Расчеты с участием понятия растворимости солей в рамках ЕГЭ
В ходе подготовки к ЕГЭ по химии постоянно приходится сталкиваться с понятием «раствор». Обычно под этим словом подразумевают абсолютно однородную на любом уровне, гомогенную смесь веществ. Растворы бывают самые разные по агрегатному состоянию, но в рамках экзаменов встречаем в основном растворы жидкие. Среда, в которой что-то растворяем, в таком случае будет жидкостью. Давайте введем сразу несколько понятий, которые пригодятся в дальнейшем.
Растворитель – жидкость, которая выполняет роль среды, в которой что-то растворяют. В рамках задач ЕГЭ и ДВИ практически всегда используют воду.
Растворенное вещество – вещество, которое добавили в растворитель, и оно с ним полностью смешалось. Может быть в любом агрегатном состоянии.
Растворимость – способность вещества смешиваться с растворителем. Также под растворимостью понимают массу вещества, которое может раствориться в определенной массе раствора при данных условиях.
Разбавленный раствор – раствор, содержание растворителя в котором значительно превышает содержание растворенного вещества. Например, 0,1%-ный раствор хлорида натрия.
Концентрированный раствор – раствор, содержание растворенного вещества в котором сопоставимо или превышает содержание растворителя. Например, 65%-ный раствор азотной кислоты.
Насыщенный раствор – раствор, в котором больше нельзя растворить такое вещество. Достигнут предел по растворимости.
Пересыщенный раствор – неустойчивая система, в которой содержание растворенного вещества превышает растворимость при данных условиях. На экзаменах не встречается.
В расчетных задачах ЕГЭ или ДВИ часто фигурирует растворимость тех или иных веществ. Она зависит от многих факторов. Например, природы растворителя и растворенного вещества. Очень важным фактором является температура. Для подавляющего большинства солей растворимость в воде больше при высокой температуре и меньше при низкой. Например, у хлорида калия при 80˚С растворимость равна 51,3 г/100 г воды, а при 0˚С уже станет 28 г/100 г воды. Растворимость является индивидуальной физико-химической характеристикой вещества. Итого можно отметить следующие факты, значимые для решения задач:
- Растворимость вещества при определенных условиях является постоянной величиной и приведена в качестве справочного данного.
- Растворимость при заданной температуре обычно приводится в формате массы растворенного вещества в 100 г чистого растворителя (воды). Не раствора, а именно чистого растворителя!
- Горячий насыщенный раствор содержит больше растворенного вещества, чем холодный.
- При охлаждении горячего насыщенного раствора из него начнет выпадать избыток растворенного вещества до достижения значения растворимости при более низкой температуре.
- Избыток растворенного вещества может выпасть как в безводном состоянии, так и в виде кристаллогидрата. Во втором случае он уносит с собой часть растворителя.
Рассмотрим основные расчетные приемы с участием растворимости.
Задача №1
Растворимость хлорида калия при 0˚С равна 28 г/100 г воды. Вычислите массовую долю соли в таком растворе.
Решение:
Пусть было 28 г соли и 100 г воды. Тогда можно найти массу раствора:
m(p-pa) = m(соли) + m(воды) = 28 + 100 = 128 г
Вычислим массовую долю соли в растворе:
ω(соли) = m(соли)/m(p-pa)·100% = 28/128·100% = 21,88%
Ответ: 21,88%
Задача №2
Вычислите растворимость сульфата аммония при 20˚С, если массовая доля соли в его насыщенном растворе при данной температуре равна 42,86%. Плотность раствора равна 1,25 г/мл.
Решение:
Пусть было 100 мл раствора. Тогда можно вычислить его массу:
m(p-pa) = ρ(p-pa)·V(p-pa) = 1,25·100 = 125 г
Далее вычислим массу соли и воды в растворе:
m(соли) = m(p-pa)·ω(соли)/100% = 125·42,86%/100% = 53,58 г
m(воды) = m(p-pa) — m(соли) = 125 – 53,58 = 71,42 г
Растворимость соли на 100 г воды можно найти по пропорции:
53,58 г соли – 71,42 г воды
х г соли – 100 г воды
х = 53,58·100/71,42 = 75 г
Ответ: 75 г/100 г воды.
Задача №3
Насыщенный при 20˚С раствор нитрата бария массой 218 г нагрели до 60˚С. Вычислите массу соли, которую можно дополнительно растворить в горячем растворе, если растворимость нитрата бария при 20˚С равна 9 г/100 г воды, а при 60˚С – 20 г/100 г воды.
Решение:
Вычислим массы соли и воды в изначальном растворе:
9 г соли – 109 г раствора
х г соли – 218 г раствора
х = 18 г
m1(соли) = 18 г
m(воды) = m(p-pa) – m1(соли) = 218 – 18 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 60˚С:
20 г соли – 100 г воды
х г соли – 200 г воды
х = 40 г
m2(соли) = 40 г
Найдем массу соли, которую можно дополнительно растворить в горячем растворе:
Δm = m2(соли) — m1(соли) = 40 – 18 = 22 г
Ответ: 22 г.
Задача №4
Рассчитайте массу безводной соли, которая получится при охлаждении до 10˚С насыщенного при 80˚С раствора дихромата аммония массой 430 г. Растворимость соли при 80˚С равна 115 г/100 г воды, а при 10˚С – 25,5 г/100 г воды.
Решение:
Вычислим массу соли и воды в исходном растворе:
115 г соли – 215 г раствора
х г соли – 430 г раствора
х = 230 г
m1(соли) = 230 г
m(воды) = m(p-pa) – m1(соли) = 430 – 230 = 200 г
Далее вычислим, сколько соли может раствориться в имеющемся количестве воды при 10˚С:
25,5 г соли – 100 г воды
х г соли – 200 г воды
х = 51 г
m2(соли) = 51 г
Найдем массу соли, которая выпадет при охлаждении горячего раствора:
Δm = m1(соли) – m2(соли) = 230 – 51 = 179 г
Ответ: 179 г.
Задача №5
При охлаждении до 0˚С 31 г горячего насыщенного раствора сульфата меди (II) в осадок выпал медный купорос (CuSO4·5H2O). Определите массу образовавшегося кристаллогидрата, если растворимость сульфата меди (II) при 80˚С равна 55 г/100 г воды, а при 0˚С равна 15 г/100 г воды.
Решение:
Выразим массовую долю сульфата меди в составе медного купороса:
ω(CuSO4) = m(CuSO4)/m(CuSO4·5H2O)·100% = М(CuSO4)/М(CuSO4·5H2O)·100%
ω(CuSO4) = 160/250·100% = 64% или 0,64
Пусть масса осадка была х г. Тогда в его составе оказалось 0,64х г безводной соли. Вычислим массу безводной соли в изначальном растворе:
55 г соли – 155 г раствора
у г соли – 31 г раствора
у = 11
m1(соли) = 11 г
При охлаждении часть безводной соли перешла в состав кристаллогидрата. Охлажденный раствор по растворимости должен соответствовать справочным данным. Можно записать это так:
(11 – 0,64х)/(31 – х) = 15/115
115·(11 – 0,64х) = 15·(31 – х)
1265 – 73,6х = 465 – 15х
800 = 58,6х
х = 13,65 г
Ответ: 13,65 г.
«Методика решения задач на растворимость и массовую долю вещества
в растворе».
Выполнена учителем химии МБОУ СОШ № 18 г. Ногинска Московской области Ломать
Светланой Петровной.
1. Растворимость – это способность вещества растворяться в воде или другом
растворителе. Количественно растворимость определяют коэффициентом
растворимости или просто растворимостью вещества.
Растворимость вещества X (s) – это масса вещества, которая может раствориться
при данных условиях в 100г растворителя с образованием насыщенного раствора:
S= m(x) / m(H
2
O) × 100 (г).
Массовая доля безводного вещества Х в насыщенном растворе связана с его
растворимостью соотношением:
W(X) = s / s +100
Для вычисления массы безводного вещества в определенной массе насыщенного
раствора можно вывести формулу:
W(x) = m(x) / m(р–ра) => m(x) / m(р–ра)= s / s + 100 ; откуда
m (x) = (s / s + 100 ) ∙ m(р–ра).
Пример 1. Определите, какая масса нитрата бария может раствориться в воде
объемом 500 мл при 30
0
С. Растворимость нитрата бария при данной температуре
составляет 14,2 г.
Решение:
Плотность воды составляет 1 г/мл, поэтому
m(Н
2
О) = 500 ∙ 1 = 500 г.
Определяем массу нитрата бария.
По формуле: s = m(Ba(NO
3
)
2
) / m(H
2
O) ∙ 100 =>
m(Ba(NO
3
)
2
) = s ∙ m(H
2
O) / 100 = 14,2 ∙ 500 / 100 = 71г.
Ответ: m(Ba(NO
3
)
2
) =71 г.
Пример 2. Массовая доля хлорида аммония в насыщенном растворе при 30
0
С
. равна 29,5%. Определите растворимость NH
4
Cl при данной температуре.
Решение:
1. Вычисляем массу соли в растворе массой 100г:
m(NH
4
Cl) = m(р–ра) ∙ w(NH
4
Cl) = 100 ∙ 0,295 = 29,5 г.
2. Находим массу воды в растворе массой 100 г:
m(H
2
O) = m(р–ра) – m(NH
4
Cl) = 100 -29,5 =70,5 г
3. Определяем растворимость NH
4
Cl.
S
30
= m(NH
4
Cl) / m(H
2
O) ∙ 100 = 29,5 / 70,5 ∙ 100 = 41,84 г.
Ответ: S
30
= 41,84 г.
Пример 3. Вычислите, какая масса нитрата калия выпадет в осадок, если 100 г
. насыщенного при температуре 70
0
С раствора KNO
3
охладить до температуры 0
0
С.
. Растворимость нитрата калия составляет 138г при t
0
=70
0
и 13,3г при t
0
ρ=0
0
C.
Решение:
1. Находим массу соли в насыщенном растворе массой 100 г при 70
0
С.
По формуле: s
70
= m
70
(KNO
3
) / m(H
2
O) ∙ 100 = m
70
(KNO
3
) / (m(р–ра) – m
70
(KNO
3
))
∙100 => m
70
(KNO
3
) = (s
70
∙ (m(р–ра) – m
70
(KNO
3
)) / 100 = 138 ∙ ( 100 – m
70
(KNO
3
)) /
100 ; отсюда m
70
(KNO
3
) = 57, 98 г.
2. Находим массу воды в насыщенном растворе массой 100 г:
m(H
2
O) = m(р–ра) – m
70
(KNO
3
) = 100 – 57,98 = 42,02 г.
3. Находим массу соли, выпавшей в осадок:
m( осадка KNO
3
) = m
70
(KNO
3
) – m
0
(KNO
3
) = 57,98 – 5,59 = 52,39 г.
Ответ: m(осадка KNO
3
) = 52,39 г.
2. Массовая доля растворенного вещества – это отношение массы растворенного
вещества к общей массе раствора:
W(раств.в–ва) = m(раств.в–ва) / m(р–ра) ( в долях единицы), откуда
m(раств.в–ва) = m(р–ра) ∙ w(раств.в–ва);
W(раств.в–ва) = m(раств.в–ва) / m(р–ра) ∙ 100% ( в процентах).
Эта формула указывает массу безводного вещества, содержащегося в 100 г
раствора. Раствор состоит из растворенного вещества и растворителя.
m(р–ра) = m(раств.в–ва) + m(H
2
O)
W(раств.в–ва) = m(раств.в–ва) / (m(раств.в–ва) + m(H
2
O))/
Массу раствора можно выразить через объем раствора (V)и его плотность (ρ): m(р–
ра) = V ∙ ρ. Откуда:
W(раств.в–ва) = m(раств.в–ва) / V ∙ ρ ;
m(раств.в–ва) = V ∙ ρ ∙ w(раств.в–ва).
Пример 1. Определите массовую долю (%) соли в растворе, полученном при
растворении 50 г соли в 200 г воды.
Решение:
W(соли) = m(соли) / (m(соли) + m(H
2
O) = 50 / (50+ 200) = 0,2 или 20%
Ответ: W(соли) =0,2 или 20%.
Пример 2. Вычислите массу гидроксида калия в растворе объемом 600 мл и
плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10% .
Решение:
W(KOH) = m(KOH) / V∙ ρ;
m(KOH) = w(KOH) ∙ V ∙ ρ = 0,1 ∙ 600 ∙ 1,082 = 64,92 (г).
Ответ: m(KOH) = 64,92 (г).
Пример 3. Какую массу воды надо прибавить к раствору гидроксида натрия
массой 150 г с массовой долей 10%, чтобы получить раствор с массовой долей 2%?
Решение:
m
2
(р–ра) = m
1
(р–ра) + m (воды)
w
2
(NaOH) = m(NaOH) / m
2
(р–ра) = m
1
(р–ра) ∙ w
1
(NaOH) / (m
1
(р–ра) + m(H
2
O));
0,02 = 150 ∙ 0,1 / (150 + m(H
2
O); m(H
2
O) = 600г.
Ответ: m(Н
2
О) =600 г.
Пример 4. Какую массу раствора с массовой долей уксусной кислоты 40% надо
прибавить к 500 г воды для получения раствора с массовой долей уксусной
кислоты 15%?
Решение:
W
2
(CH
3
COOH) = m(р–ра) ∙ m
1
(CH
3
COOH) / (m(р–ра) + 500;
0,15 = m(р–ра) ∙ 0,4 / (m(р–ра) +500 ;
m(р–ра) = 300 г.
Ответ: m(р–ра) = 300 г.
Пример 5. Какой объем раствора с массовой долей гидроксида калия 50% (
плотностью 1,538 г/ мл) требуется для приготовления 3 л раствора гидроксида
калия с массовой долей 6% ( плотностью 1,048 г/мл)?
Решение:
W
2
(KOH) = V
1
∙ ρ
1
∙ w
1
(KOH) / V
2
∙ ρ
2
;
0,06 = 0,5 ∙ 1,538 ∙ V
1
/ 3000 ∙ 1,048;
0,06 ∙ 3000 ∙ 1,048 = 0,5 ∙ 1,538 ∙ V
1
;
V
1
= 245,3 мл.
Ответ: V
1
= 245,3 мл.
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор


Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.

Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
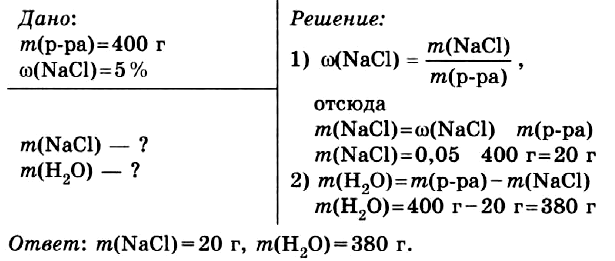
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради

Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
 Сегодня у нас урок по химии 60 – Задачи на растворимость. Как изучить? Полезные советы и рекомендации – повторите предыдущие уроки химии. Особенное внимание обратите на уроки по химии, посвященные растворам, коэффициенту растворимости.
Сегодня у нас урок по химии 60 – Задачи на растворимость. Как изучить? Полезные советы и рекомендации – повторите предыдущие уроки химии. Особенное внимание обратите на уроки по химии, посвященные растворам, коэффициенту растворимости.
- Сколько граммов бертолетовой соли выкристаллизуется из 70 г. насыщенного при 80 ºС раствора при охлаждении его до 10 ºС? Растворимость соли при 80 ºС – 40 г., а при 10 ºС – 5 г.
Решение
Если нет специальных оговорок, растворимость показывает массу вещества, которое может раствориться в 100 г растворителя.
Первый метод: По условию задачи, растворимость соли при 80 ºС – 40 г., а при 10 ºС – 5 г. Это значит, что 140 г. раствора при 80 ºС содержит 40 г. бертолетовой соли. Найдем массы соли и воды в 70 г. насыщенного при 80 ºС раствора. Для этого составим пропорцию:
140 г. раствора содержит 40 г. KClO3
70 г. » » х г. »
х = 70 ⃰ 40/140 = 20 г. KClO3. Масса воды будет 70 – 20 = 50 г. Н2О.
Теперь найдем, сколько г. KClO3 может раствориться в 50 г. Н2О при 10 ºС:
100 г. Н2О растворяет 5 г. KClO3
50 г. » » х г. »
х = 50 ⃰ 5/100 = 2,5 г. KClO3.
Значит, из раствора выкристаллизуется: 20 – 2,5 = 17,5 г. KClO3.
Второй метод: Разность масс растворимостей при разных температурах равна: 40 – 5 = 35 г. Тогда можно составить пропорцию:
из 140 г. раствора выпадает 35 г. KClO3
из 70 г. » » х г. »
х = 70 ⃰ 35/140 = 17,5 г. KClO3.
Ответ: 17,5.
- Растворимость нитрата калия при 60 ºС равна 110 г., а при 0 ºС — 15 г. Сколько граммов соли выпадет в осадок, если 840 г. насыщенного при 60 ºС раствора охладить до 0 ºС?
Решение
Задача решается аналогично предыдущей.
Ответ: 380.
- Для очистки калийной селитры 300 г. ее растворили при нагревании в 200 г. воды. Сколько грамм селитры выделится, если охладить раствордо 10 ºС? Растворимость калийной селитры в воде при 10 ºС равна 22 г.
Решение
Найдем, сколько г. KNO3 может раствориться в 200 г. Н2О при 0 ºС:
100 г. Н2О растворяет 22 г. KNO3
200 г. » » х г. »
х = 200 ⃰ 22/100 = 44 г. KNO3.
Значит, из раствора выделится: 300 – 44 = 256 г. KNO3.
Ответ: 256.
- Сколько граммов хлорида аммония содержалось в 405 г. раствора при 15 ºС, если растворимость этой соли при 15 ºС равна 35 г.
Решение
Найдем, сколько г. NH4Cl содержалось в 405 г. раствора при 15 ºС :
135 г. р-ра содержат 35 г. NH4Cl
405 г. » » х г. »
х = 405 ⃰ 35/135 = 105 г. NH4Cl.
Ответ: 105.
- Растворимость сульфата меди при 20 ºС равна 20 г., а при 100 ºС — 65 г. Сколько граммов сульфата меди выпадет в осадок, если охладить 825 г. раствора от100 ºС до 20 ºС?
Решение
Задача решается аналогично задаче № 1.
Ответ: 225.
- Растворимость сульфата меди при 30 ºС – 25 г. Сколько граммов кристаллогидрата меди CuSO4*5H2O пойдет на получение 500 г. насыщенного раствора сульфата меди при этой температуре?
Решение
Задача отличается от предыдущих тем, что кристаллогидрат содержит связанную воду. Ее надо учитывать, так-как она увеличивает массу воды в растворе.
Грамм-молекулярная масса CuSO4*5H2O составляет 250 г. На долю CuSO4 приходится 160 г., на долю 5 молей воды – 90 г.
Найдем массу CuSO4 в 500 г. насыщенного раствора при 30 ºС:
125 г. р-ра содержат 25 г. CuSO4
500 г. » » х г. »
х = 500 ⃰ 25/125 = 100 г. CuSO4
Найдем массу CuSO4*5H2O, в которой содержится 100 г. CuSO4:
250 г. CuSO4*5H2O содержат 160 г. CuSO4
х г. » » 100 г. »
х = 250 ⃰ 100/160 = 156,25 г. CuSO4*5H2O
Нам осталось найти массу воды, которую надо добавить к 156,25 г. CuSO4*5H2O, чтобы получить 500 г. насыщенного раствора сульфата меди: 500 р-ра — 156,25 г. CuSO4*5H2O = 343,75 г. H2O
Ответ: 343,75.
- Сколько граммов карбоната калия выпадет в осадок из 765 г. насыщенного при 100 ºС раствора при охлаждении его до 0 ºС, если в 100 г. растворителя при 100 ºС растворяется 155 г. соли, а при 0 ºС – 111 г?
Решение
Задача решается аналогично задаче № 1.
Ответ: 132.
- Сколько граммов нитрата аммония выделилось в твердую фазу из 200 г. насыщенного при 80 ºС раствора, если охладить его до 15 ºС? Растворимость соли при 80 ºС– 180 г., а при 15 ºС — 138 г.
Решение
Задача решается аналогично задаче № 1.
Ответ: 30.
- При выпаривании досуха 380 г. насыщенного при 50 ºС раствора нитрата калия было получено 180 г. нитрата калия. Вычислить растворимость соли в 100 г. воды при 50 ºС.
Решение
Найдем массу воды: 380 – 180 = 200 г. Составим пропорцию:
200 г. Н2О растворяет 180 г. KNO3
100 г. » » х г. »
х = 100 ⃰ 180/200 = 90 г. KNO3.
Ответ: 90.
10. Сколько граммов хлорида алюминия выделится из насыщенного при 50 ºС раствора массой 600 г., если охладить его до 0 ºС? Растворимость хлорида алюминия равна при 50 ºС – 50 г., а при 0 ºС — 29,8 г.
Решение
Задача решается аналогично задаче № 1.
Ответ: 80,8.
11. Вычислить растворимость хлорида бария при 0 ºС, если при этой температуре в 13,1 г. насыщенного раствора содержится 3,1 г. хлорида бария.
Решение
Задача решается аналогично задаче № 9.
Ответ: 31.
12. Вычислить растворимость сульфата калия в воде, если 54 г. его насыщенного при 0 ºС раствора содержат 4 г. соли.
Задача решается аналогично задаче № 9.
Ответ: 8.
13. Имеется 381 г. насыщенного при 40 ºС раствора нитрата калия. Сколько грамм соли выкристаллизуется при охлаждении раствора до 30 ºС, если растворимость нитрата калия при 30 ºС равна 19 г., а при 40 ºС — 27 г.?
Решение
Задача решается аналогично задаче № 1.
Ответ: 24.
14. Сколько граммов насыщенного раствора было взято, если при охлаждении его от 100 до 20 ºС выкристаллизовалось 132 г. соли? Растворимость соли при 100 ºС равна 52 г., а при 20 ºС – 8 г.
Решение
Задача решается аналогично задаче № 1.
из 152 г. раствора выпадает 44 г. соли
из х г. » » 132 г. »
х = 152 ⃰ 132/44 = 456 г.
Ответ: 456.
15. В 56,5 г. насыщенного при 35 ºС раствора содержится 6,5 г. сульфата калия. Определить его растворимость.
Решение
Задача решается аналогично задаче № 1.
50 г. воды растворяет 6,5 г. K2SO4
100 г. » » х г. »
х = 100 ⃰ 6,5/50 = 13 г.
Ответ: 13.
- Растворимость нитрата натрия по отношению к массе раствора равна 40 %. Сколько граммов воды потребуется для растворения 500 г. нитрата натрия?
Решение
В данном случае, под «растворимостью» следует понимать то, что в каждых 60 г. воды растворяется 40 г. вещества (40 %-й раствор). Поэтому, составим пропорцию:
60 г. воды растворяют 40 г. NaNO3
х г. » » 500 г. »
х = 500 ⃰ 60/40 = 750 г.
Ответ: 750.
- Насыщенный при 20 ºС растворнитрата кальциясодержит в 111,5 г. раствора 61,5 г. нитрата кальция. Определить растворимость в воде кристаллогидрата Ca(NO3)2*4H2O.
Это был у нас был урок по химии 60 – Задачи на растворимость.
Решение
Грамм-молекулярная масса Ca(NO3)2*4H2O составляет 236 г. На долю Ca(NO3)2 приходится 164 г., на долю 4 молей воды – 72 г.
Найдем количества молей Ca(NO3)2 и Ca(NO3)2*4H2O:
n(Ca(NO3)2) = n(Ca(NO3)2*4H2O) = 61,5/164 = 0,375 моль.
Найдем массу 0,375 моль Ca(NO3)2*4H2O:
m(Ca(NO3)2*4H2O) = 0,375 *236 = 88,5 г.
Масса «чистой» воды без учета кристаллизационной составляет: 111,5 — 88,5 = 23 г.
Теперь найдем растворимость кристаллогидрата Ca(NO3)2*4H2O, для чего составим пропорцию:
23 г. воды растворяют 88,5 г. Ca(NO3)2*4H2O
100 г. » » х г. »
х = 100 ⃰ 88,5/23 = 384,7826 г.
Ответ: 384,7826.
Это был у нас был урок по химии 60 – Задачи на растворимость с решениями.
Подружитесь со мной:
2022-10-20 ![]()
Вычислите, какая масса нитрата калия выпадет в осадок, если 100 г насыщенного при температуре $70^{ circ } С$ раствора $KNO_{3}$ охладить до температуры $0^{ circ } С$. Растворимость нитрата калия составляет 138 г при температуре $70^{ circ } С$ и 13,3 г при температуре $0^{ circ } С$.
Решение:
При решении данного типа задач обратите внимание на то, что при охлаждении насыщенного раствора происходит выпадение осадка из-за уменьшения растворимости вещества. Масса воды при этом остается постоянной, если соль не образует кристаллогидрата.
Находим массу соли в насыщенном растворе массой 100 г при $70^{ circ} С$.
По формуле
$s^{70} = frac{m^{70}(KNO_{3})}{m(H_{2}O )} cdot 100 = frac{m^{70}(KNO_{3} )}{m(р-ра) – m^{70}(KNO_{3})} cdot 100 Rightarrow m^{70}(KNO_{3} ) = frac{s^{70} cdot (m(р-ра) – m^{70}(KNO_{3} ) ) }{100} = frac{138 cdot (100 – m^{70}(KNO_{3})}{100}$,
отсюда $m^{70}(KNO_{3}) = 57,98 г$.
Или по формуле
$m^{70} (KNO_{3} ) = frac{s^{70} cdot m(р-ра) }{s^{70} + 100 } = frac{138 cdot 100}{138 + 100} = 57,98 г$.
Находим массу воды в насыщенном растворе массой 100 г:
$m(H_{2}O) = m(р-ра) – m^{70}(KNO_{3}) = 100 – 57,98 = 42,02 г$.
Находим массу соли в растворе при $0^{ circ } С$:
$s^{0} = frac{m^{0}(KNO_{3} )}{m(H_{2}O )} cdot 100 Rightarrow m^{0} (KNO_{3} ) = frac{s^{0} cdot m(H_{2}O ) }{100} = frac{13,3 cdot 42,02}{100} = 5,59 г$.
Находим массу соли, выпавшей в осадок:
$m(осадка : KNO_{3}) = m^{70}(KNO_{3}) – m^{0}(KNO_{3}) = 57,98 – 5,59 = 52,39 г$.
Ответ: $m(осадка : KNO_{3}) = 52,39 г$.
