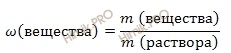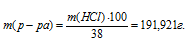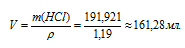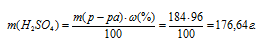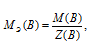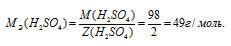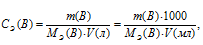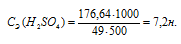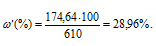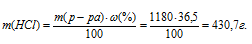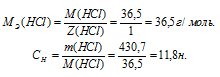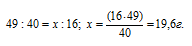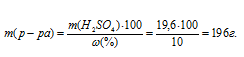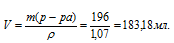Раствор соляной кислоты (HCl) объемом 1,8 мл (плотность 1,18 г/мл) с массовой долей вещества 36 процентов, разбавили водой до 1 литра. Найти pH раствора полученного?
Решение задачи
Запишем уравнение диссоциации соляной кислоты:
Вычислим массу 1,8 мл 36-процентного раствора соляной кислоты (HCl).
Найдем, массу раствора соляной кислоты (HCl) по формуле, устанавливающей связь между массой и объемом раствора:
m = 1,18 г/мл ∙ 1,8 мл = 2,124 (г).
Найдем, сколько в растворе содержится соляной кислоты (HCl) (в г). Для расчета будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Откуда выразим m (вещества):
Получаем:
m (HCl) = 2,124 ∙ 0,36 = 0,765 (г).
Если раствор соляной кислоты (HCl) 36-процентный, то массовая доля соляной кислоты (HCl) в нем 0,36.
Учитывая, что молярная масса соляной кислоты (HCl) равна 36,5 г/моль, рассчитаем химическое количество соляной кислоты (HCl) в растворе, используя формулу, которая устанавливает связь между химическим количеством вещества и массой:
Получаем:
n (HCl) = 0,765/36,5 = 0,021 (моль).
Учитывая, что объем раствора разбавили водой (H2O) до 1 л, найдем молярную концентрацию раствора соляной кислоты (HCl) по формуле:
Молярная концентрация показывает количество растворенного вещества (моль), содержащегося в 1 л раствора.
Получаем:
По уравнению диссоциации вычислим, сколько моль ионов водорода (H+)образуется при полной диссоциации 0,021 моль раствора соляной кислоты (HCl):
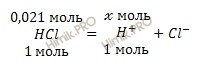
при диссоциации 0,021 моль HCl образуется моль ионов H+
Откуда:
Следовательно, концентрация ионов водорода ([H+]) равна 0,021 моль.
Вычислим pH раствора соляной кислоты (HCl) по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
Получаем:
Ответ:
pH раствора 1,678.
Похожие задачи
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
m(H2SO4) = w(H2SO4) ∙ m(р-ра H2SO4)/100% = 147 г ∙ 20% /100% = 29,4 г
2) Рассчитаем количество вещества (моль) серной кислоты:
n(H2SO4) = m(H2SO4) / M(H2SO4) = 29,4 г/98 г/моль = 0,3 моль.
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
можем записать:
n(BaSO4) = n(H2SO4) ∙ k(H2SO4)/k(BaSO4) = 0,3 моль ∙ 1/1 = 0,3 моль
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
FeS + 2HCl = FeCl2 + H2S↑
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
Следовательно:
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Автор: С.И. Широкопояс https://scienceforyou.ru/
Как правильно производить расчеты по приготовлению растворов
Задача 435.
Сколько миллилитров концентрированной соляной кислоты (p = 1,19 г/мл), содержащей 38% (масс.) НСI, нужно взять для приготовления 1 л 2н. раствора?
Решение:
M(НСI) = MЭ(НСI) = 36,5 г/моль.
Рассчитаем массу НСI в 1 л 2 н раствора её: 2 . 36,5 = 72,93 г.
Рассчитаем массу 38%-ного раствора по формуле:
где

Тогда
Объём раствора, который необходимо взять для приготовления 1 л 2 н раствора рассчитаем по формуле:
m(p-pa) = p . V,
где p – плотность, а V – объём раствора, получим:
Ответ: 161,28 мл.
Задача 436.
К 100 мл 96%-ной (по массе) H2SO4 (плотность 1,84 г/мл) прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Вычислить его эквивалентную концентрацию и массовую долю H2SO4.
Решение:
Массу раствора 100 мл 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где p – плотность, а V – объём раствора, получим:
m(p-pa) = 1,84 . 100 = 184 г.
Массу серной кислоты в данном растворе находим по формуле:
где

Тогда
Рассчитаем массу раствора полученного при смешении 100 мл 96%-ного раствора с 400 мл воды, получим:
m’(p-pa) = (100 + 400) . 1,220 = 610 г.
Определим молярную массу эквивалента H2SO4 из соотношения:
MЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(B) – эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 – 2.
Отсюда
Тогда эквивалентную концентрацию раствора найдём по формуле:
где
m(B)- масса растворённого вещества, MЭ(В) – молярная масса эквивалента растворённого вещества, V – объём раствора (в л или мл).
Отсюда
Рассчитаем массовую долю полученного раствора:
Ответ: 7,2н; 28,96%.
Задача 437.
Рассчитать нормальность концентрированной соляной кислоты (плотность 1,18г/мл), содержащей 36,5% (масс.) НСI.
Решение:
Массу 96%-ного раствора найдём по формуле:
m(p-pa) = p . V,
где p – плотность, а V – объём раствора, получим:
m(p-pa) = 1,18 . 1000 = 1180 г.
Рассчитаем массу соляной кислоты в растворе по формуле:
где

Тогда
Определим молярную массу эквивалента HCl из соотношения:
MЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(B) – эквивалентное число; Z(кислоты) равно числу ионов Н+, H2SO4 → 2.
Отсюда
Ответ: 11,8н.
Задача 438.
Какой объем 10%-ной (по массе) серной кислоты (p = 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16,0 г NaOH?
Решение:
Уравнение реакции нейтрализации раствора NaOH раствором H2SO4 имеет вид:
H2SO4 + 2NaOH ↔ Na2SO4 + 2H2O
Из уравнения реакции следует, что на нейтрализацию 1 моля NaOH затрачивается 0,5 молей NaOH, значит, эквивалентная масса серной кислоты в данной реакции равна 49 г/моль (М/2 = 98/2 = 49).
Теперь рассчитаем массу серной кислоты, необходимую для нейтрализации 16 г NaOH из пропорции:
Массу раствора, содержащего 19,6 г H2SO4, рассчитаем по формуле:
где

Тогда
Объём раствора рассчитаем по формуле:
m(p-pa) = p . V,
где – плотность, а V – объём раствора, получим:
Ответ: 183,18 мл.
-
Дано:
w (HCl) – 35%
m р-ра (HCl) – 200 г
Найти:
m (HCL) – ?
Решение:
m в-ва = m р-pа * w / 100%
m в-ва (HCL) = 200 г * 35% / 100% = 70 г
Ответ: масса вещества HCL 70 грамм
- Комментировать
- Жалоба
- Ссылка
-
Найди верный ответ на вопрос ✅ «Какова масса соляной кислоты в растворе массой 200 г с массовой долей 35% …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Какова масса соляной кислоты в растворе массой 200 г с массовой долей 35%