Цель работы состоит в приготовлении раствора с заданной массовой долей путём растворения рассчитанной массы твёрдого вещества в определённом объёме воды.Рассчитайте массу твёрдого вещества, необходимого для приготовления раствора, в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твёрдого вещества и перенесите его в химический стакан.
Рассчитайте массу воды, необходимой для приготоления раствора. Поскольку плотность воды равна 1 г/мл, рассчитанная вами масса воды численно равна её объёму. С помощью мерного цилиндра отмерьте вычисленный объём воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
Таблица 3
Варианты заданий для выполнения практической работы №3
| Вариант | Растворенное вещество | Масса раствора, г | Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Сода питьевая | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |
reshalka.com
ГДЗ учебник по химии 7 класс Габриелян. Практическая работа №3. Номер №1
Решение
1 вариант
Дано:
m (раствора) = 80 г
w (поваренной соли) = 10% = 0,1
Найти:
m (поваренной соли) = ?
m (
H
2
O
) = ?
Решение:
m (поваренной соли) = m (раствора) * w (поваренной соли) = 80 * 0,1 = 8 г
m (
H
2
O
) = 80 − 8 = 72 г
Ответ: m (поваренной соли) = 8 г ; m (
H
2
O
) = 72 г
2 вариант
Дано:
m (раствора) = 150 г
w (сахара) = 5% = 0,05
Найти:
m (сахара) = ?
m (
H
2
O
) = ?
Решение:
m (сахара) = m (раствора) * w (сахара) = 150 * 0,05 = 7,5 г
m (
H
2
O
) = 150 − 7,5 = 142,5 г
Ответ: m (сахара) = 7,5 г ; m (
H
2
O
) = 142,5 г
3 вариант
Дано:
m (раствора) = 50 г
w (питьевой соды) = 2% = 0,02
Найти:
m (питьевой соды) = ?
m (
H
2
O
) = ?
Решение:
m (питьевой соды) = m (раствора) * w (питьевой соды) = 50 * 0,02 = 1 г
m (
H
2
O
) = 50 − 1 = 49 г
Ответ: m (питьевой соды) = 1 г ; m (
H
2
O
) = 49 г
4 вариант
Дано:
m (раствора) = 70 г
w (натриевой селитры) = 10% = 0,1
Найти:
m (натриевой селитры) = ?
m (
H
2
O
) = ?
Решение:
m (натриевой селитры) = m (раствора) * w (натриевой селитры) = 70 * 0,1 = 7 г
m (
H
2
O
) = 70 − 7 = 63 г
Ответ: m (натриевой селитры) = 7 г ; m (
H
2
O
) = 63 г
Рассчитайте массу твёрдого вещества и воды, необходимых для приготовления раствора 1. Зная, что плотность воды равна 1 г/мл, рассчитайте объём воды, необходимый для приготовления раствора. Взвесьте твёрдое вещество в соответствии с рассчитанной массой и перенесите в химический стакан. Мерным цилиндром отмерьте вычисленный объём воды и прилейте его к веществу в химическом стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Приготовленный раствор отдайте учителю.
|
Вариант |
Растворённое вещество |
Раствор 1 |
Раствор 2 |
Раствор 3 |
|---|---|---|---|---|
|
1 |
Хлорид натрия |
50 г, 10%-ный |
6%-ный |
8%-ный |
|
2 |
Хлорид натрия |
30 г, 20%-ный |
8%-ный |
12%-ный |
|
3 |
Карбонат натрия |
70 г, 5%-ный |
4%-ный |
6%-ный |
|
4 |
Карбонат натрия |
80 г, 8%-ный |
6%-ный |
10%-ный |
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор
Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.
Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Задача № 1.
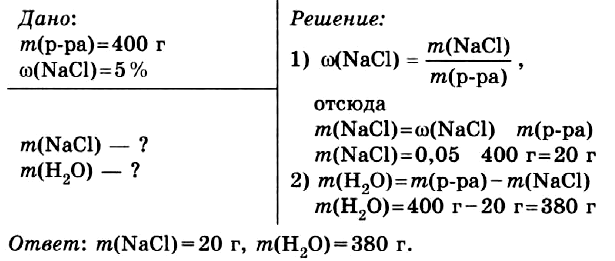
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради
Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради
Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2019 ПРАКТИЧЕСКАЯ РАБОТА №6 Приготовление раствора с заданной массовой долей растворённого вещества.
Красным цветом приводится решение, а фиолетовым ― объяснение.
Варианты задания для выполнения практической работы
| Вариант | Растворённое вещество | Раствор 1 | Раствор 2 | Раствор 3 |
| 1 | Хлорид натрия | 50 г, 10%-ный | 6%-ный | 8%-ный |
| 2 | Хлорид натрия | 30 г, 20%-ный | 8%-ный | 12%-ный |
| 3 | Карбонат натрия | 70 г 5%-ный | 4%-ный | 6%-ный |
| 4 | Карбонат натрия | 80 г 8%-ный | 6%-ный | 10%-ный |
ПРИГОТОВЛЕНИЕ РАСТВОРА 1.
1. Рассчитайте массу твёрдого вещества и воды, необходимых для приготовления раствора 1. Зная, что плотность воды равна 1 г/мл, рассчитайте объём воды, необходимый для приготовления раствора.
Вариант 1
Дано: m1(раствора)=50 г, ω1(NaCl)=10%, ρ(H2O)=1 г/мл
Найти: m1(NaCl)-?, m(H2O)-?
Решение:
m1(NaCl)=m1(раствора)•ω1(NaCl):100%=50 г•10%:100%=5 г
m(H2O)=m1(раствора)-m1(NaCl)=50 г – 5 г=45 г
V(H2O)=m(H2O)/ρ(H2O)=45 г : 1 г/мл=45 мл
Вариант 2
Дано: m1(раствора)=30 г, ω1(NaCl)=20%, ρ(H2O)=1 г/мл
Найти: m1(NaCl)-?, m(H2O)-?
Решение:
m1(NaCl)=m1(раствора)•ω1(NaCl):100%=30 г•20%:100%=6 г
m(H2O)=m1(раствора)-m1(NaCl)=30 г – 6 г=24 г
V(H2O)=m(H2O)/ρ(H2O)=24 г : 1 г/мл=24 мл
Вариант 3
Дано: m1(раствор)=70 г, ω1(Na2CO3)=5%, ρ(H2O)=1 г/мл
Найти: m1(Na2CO3)-?, m(H2O)-?
Решение:
m1(Na2CO3)=m1(раствора)•ω1(Na2CO3):100%=70 г•5%:100%=3,5 г
m(H2O)=m1(раствора)-m1(Na2CO3)=70 г – 3,5 г=66,5 г
V(H2O)=m(H2O)/ρ(H2O)=66,5 г : 1 г/мл=66,5 мл
Вариант 4
Дано: m1(раствор)=80 г, ω1(Na2CO3)=8%, ρ(H2O)=1 г/мл
Найти: m1(Na2CO3)-?, m(H2O)-?
Решение:
m1(Na2CO3)=m1(раствора)•ω1(Na2CO3):100%=80 г•8%:100%=6,4 г
m(H2O)=m1(раствора)-m1(Na2CO3)=80 г – 6,4 г=73,6 г
V(H2O)=m(H2O)/ρ(H2O)=73,6 г : 1 г/мл=73,6 мл
2. Взвесьте твёрдое вещество в соответствии с рассчитанной массой и перенесите в химический стакан.
Вариант 1 5 г хлорид натрия
Вариант 2 6 г хлорид натрия
Вариант 3 3,5 г карбоната натрия
Вариант 4 6,4 г карбоната натрия
3. Мерным цилиндром отмерьте вычисленный объём воды и прилейте его к веществу в химическом стакане.
Вариант 1 45 мл воды
Вариант 2 24 мл воды
Вариант 3 66,5 мл воды
Вариант 4 73,6 мл воды
Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
4. Приготовленный раствор отдайте учителю.
ПРИГОТОВЛЕНИЕ РАСТВОРА 2
Рассчитайте массу воды, которую необходимо добавить к раствору 1 , чтобы получить раствор 2 меньшей концентрации. Рассчитайте объём воды.
Вариант 1
Дано: m1(раствора)=50 г, ω1(NaCl)=10%, ρ(H2O)=1 г/мл, ω2(NaCl)=6%
Найти: m(H2O)-?
Решение:
m1(NaCl)=m1(раствора)•ω1(NaCl):100%=50 г•10%:100%=5 г
m2(раствора)=(m1(NaCl):ω2(NaCl))•100%=(5 г:6%)•100%=83,3 г
m(H2O)=m2(раствора)-m1(раствора)=83,3 г – 50 г=33,3 г
V(H2O)=m(H2O)/ρ(H2O)=33,3 г:1 г/мл=33,3 мл
Вариант 2
Дано: m1(раствора)=30 г, ω1(NaCl)=20%, ρ(H2O)=1 г/мл, ω2(NaCl)=8%
Найти: m(H2O)-?
Решение:
m1(NaCl)=m1(раствора)•ω1(NaCl):100%=30 г•20%:100%=6 г
m2(раствора)=(m1(NaCl):ω2(NaCl))•100%=(6 г:8%)•100%=75 г
m(H2O)=m2(раствора)-m1(раствора)=75 г – 30 г=45 г
V(H2O)=m(H2O)/ρ(H2O)=45 г:1 г/мл=45 мл
Вариант 3
Дано: m1(раствора)=70 г, ω1(Na2CO3)=5%, ρ(H2O)=1 г/мл, ω2(Na2CO3)=4%
Найти: m(H2O)-?
Решение:
m1(Na2CO3)=m1(раствора)•ω1(Na2CO3):100%=70 г•5%:100%=3,5 г
m2(раствора)=(m1(Na2CO3):ω2(Na2CO3))•100%=(3,5 г:4%)•100%=87,5 г
m(H2O)=m2(раствора)-m1(раствора)=87,5 г – 70 г=17,5 г
V(H2O)=m(H2O)/ρ(H2O)=17,5 г:1 г/мл=17,5 мл
Вариант 4
Дано: m1(раствора)=80 г, ω1(Na2CO3)=8%, ρ(H2O)=1 г/мл, ω2(Na2CO3)=6%
Найти: m(H2O)-?
Решение:
m1(Na2CO3)=m1(раствора)•ω1(Na2CO3):100%=80 г•8%:100%=6,4 г
m2(раствора)=(m1(Na2CO3):ω2(Na2CO3))•100%=(6,4 г:6%)•100%=106,7 г
m(H2O)=m2(раствора)-m1(раствора)=106,7 г – 80 г=26,7 г
V(H2O)=m(H2O)/ρ(H2O)=26,7 г:1 г/мл=26,7 мл
Отмерьте воду с помощью мерного цилиндра и добавьте в раствор 1.
Вариант 1 33,3 мл воды
Вариант 2 45 мл воды
Вариант 3 17,5 мл воды
Вариант 4 26,7 мл воды
Какова масса раствора 2?
Вариант 1 83,3 г
Вариант 2 75 г
Вариант 3 87,5 г
Вариант 4 106,7 г
ПРИГОТОВЛЕНИЕ РАСТВОРА 3
Рассчитайте массу твёрдого вещества, которое следует добавить к раствору 2, чтобы получить раствор 3 большей концентрации.
Вариант 1
Дано: m2(раствора)=83,3 г, ω2(NaCl)=6%, ω3(NaCl)=8%,или 0,08
Найти: m(NaCl)-?
Решение:
m2(NaCl)=m2(раствора)•ω2(NaCl):100%=83,3 г•6%:100%=5 г
Пусть масса вещества, которое следует добавить, равна х г, то есть m(NaCl)=х г, тогда, подставив значения в формулу вычисления массовой доли в растворе 3: ω3(NaCl)=(m2(NaCl)+m(NaCl))/(m2(раствора)+m(NaCl)), получим алгебраическое уравнение и решим его.
0,08=(5+х)/(83,3+х)
0,08•(83,3+x)=5+х
6,664+0,08х=5+х
х-0,08х=6,664-5
0,92х=1,664
х=1,664:0,92
х=1,8, следовательно, нужно добавить m(NaCl)=1,8 г
m3(раствора)=m2(раствора)+m(NaCl)=83,3 г + 1,8 г=85,1 г
Вариант 2
Дано: m2(раствора)=75 г, ω2(NaCl)=8%, ω3(NaCl)=12%,или 0,12
Найти: m(NaCl)-?
Решение:
m2(NaCl)=m2(раствора)•ω2(NaCl):100%=75 г•8%:100%=6 г
Пусть масса вещества, которое следует добавить, равна х г, то есть m(NaCl)=х г, тогда, подставив значения в формулу вычисления массовой доли в растворе 3: ω3(NaCl)=(m2(NaCl)+m(NaCl))/(m2(раствора)+m(NaCl)), получим алгебраическое уравнение и решим его.
0,12=(6+х)/(75+х)
0,12•(75+x)=6+х
9+0,12х=6+х
х-0,12х=9-6
0,88х=3
х=3:0,88
х=3,4, следовательно, нужно добавить m(NaCl)=3,4 г
m3(раствора)=m2(раствора)+m(NaCl)=75 г + 3,4 г=78,4 г
Вариант 3
Дано: m2(раствора)=87,5 г, ω2(Na2CO3)=4%, ω3(Na2CO3)=6%,или 0,06
Найти: m(Na2CO3)-?
Решение:
m2(Na2CO3)=m2(раствора)•ω2(Na2CO3):100%=87,5 г•4%:100%=3,5 г
Пусть масса вещества, которое следует добавить, равна х г, то есть m(Na2CO3)=х г, тогда, подставив значения в формулу вычисления массовой доли в растворе 3: ω3(Na2CO3)=(m2(Na2CO3)+m(Na2CO3))/(m2(раствора)+m(Na2CO3)), получим алгебраическое уравнение и решим его.
0,06=(3,5+х)/(87,5+х)
0,06•(87,5+x)=3,5+х
5,25+0,06х=3,5+х
х-0,06х=5,25-3,5
0,94х=1,75
х=1,75:0,94
х=1,9, следовательно, m(Na2CO3)=1,9 г
m3(раствора)=m2(раствора)+m(Na2CO3)=87,5 г + 1,9 г=89,4 г
Вариант 4
Дано: m2(раствора)=106,7 г, ω2(Na2CO3)=6%, ω3(Na2CO3)=10%,или 0,1
Найти: m(Na2CO3)-?
Решение:
m2(Na2CO3)=m2(раствора)•ω2(Na2CO3):100%=106,7 г•6%:100%=6,4 г
Пусть масса вещества, которое следует добавить, равна х г, то есть m(Na2CO3)=х г, тогда, подставив значения в формулу вычисления массовой доли в растворе 3: ω3(Na2CO3)=(m2(Na2CO3)+m(Na2CO3))/(m2(раствора)+m(Na2CO3)), получим алгебраическое уравнение и решим его.
0,1=(6,4+х)/(106,7+х)
0,1•(106,7+x)=6,4+х
10,67+0,1х=6,4+х
х-0,1х=10,67-6,4
0,9х=4,27
х=4,27:0,9
х=4,7, следовательно, m(Na2CO3)=4,7 г
m3(раствора)=m2(раствора)+m(Na2CO3)=106,7 г + 4,7 г=111,4 г
На весах взвесьте необходимую массу вещества, добавьте его в раствор 2 и перемешайте стеклянной палочкой до полного растворения.
Вариант 1 1,8 г хлорида натрия
Вариант 2 3,4 г хлорида натрия
Вариант 3 1,9 г карбоната натрия
Вариант 4 4,7 г карбоната натрия
Какова масса раствора 3?
Вариант 1 85,1 г
Вариант 2 78,4 г
Вариант 3 89,4 г
Вариант 4 111,4 г
Как найти массу растворенного вещества
Бывает, что возникает такая задача: как найти массу вещества, содержащегося в том или ином объеме раствора? Ход ее решения зависит от того, какими исходными данными вы располагаете. Оно может быть и очень простым, буквально в одно действие, и более сложным.

Инструкция
Например, вам надо узнать, какое количество поваренной соли содержится в 150 миллилитрах 25%-го раствора. Решение: 25%-й раствор – это значит, что в 100 миллилитрах раствора содержится 25 грамм растворенного вещества (в данном случае поваренной соли). В 150 миллилитрах, соответственно, в полтора раза больше. Произведите умножение: 25* 1,5 = 37,5. Вот и ответ: 37,5 грамм поваренной соли.
Немного видоизмените условия задачи. Предположим, вам даны те же 150 миллилитров раствора поваренной соли. Но вместо массовой концентрации известна молярная – 1 М. Сколько поваренной соли содержится в растворе в этом случае? И здесь нет ничего сложного. Прежде всего, вспомните химическую формулу поваренной соли: NaCl. Заглянув в таблицу Менделеева, уточните атомные массы (округленные) элементов, составляющих это вещество: натрия – 23, хлора – 35,5. Следовательно, молярная масса поваренной соли – 58,5 г/моль.
А что такое молярная концентрация? Это – количество молей растворенного вещества в 1 1 литре 1-молярного раствора поваренной соли содержалось бы 58,5 грамм этого вещества. Сколько же его содержится в 150 миллилитрах? Произведя умножение, получите: 58,5* 0,15 = 8,775 г. Если вам не нужна высокая точность, можно принять результат за 8,78 грамм или за 8,8 грамм.
Предположим, вам известен точный объем раствора и его плотность, но неизвестна концентрация вещества. Как в таком случае определить его количество в растворе? Тут решение займет немного больше времени, но опять-таки не вызовет затруднений. Надо лишь найти любой справочник, где есть таблицы плотностей растворов. Для каждого показателя плотности там приведены соответствующие значения его массовой и молярной концентраций.
Например: даны 200 миллилитров водного раствора вещества Х, с плотностью 1,15 г/мл. По таблице растворимости вы выяснили, что такая плотность соответствует 30%-й концентрации раствора. Сколько вещества Х находится в растворе? Решение: если в 100 миллилитрах раствора содержалось бы 30 грамм вещества Х, то в 200 миллилитрах: 30*2 = 60 грамм.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.