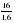I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D – относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород – CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
Определите истинную формулу углеводорода, при сжигании 4,4 грамм которого получили 13,2 грамм диоксида углерода (CO2) и 7,2 грамм воды (H2O). Относительная плотность по водороду (H2) 22.
Решение задачи
Предлагаю, искомую формулу углеводорода обозначить CхHуOz?, наличие кислорода под вопросом, так как в условии задачи не указано какой углеводород (кислород содержащий или нет).
Рассчитаем молярные массы интересующих нас веществ: диоксид углерода (CO2), воды (H2O):
M (CO2) = 12 + 2 ⋅ 16 = 44 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль).
Найдем массу углерода (Cх) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 44 г диоксид углерода (CO2) содержится 12 г углерода (C)
в 13,2 г диоксид углерода (CO2) содержится Cх г
Откуда:
Найдем массу водорода (Hу) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 18 г воды (H2O) содержится 2 г водорода (H)
в 7,2 г воды (H2O) содержится Hу г
Откуда:
Рассчитаем массу углеводорода (CхHуOz?):
m (CхHуOz?)= 3,6 + 0,8 = 4,4 (г), что соответствует условию задачи.
Следовательно, искомую формула углеводорода CхHу.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
Число атомов углерода (C) и водорода (H) относятся 3 : 8, следовательно простейшая формула углеводорода – C3H8.
Молярная масса (C3H8) равна:
M (C3H8) = 3 ⋅ 12 + 8 = 44 (г/моль).
Найдем относительную молярную массу углеводорода (C3H8), зная, что относительная плотность по водороду (H2) равна 22, по формуле:
Учитывая, что молярная масса водорода (H2) равна 2 г/моль, получаем:
M (CxHy) = 22 ∙ 2 = 44 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) ”вмещает” молярную массу (C3H8):
M (CxHy)/ M (CH) = 44/44 = 1.
Следовательно, молекулярная формула углеводорода C3H8 (пропан).
Ответ:
молекулярная формула углеводорода C3H8.
Анна Валерьевна Дзенис
Задачи на вывод молекулярной формулы углеводородов
I. По массовым долям элементов
Опорная информация:
1) Пусть имеется углеводород СхНу, тогда ω%(C) – массовая доля углерода 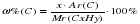
преобразуя эту формулу, можно выразить «х» – число атомов углерода: 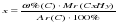
Аналогично: 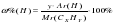
преобразуем эту формулу, выражая число атомов водорода («у»):
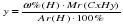
[Примечание: если по условию задачи известна массовая доля только одного элемента, то массовую долю второго элемента можно определить из формулы: 
2) Относительную молекулярную массу углеводорода можно вычислить, зная величину относительной плотности данного углеводорода по какому-либо газу «А» (водород, кислород, гелий, азот или воздух и др):
Mr(СхНу ) = DА(СхНу) · Mr (А),
где
Задача-образец: Определите молекулярную формулу углеводорода, содержащего 84% углерода, если относительная плотность данного вещества по азоту = 3,57.
|
Общая схема решения задачи |
Решение задачи-образец |
|
Дано: а) ω % (C) или ω % (Н) б) DА (СXHY) или ρ Найти: СхНу Последовательность действий: 1) Находим Mr (СXHY) : Если известна DА (СXHY), то Mr(СXHY) = DА (СXHY) • Mr(A) 2) Находим индексы (х и у): а) б) ω % (H) = 100 % – ω % (C) в) |
Дано: а) ω % (C) = 84% б) DN2 (СXHY) = 3,57 Найти: СхНу Решение: 1) Находим Mr (СXHY) : Mr(СXHY) = DN2 (СXHY) • Mr(N2) = 3,57 • 28 = 99,96 2) Находим индексы (х и у): а) б) ω % (H) = 100 % – ω % (C) = 100 % – 84%= 16% в) Ответ: С7Н16 |
1) Задача: Массовая доля углерода в углеводороде составляет 83,3%. Относительная плотность паров этого углеводорода по водороду = 36. Определите молекулярную формулу этого углеводорода.
2) Задача: Определите молекулярную формулу углеводорода, если массовая доля углерода в нем составляет 85,71%, а относительная плотность данного вещества по кислороду равна 1,3125.
3) Задача: Определите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 15,79%. Относительная плотность паров этого вещества по воздуху равна 3,93.
4) Задача: Определите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 18,2%. Относительная плотность данного вещества по азоту равна 1,57.
II. По продуктам сгорания
Задача-образец: При сгорании 92,8 г углеводорода образовалось 143,36 л оксида углерода (IV) и 144 г воды. Относительная плотность углеводорода по воздуху равна двум. Определите молекулярную формулу данного вещества.
|
Общая схема решения задачи |
Решение задачи-образец |
|
Дано: а) m(CXHY) или V(CXHY) б) m(CO2) или V(CO2) в) m(H2O) г) DА (СXHY) Найти: СхНу Последовательность действий: 1) а) Если известна m (CXHY), то сначала определяют М(CXHY): Mr(СXHY) = DА (СXHY) • Mr(A) б) Если известен V(CXHY), то переходим ко 2 действию. 2) Вычисляем : а) n (CXHY) ; б) n(CО2) ; в) n (H2O) по одной из формул: n(A) 3) Вычисляем: а) n (C) = n (CО2) ; б) n (H) = 2• n (H2O). (Примечание: проверка на наличие атомов кислорода: m (О)= m (в-ва) – m (С) – m (Н) = m (в-ва) – 12 · n (C) – 1 · n (Н) ) 4) Записываем соотношение: n (CXHY) : n (C) : n(H) Делим на наименьшее число. 5) Ответ: в 1 молекуле CXHY содержится …. атомов углерода и …. атомов водорода. |
Дано: а) m(CXHY) = 92,8 г б) V(CO2) = 143,36 л в) m(H2O) = 144 г г) Dвоздух (СXHY) = 2 Найти: СхНу Решение: 1) Так как известна m (CXHY), то сначала определяют М(CXHY): Mr(СXHY) = Dвоздух (СXHY) • Mr(воздух) = 2 • 29 = 58 2) Вычисляем : а) n (CXHY) = б) n(CО2) = в) n (H2O) = 3) Вычисляем: а) n (C) = n (CО2) = 6,4 б) n (H) = 2 • n (H2O) = 2 • 8 = 16 (Так как по условию задачи известно, что сожгли углеводород, проверку на кислород делать не нужно) 4) Записываем соотношение: n (CXHY) : n (C) : n(H) 1,6 : 6,4 : 16 Делим на наименьшее число – на 1,6 : 1 : 4 : 10 5) Ответ: С4Н10 |
5) Задача: Относительная плотность углеводорода по водороду равна
14. Определите молекулярную формулу этого вещества, если при сгорании 42 г его образовалось 54 г воды и 67,2 л углекислого газа.
6) Задача: 20,16 л углеводорода сожгли, в результате чего было получено 80,64 л оксида углерода (IV) и 64,8 г воды. Какова молекулярная формула исходного углеводорода?
7) Задача: При сжигании 6,72 л некоторого углеводорода образовалось 26,4 г оксида углерода (IV) и 10,8 г воды. Определите молекулярную формулу данного вещества.
8) Задача: Относительная плотность паров некоторого углеводорода по водороду = 64. В результате сгорания 3,2 г этого вещества образовалось 9,9 г углекислого газа и 4,5 г воды. Определите молекулярную формулу этого углеводорода.
9) Задача: При сжигании 28 л углеводорода было получено 84 л оксида углерода (IV) и 67,5 г воды. Плотность газа по водороду равна 21. Найти молекулярную формулу газа.
10) Задача: При сгорании 17,6 г углеводорода образовалось 52,8 г углекислого газа и 28,8 г воды. Относительная плотность исходного вещества по воздуху равна 1,517. Какова его молекулярная формула?
определи молекулярную формулу газообразного углеводорода, в котором содержится (92,31)
%
углерода. Известно, что плотность этого углеводорода равна (1,161) г/дм³ (н. у.).
Первый вариант решения
1. Формула вещества —
CxHy
;
x:y=n(C):n(H).
В (100) г углеводорода содержится (92,31) г углерода и
100−92,31=7,69
г водорода.
Найдём количества элементов:
n(C)=m(C)Ar(C)=92,31г12г/моль=7,6925моль;
n(H)=m(H)Ar(H)=7,69г1г/моль=7,69моль;
x:y=7,1425:14,29=7,69257,69:7,697,69=1:1.
Значит, простейшая формула углеводорода —
CH
.
2. Определим относительную молекулярную массу вещества и сравним с массой
CH
:
M(CxHy)=ρ(CxHy)⋅Vm=1,161г/дм³⋅22,4дм³/моль=26г/моль.
Mr(CxHy)Mr(CH)=2613=2.
Следовательно, молекулярная формула вещества
(CH)2=C2H2.
Второй вариант решения
1. Вычислим относительную массу углеводорода:
M(CxHy)=ρ(CxHy)⋅Vm=1,161г/дм³⋅22,4дм³/моль=26г/моль.
2. Найдём числа атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=26⋅92,31%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=26⋅7,69%1⋅100%=2.
Урок
16: Расчетные задачи
(определение
молекулярной формулы углеводорода по его относительной плотности или массе,
объему, количеству вещества продукта его горения).
Цель: Вспомнить
алгоритм решения расчетных задач.
Задачи:
а) Вспомнить алгоритм решения задач
б) Воспитать ответсвенность перед учебным процессом
в) Развивать математические навыки, умение работать самостоятельно
Тип урока: Урок
решения расчетных задач
Методы: Решение задач на доске, индивидуальная работа.
Ход урока:
I.Орг.момент
II.Обсуждение результатов итогового тестирования
за I полугодие
III.Решения расчетных задач
Задача 1: Назовите углеводород, если массовая доля углерода в
нем 85,7%, а относительная плотность по водороду 42.
Дано: Решение:
Задача 2: Если 14 г алкена поглощает 32 г брома. Найдите
молекулярную формулу алкена.
Дано: Решение:
Задача3: В результате сгорания 8,4 г углеводорода с плотностью
по гелию 10,5 образовалось 13,44 л углекислого газа и 10,8 г паров воды.
Найдите молекулярную формулу данного углеводорода.
Дано: Решение:
Задача 4: Углеводород, имеющий в составе 92,3 % углерода и 7,7
% водорода, относительная плотность по воздуху равна 13. Его молекулярная
формула?
Дано: Решение:
Задача 5: Углеводород с общей формулой СnH2n+2 имеет плотность паров по воздуху
2,966. Найдите молекулярную формулу соединения.
Дано: Решение:
Задача 6: Массовая доля углерода и водорода в углеводороде раны
88,24 и 11,76% соответственно. Относительная плотность вещества по воздуху-
2,89. Найдите молекулярную формулу данного углеводорода.
Дано: Решение:
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет
относительную плотность по воздуху, равную 3,93.
Решение примера
1.
Пусть масса
вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
Найдём
количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль.
Определяем
мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 :
2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9.
По
относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 —
57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Пример 2.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и
продукты реакции пропустили через избыток известковой воды, при этом
образовалось 8 г осадка. Какой углеводород был взят?
Решение примера2 .
Общая формула
газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 +
H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль
углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести
миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
При пропускании
углекислого газа через известковую воду Са(ОН)2 выпадает осадок
карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100
г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
Количество углекислого
газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
Пример 3.Определить
формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 3.
Общая формула
алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в
молекуле диена две двойные связи и, соответственно, в реакцию
с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4
Так как в задаче даны
масса и процентная концентрация раствора брома, прореагировавшего с диеном,
можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора •
ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль.
Так как количество
брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти
количество диена и (так как известна его масса) его молярную массу:
|
0,005 |
0,01 |
|
|
СnH2n−2 |
+ |
СnH2n−2Br4 |
Мдиена =
m / ν = 3,4 / 0,05 = 68 г/моль.
Мдиена =
m / ν = 3,4 / 0,05 = 68 г/моль.
Находим формулу
алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.
Это пентадиен С5Н8.
Ответ: C5H8.
Пример 4.При сжигании 4,3 г углеводорода,
состоящего из углерода и водорода, образовалось 13,2 г углекислого газа. Плотность пара углеводорода по водороду
равна 43. Выведите формулу углеводорода.
Пример 5. При
горении 1 моль газообразного алкана (н. у.) образовалось 22,4 л оксида
углерода(IV) и 36 г воды. Найдите молекулярную формулу алкана и рассчитайте,
какой объём кислорода потребуется для полного сгорания 5 л этого вещества.
(Ответ: СН4; 10 л.)
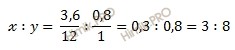
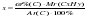
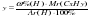
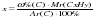 =
= 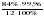 = 6,99
= 6,99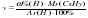 =
=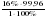 = 15,99
= 15,99 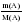 или n(A)
или n(A) 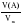
 =
= 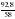 = 1,6
= 1,6 =
= 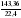 = 6,4
= 6,4 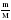 =
= 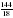 = 8
= 8 :
:  :
: