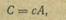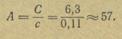Ответы Mail.ru
Наука, Техника, Языки
Гуманитарные науки
Естественные науки
Лингвистика
Техника
Вопросы – лидеры.
Возможно ли стать учёным самоучкой?
1 ставка
Лидеры категории
Лена-пена
Искусственный Интеллект
М.И.
Искусственный Интеллект
Y.Nine
Искусственный Интеллект
•••
Анна Носова
Ученик
(79),
закрыт
2 года назад
Лучший ответ
Иван Натальин
Мастер
(1196)
12 лет назад
Количество теплоты (Q) = удельная теплоёмкость*массу (m) (с) * на разность температур (t2-t1)
Отсюда вырази m
m=Q/(c*(t2-t1))
Остальные ответы
укукм уцкуцкуцкуцк
Гуру
(4688)
12 лет назад
Q = c*m*(t2-t1)
Формула
Dimas444423
Знаток
(344)
2 года назад
m=Q/c(t2-t1)
Каиров Тимур
Мыслитель
(6315)
7 месяцев назад
не5
Сузуя Джузо
Знаток
(285)
5 месяцев назад
m = Q/c△t
Q = cm△t
Похожие вопросы
Как найти массу, зная удельную теплоемкость и кол – во теплоты?
На этой странице находится вопрос Как найти массу, зная удельную теплоемкость и кол – во теплоты?, относящийся к категории
Физика. По уровню сложности данный вопрос соответствует знаниям
учащихся 5 – 9 классов. Здесь вы найдете правильный ответ, сможете
обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С
помощью автоматического поиска на этой же странице можно найти похожие
вопросы и ответы на них в категории Физика. Если ответы вызывают
сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Количество вещества, содержащегося в объекте, измеряется его массой, которая является наиболее фундаментальным свойством любого объекта. В этом посте с различными подходами и решенными проблемами будет обсуждаться, как найти массу без ускорения, то есть без использования второго закона Ньютона.
Самый популярный метод определения массы – применение второго закона Ньютона, который включает как силу, так и ускорение. Кроме того, массу можно рассчитать, используя плотность, объем и удельную теплоемкость, а также энергию.
Давайте рассмотрим каждый подход к нахождению массы один за другим.
⇒ Определение массы по плотности:
Наблюдения и советы этой статьи мы подготовили на основании опыта команды плотность объекта – это его единственное в своем роде физическое свойство. Плотность открыл греческий ученый Архимед. Плотность вещества предмета (масса предмета) показывает, сколько места он занимает, т. е. его объем. По сути, это измерение того, насколько плотно или свободно упаковано вещество или материал. В результате этого свойство происходит от массы и объема и может быть выражено как:
Таким образом, массу можно просто определить, если известны плотность и объем объекта или материала. Делая массу предметом уравнения, ее можно вычислить следующим образом:
м = 𝜌V
⇒ Определение массы по удельной теплоемкости:
Количество тепла, необходимое для повышения температуры одного грамма вещества на один градус Цельсия, называется его удельной теплоемкостью. Когда это утверждение преобразовано в уравнение, уравнение теплоемкости выглядит следующим образом:
Где c обозначает удельную теплоемкость, буква Q обозначает количество выделенного тепла, m обозначает массу вещества, а T обозначает изменение температуры.
Удельная теплота сгорания каждого вещества или материала различна. Массу любого вещества легко найти, если известно значение удельной теплоемкости, а также количество отдаваемого тепла и изменение температуры. Массу в виде удельной теплоемкости можно рассчитать следующим образом:
⇒ Определение массы по кинетической энергии:
Когда объект или частица находится в движении, у них есть тип энергии, известный как кинетическая энергия. Когда к объекту прикладывается сила, считается, что над объектом совершается работа, которая заставляет его ускоряться и набирать кинетическую энергию. В результате, если объект движется, он обладает свойством кинетической энергии. Кинетическая энергия объекта определяется его движением, а также его массой и определяется следующим образом:
Где k обозначает кинетическую энергию, а V обозначает скорость объекта.
Таким образом, масса объекта определяется выражением:
Масса объекта сохраняется согласно закону сохранения массы. Однако абсолютность массы не всегда соответствует действительности.. Это означает, что приведенное выше уравнение действительно только тогда, когда объект движется с низкой или относительно высокой скоростью. Однако, когда объект движется с чрезвычайно высокой скоростью, такой как скорость света, его масса увеличивается. В результате в то время должен применяться принцип относительности Альберта Эйнштейна, а именно:
E = MC2
Согласно приведенному выше уравнению, масса и энергетика по сути, являются одним и тем же физическим лицом и могут быть заменены.
В этом сценарии энергия упоминается как релятивистская кинетическая энергия, а масса упоминается как релятивистская масса.
Следующее уравнение можно использовать для определения релятивистской массы:
Где,
- Масса покоя объекта обозначена m
- его скорость обозначается V
- а скорость света обозначена буквой c.
Пока что мы рассмотрели, как найти массу без ускорения, используя множество подходов. Итак, давайте посмотрим на несколько решенных кейсов для каждого из них.
Решенные примеры определения массы без ускорения:
Проблема 1: По озеру плывет лодка длиной 3 метра и шириной 2 метра. Когда человек садится в лодку, лодка тонет на 1 см. Затем найдите массу человека.
Решение: Здесь нам даны:
Длина l = 3 м
Ширина b = 2 м
Высота h = 1 см = 0.01 м
Масса M =?
Здесь указаны длина, ширина и высота. В результате объем можно просто найти.
V = фунт-час
∴ V = 3 Х 2 Х 0.01
∴ V = 0.06 м3
Теперь плотность воды составляет 1000 кг / мXNUMX.3.
Таким образом, масса человека составляет:
м = ρV
м = 1000 Х 0.06
∴ м = 60 кг
Таким образом, масса человека, сидящего на лодке, составляет 60 кг.
Задача 2: Рассчитайте массу пробы воды, которая была нагрета от начальной температуры 25 ℃ до конечной температуры 100 ℃ после получения 1200 Дж тепловой энергии.
Решение: Здесь,
Q = 1200 Дж
Ti = 25 ℃
Tf = 100 ℃
∴ 𝛥T = Tf – Тi = 100 ℃ -25 ℃ = 75 ℃
А удельная теплоемкость воды c = 4.184 Дж ℃.-1 g-1
Теперь масса пробы воды определяется как:
∴ m = 3.8 г
Таким образом, масса пробы воды в данном случае составляет 3.8 г.
Проблема 3: Если KE составляет 80 Дж, а скорость объекта составляет 7 м / с, определите массу объекта.
Решение: Здесь,
K = 80 Дж
v = 7 м / с
Таким образом, масса объекта равна:
∴ м = 3.26 кг
Таким образом, объект со скоростью 7 м / с и кинетической энергией 80 Дж имеет массу 3.26 кг.
Задача 4: объект движется по воздуху со скоростью 0.85 c. Масса объекта в движении составляет 11 кг. Итак, какова масса покоя этого объекта?
Решение: Здесь,
Масса m = 11 кг,
Скорость v = 0.85 c,
Скорость света c = 3 X 108 м/с
Релятивистская масса
∴ м0 = 5.8 кг
В результате масса покоя объекта составляет 5.8 кг.


как найти массу, зная удельную теплоемкость, кол-во теплоты, начальную и конечнут температуру
Остались вопросы?
Новые вопросы по предмету Физика
Содержание
- Вычисление атомного веса по атомной теплоемкости.
- Определение атомной массы металла
- Как найти атомную массу металла через удельную теплоемкость
- Определение химического эквивалента, эквивалентной и атомной массы металла
Вычисление атомного веса по атомной теплоемкости.



Атомной теплоемкостью (в калориях, на грамм) • называется количество тепла, требуемое для нагревания одного грамм— атома простого вещества на один градус. Из этого следует, что атомная теплоемкость равна произведению удельной теплоемкости на атомный вес:
где С — атомная теплоемкость; с — удельная теплоемкость; А — атомный вес.
Согласно правилу Дюлонга и Пти, атомная теплоемкость большинства простых твердых веществ при небольших отклонениях от обычной температуры приблизительно равна 6,3. Это дает возможность найти приблизительный атомный вес элемента по удельной теплоемкости соответствующего простого вещества.
Пусть, например, установлено, что удельная теплоемкость некоторого металла равна 0,11 и требуется найти приблизительный атомный вес этого металла. Из соотношения между атомной и удельной теплоемкостями находим:
Чтобы уточнить найденный атомный вес, достаточно знать эквивалент элемента. Предположим, что эквивалент равен 19,56.. Согласно рассмотренной ранее зависимости между атомным весом, эквивалентом и валентностью, частное от деления атомного веса на эквивалент будет являться валентностью элемента:
Дробная валентность невозможна, поэтому найденное частное округляем до целого числа 3. Находим точный атомный вес умножением эквивалента на установленную валентность:
129. Окисел содержит 78,7% металла и 21,3% кислорода. Удельная теплоемкость металла 0,05. Вычислить его атомный вес.
130. При взаимодействии с кислотой 0,608 г металла вытесняют 560 мл водорода, измеренного при нормальных условиях. Удельная теплоемкость металла 0,26. Вычислить его атомный вес.
131. 0,1735 г металла соединяется с 280 мл хлора, измеренного при нормальных условиях. Удельная теплоемкость металла 0,85. Вычислить его атомный вес.
132. На окисление 0,7663 г металла расходуются 140 мл кислорода, измеренного при нормальных условиях. Удельная теплоемкость металла 0,033. Вычислить его атомный вес.
133. 2,64 г окисла металла содержат 0,32 г кислорода. Удельная теплоемкость металла 0,028. Вычислить его атомный вес.
134. 0,4634 г металла вытесняет 0,5276 г меди. Удельная теплоемкость металла 0,11. Вычислить его атомный вес, приняв валентность меди 2.
135. 0,318 г металла вытеснили всю ртуть из 1,620 г нитрата ртути. Удельная теплоемкость металла 0,0928. Вычислить его атомный вес.
Источник
Для основной образовательной программы
«Экспериментальная отработка и эксплуатация летательных аппаратов»
По направлению (специальности) подготовки
«Испытание летательных аппаратов» 24.05.03
ст. преподаватель Сгибнева И.В.
на заседании кафедры Б13-ОТД
Лабораторная работа №1
1. Название: «Определение удельной теплоёмкости металла и его атомной массы»
Целью выполнения лабораторной работы является проверка достижения следующих результатов образования (РО):
на уровне представлений: Знание экспериментальных и теоретических методов изучения химических явлений, а также применение математического аппарата для их количественного описания.
на уровне воспроизведения: Фундаментальные физические законы, описывающие процессы и явления в природе
на уровне понимания: Физическую сущность явлений, процессов и эффектов, лежащих в основе устройства и функционирования испытательных стендов и объектов испытания.
теоретические: Уметь составлять химические уравнения при решении задач по химическим реакциям в различных средах и системах
практические: Уметь применять химические законы для решения практических задач; проводить расчеты с использованием фундаментальных констант, пользоваться основными приемами обработки экспериментальных данных с представлением их в виде схем, графиков и т.д. Уметь работать с технической литературой, справочниками и другими информационными источниками
навыки: Владеть навыками практического применения законов химии
Перечисленные РО являются основой для формирования следующих компетенций:
общекультурных и профессиональных:
ОПК-2 Способность представить адекватную современному уровню знаний научную картину мира на основе знания основных положений, законов и методов естественных наук и математики на уровне основных формулировок.
2. Теория и методические указания
Если два тела с разной температурой привести в соприкосновение, то происходит выравнивание температур. При этом тело с более высокой температурой охлаждается и передаёт часть тепловой энергии менее нагретому телу, то есть происходит процесс передачи некоторого количества теплоты. Внутренняя энергия тел при этом изменится. Процесс изменения, внутренней энергии тела без совершения работы называется теплопередачей. Количество теплоты является мерой изменения внутренней энергии при теплопередаче.
Количество теплоты, получаемое телом от другого тела, может быть измерено. За единицу количества теплоты принята калория – количество теплоты, необходимое для нагревания 1 грамма чистой воды на 1°C. В системе СИ за единицу количества теплоты принята единица джоуль (Дж):
I кал = 4,1868 Дж.
Разные тела можно нагреть до одной и той же температуры путём подведения разного количества теплоты. Это означает, что различные вещества обладают разной восприимчивостью к нагреванию.
Количество теплоты, необходимое для нагревания вещества на I°C, называется теплоёмкостью данного вещества.
Теплоёмкость вещества пропорциональна его массе и зависит от свойств данного вещества. Удельной теплоёмкостью данного вещества называется количество теплоты, необходимое для нагревания I грамма вещества на I°C.
Если Q – количество теплоты, переданное телу массой m при нагревании его от температуры t1, до температуры t2, то удельная теплоёмкость будет равна:
Удельная теплоёмкость вещества выражается в Дж/г·°К (или в системе СИ — Дж/кг·°К).
1.2 Теплоемкость металлов
Простейший способ определения удельной теплоёмкости твёрдых тел состоит в следующем: кусок металла определённого веса нагревают до температуры кипящей воды и затем помещают в калориметр с холодной водой. После того, как температуры металла и воды сравняются, определяют результирующую температуру в калориметре. При этом в соответствии с уравнением теплового баланса количество теплоты, выделившееся при охлаждении металла равно количеству теплоты, полученному сосудом калориметра и водой. Поскольку все параметры, кроме одного – удельной теплоёмкости исследуемого металла СМ, известны, то из уравнения теплового баланса можно определить величину СМ.
По уравнению теплового баланса:
то есть суммарное количество теплоты, отданное при теплообмене всеми охлаждаемыми телами замкнутой системы, равно сумме количеств теплоты, полученных всеми нагревающимися телами.
При теплообмене исследуемый металл отдал количество теплоты:
где cм – удельная теплоёмкость исследуемого металла (Дж/г·°К);
mм — масса исследуемого металла, г ;
t2 – температура, до которой нагрет металл (в нашем случае 100º С);
θ — температура, установившаяся после теплообмена.
Калориметр и жидкость (вода) получили соответственные количества теплоты:
где cк – удельная теплоёмкость калориметра (стекла) (Дж/г·°К);
mк — масса внутреннего сосуда калориметра, г ;
t1 – начальная температура жидкости;
cк – удельная теплоёмкость жидкости (воды), (Дж/г·°К);
mк — масса жидкости (воды), г.
Незначительное количество теплоты, полученное термометром, не учитывается.
Уравнение теплового баланса можно записать в виде:
Отсюда определяется удельная теплоёмкость металла:
| cм = | (cжmж + cкmк) ( θ- t1) | (1.5) |
| mм(t2 — θ) |
Тогда уравнение (1.5) принимает вид:
| cм = | (4,19·mж + 0,8·mк) (θ — t1) | (1.6) |
| mм(100 – θ) |
Определение атомной массы металла
Вычислив таким образом удельную теплоёмкость металла, можно определить его приближённую атомную массу по правилу Дюлонга и Пти. Атомная теплоёмкость большинства простых веществ в твёрдом состоянии лежит в пределах 22 ÷ 29 Дж/моль·°К (в среднем около 26 Дж/моль·°К).
Атомная теплоёмкость представляет собой количество теплоты необходимое для нагревания 1 моля атомов элемента на 1 º С.
Тогда правило Дюлонга и Пти можно сформулировать следующим образом: произведение удельной теплоёмкости простого вещества в твёрдом состоянии на мольную массу атомов соответствующего элемента для большинства элементов приблизительно одинаково и равно 26 Дж/моль·°К:
М·С ≈ 26 Дж/моль·°К, (1.7)
где М – мольная масса (численно равная ей атомная масса);
С – удельная теплоёмкость.
Из правила Дюлонга и Пти следует, что разделив 26 на удельную теплоёмкость простого вещества, можно найти приближённое значение мольной массы атомов, а значит, и численно равное ей приближённое значение атомной массы.
Точное значение атомной массы находят, сравнивая это значение с эквивалентной массой. Атомная и эквивалентная масса связаны соотношением:
| Эквивалентная масса = | Атомная масса | (1.8) |
| Валентность |
Пользуясь этой зависимостью, можно по удельной теплоёмкости и эквивалентной массе определить точную атомную массу металла.
Пример: Эквивалентная масса индия равна 38,273 г/моль; удельная теплоёмкость этого металла 0,222 Дж/г·°К. Определить точную атомную массу индия.
Сначала на основании правила Дюлонга и Пти определяем приближённую мольную массу атомов индия:
26 : 0,222 = 117 г/моль
Затем делением этой приближённой величины на эквивалентную массу находим валентность индия:
Умножая эквивалентную массу на валентность, получаем мольную массу атомов индия:
38,273 · 3 = 114,82 г/моль
Следовательно, атомная масса индия равна 114,82 а.е.м.
Описание установки
Для определения удельной теплоёмкости пользуются калориметром, который состоит из двух стаканов, вставленных один в другой. Внутренний стакан (1) ёмкостью 150 мл для уменьшения теплоотдачи поставлен на корковую пробку (2). Через асбестовую или картонную крышку (3), закрывающую внешний стакан (4), проходит термометр (5).
3. Задание на выполнение
1 Включить электроплитку, поставить на неё сосуд с водой и нагреть воду до кипения.
2 На техно-химических весах взвесить кусочек исследуемого металла, привязать его на нитку и опустить на 10 – 15 минут в кипящую воду.
3 Взвесить внутренний стакан калориметра, налить в него 50 ÷ 70 мл. воды и ещё раз взвесить.
4 Поместить этот стакан на его место в приборе и определить температуру воды.
5 Нагретый до 100º С (в кипящей воде) металл быстро перенести в воду калориметра, прикрыть калориметр крышкой и, помешивая термометром (осторожно!), установить наивысшую температуру, которую примет вода за счёт теплообмена с металлом.
Пользуясь описанной методикой, определить удельную теплоёмкость металла. Затем рассчитать приближённое и точное значение атомной массы. Посчитать % ошибки. Данные занести в таблицу 1.
Таблица 1-Результаты измерений
| Металл | Mм | mж | mк | t1 | Θ | cм | А’ | А | % ошибки |
В качестве вариантов задания выдаются пластины из разных металлов.
5. Контрольные вопросы.
1 Что называется удельной теплоёмкостью вещества
2 Сформулируйте правило Дюлонга и Пти
3 Какое соотношение существует между атомной массой, эквивалентной массой и валентностью.
6. Список учебно-методической и дополнительной литературы
1 Луцик П.П. и др. Курс физики. – Киев: издательское объединение «Вища школа», 1978.
2 Справочник по элементарной физике, Лободюк В.А. и др.- Киев: Наукова думка, 1978.
3 Глинка Н.А. Общая химия.- Л.: Химия, 1980.
4 Лабораторные работы по общей химии, Стругацкий М.К. и др.,- М.: Высшая школа, 1963.
Источник
1) Точную атомную массу металла (А) можно определить по формуле:
A = Mэ · В (формула 1)
где В – валентность металла
Mэ – его эквивалентная масса, в г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость, для чего пользуются правилом Дюлонга и Пти: произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково и равно:
Показать полностью.
СА = А · С ≈ 26,8 Дж/моль·К
где СА — атомная теплоемкость металлов — количество тепла, необходимого для нагревания 1 моля атомов металла на один градус (Кельвин)
С – удельная теплоемкость металла, Дж/г·К
А – приблизительная атомная масса взятого металла, г/моль
Я уверена, что в задаче есть ошибка в размерности: удельная теплоемкость не 477.32 кДж, а 477.32 Дж/кг·К = 0,47732 Дж/г·К (сравни: http://www.cryocatalog.ru/info/ud_teplmet.php)
тогда: А прибл.= СА/С = 26,8 Дж/моль·К / 0,47732 Дж/г·К = 56,1 г/моль
100 г бромида содержат 100 — 74,42 = 25,58 г металла.
Согласно закону эквивалентов отношение массы металла и массы
брома в соединении (25,58 : 74,42) должны быть равны отношению их
эквивалентных масс.
Экв. масса брома в задаче не дана, но ее можно найти: эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. Валентность брома в соединениях с металлами I (СО -1), поэтому
экв. масса брома равна ее атомной массе, т.е. 79,904 г/моль, тогда молярная масса эквивалента металла
Мэ = 25,58 : 74,42 · 79,904 = 27,465 г/моль
Зная приближенную атомную массу металла и его эквивалентную массу, можно по формуле (1) найти валентность этого металла, округлив до целого числа:
валентость=А прибл./Мэ=56,1 г/моль : 27,465 г/моль = 2,04 ≈ 2
Точная молярная масса металла:
Aточн. = 27,465 г/моль · 2 = 54,93 г/моль (т.е. это Mn)
Источник
Определение химического эквивалента, эквивалентной и атомной массы металла
Федеральное агенство образования и науки Российской Федерации
Саратовский государственный технический университет
ЭКВИВАЛЕНТНОЙ И АТОМНОЙ
для студентов всех специальностей
Одобрено редакционно-издательским советом Саратовского государственного технического университета
1. Ознакомить студентов с основными химическими законами и единицами массы.
2. С помощью математической обработки полученных студентами экспериментальных данных сделать вывод о названии металла, данного для работы и его положении в периодической таблице .
Вспомним основные частицы вещества.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств.
Простейшим примером может служить молекула хлористого водорода (HCl). Водород и хлор, вступая в реакцию, теряют свои свойства, характерные для газообразных Н2 и Cl2, поэтому считается, что в состав хлористого водорода входят элементы: водород и хлор. В молекуле данного соединения на один атом элемента водорода приходится один атом элемента хлора.
Масса атомов и молекул выражается в относительных атомных единицах массы (а. е.м.), принятых в 1961 г. За одну относительную атомную единицу массы принимается 1/12 часть массы атома изотопа углерода 12С. Таким образом, масса атома или молекулы любого вещества представляется относительной величиной, показывающей, во сколько раз масса данного атома (молекулы) тяжелее выбранной атомной единицы массы. Относительную атомную массу обозначают Аr. Например,
Аналогично относительную молекулярную массу веществ обозначают Мr, например, Мr(Н2О) = 2Аr(Н) + Аr(О) = 2 + 16 =18.
Аr и Мr – величины, которые не имеют единиц измерения.
При решении задач и в расчетах по уравнениям реакций гораздо чаще пользуются понятием «моль».
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа углерода 12C.
В одном моле любого вещества содержится совершенно одинаковое количество структурных единиц. Это число называют числом Авогадро и принимают его значение равным 6,02∙1023.
Применяя слово «моль», необходимо в каждом случае точно указывать, какие единицы входят в данное вещество. Существуют понятия «моль атомов», «моль молекул» и т. д. Масса одного моля взятого вещества называется его молярной массой. Она выражается в г/моль.
Числовое значение молярной массы вещества в г/моль равно относительной молекулярной массе Mr, если вещество состоит из молекул, или относительной атомной массе Ar, если вещество состоит из атомов. Например, молярная масса атомарного кислорода равна – 16 г/моль, молекулярного кислорода – 32 г/моль.
Часто в химических расчетах используется понятие эквивалента.
Эквивалентом вещества называется такое его количество, которое соединяется без остатка с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Например, в соединениях HCl, H2S и NH3 эквивалент элементов хлора, серы и азота соответственно равен 1 моль, 1/2 моль и 1/3 моль. Масса одного эквивалента называется его эквивалентной массой или молярной массой эквивалента. Выражается в г/моль.
Так, в приведенном примере эквивалентные массы хлора, серы и азота легко подсчитать, используя молярные массы атомов этих элементов, они соответственно равны:
mэ(Cl) = 35,5 г/моль; mэ(S) = 32:2 = 16 г/моль; mэ(N) = 14:3 = 4,7 г/моль.
Из разобранных примеров видно, что эквивалентная масса элемента находится из соотношения:
Эквивалентная масса 

Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
1. Эквивалентная масса оксида складывается из значений эквивалентных масс, составляющих оксид элементов.
Примеры: а) ZnO: эквивалентные массы металла и кислорода соответственно равны половине молярных масс атомов:



б) SO3. Валентность серы в оксиде равна 6, следовательно,


2. Эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты (число атомов водорода в молекуле кислоты).
Примеры: а) HNO3. Молярная масса – 63 г/моль. Кислота одноосновная, следовательно, эквивалентная масса равна: 63:1 = 63 г/моль.
б) H3PO4. Молярная масса равна 98 г/моль. Основность равна 3.

3. Эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание.
Пример: Mg(OH)2. Молярная масса его – 58 г/моль. Эквивалентная масса равна: 58 : 2 = 29 г/моль.
4. Эквивалентная масса соли равна отношению ее молярной массы к произведению валентности металла на число его атомов в молекуле.
Примеры: а) Na2CO3. Молярная масса соли 106 г/моль. Валентность металла 1, число его атомов 2. Эквивалентная масса Na2CO3:

б) Al2(SO4)3 Молярная масса – 342 г/моль:

5. Эквиваленты одних и тех же сложных веществ и их эквивалентные массы могут иметь различные значения, если их рассматривать не как отдельные вещества, а составные части химических реакций, в которых они участвуют.
Так, в примерах: эквивалент H2CO3 и его масса зависят от количества атомов водорода, участвующих в реакции, и соответственно равны:
H2CO3 + 2NaOH = Na2CO3 + 2H2O;


H2CO3 + NaOH = NaHСO3 + H2O;

В реакциях Cr(OH)3 с соляной кислотой на кислотный остаток было замещено различное число гидроксидных групп. Поэтому эквивалент и его масса будут различаться.
Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O;


Cr(OH)3 + 3HCl = CrCl3 + 3H2O;


Известно несколько способов определения эквивалента.
I. Прямое или непосредственное определение эквивалента из соединения элементов с водородом или кислородом.
Пример 1. Рассчитать эквивалент железа в его оксиде FeO.
Эквивалент кислорода по определению равен 1/2 моля атомов, эквивалентная масса кислорода равна: 16 : 2 = 8 г/моль. В данном соединении на ½ моля атомов кислорода приходится столько же, т. е. 1/2 моля атомов железа. Следовательно, эквивалент железа в данном оксиде равен ½ моля, а его эквивалентная масса: 56 : 2 = 28 г/моль.
II. Определение эквивалента с помощью закона эквивалентов.
Закон эквивалентов (эквивалентных масс), предложенный в 1803-1814 гг. Дальтоном и Рихтером: Элементы и вещества соединяются друг с другом, а также замещают друг друга в химических реакциях в строго определенных весовых количествах, прямо пропорциональных их эквивалентам.
Математическая запись закона такова:

где m1 и m2 – массы взаимодействующих элементов или веществ, г;
mЭ1 и mЭ2 – соответственно эквивалентные массы этих веществ,
Пример 2. Определить эквивалентную и молярную массы трехвалентного металла, зная, что 0,52 г его при окислении образуют 0,98 г оксида.
Решение: В соответствии с законом эквивалентов

Массу кислорода определим по разности масс оксида и металла:
mO = 0,98 – 0,52 = 0,46 г.
Эквивалентная масса кислорода известна, она равна 8 г/моль.

Т. к. валентность металла равна 3, то его молярная масса
A = mэ(Me) · В = 9,0 · 3 = 27 г/моль.
Пример 3. Вычислите эквивалентную массу металла, если в его хлориде массовая доля хлора 79,78 %, эквивалентная масса хлора 53,45 г/моль.
Решение: Массовая доля w металла в хлориде равна:
w = 100 — 79,78 = 20,22 %.
Согласно закону эквивалентов отношение массы металла и массы хлора в соединении (20,22 : 79,78) должно быть равно отношению их эквивалентных масс:

Отсюда 
Пример 4. Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
Решение: Эквивалентная масса оксида металла равна:
mэ(MeO) = mэ(Me) + mэ(O) = mэ(Me) + 8.
Эквивалентная масса сульфата металла равна:

Согласно закону эквивалентов

mэ(Me) = 27,5 г/моль.
Т. к. валентность металла равна 2, то его молярная масса равна:
A = 27,5 · 2 = 55 г/моль.
III. Если в химической реакции одно из участвующих веществ находится в газообразном состоянии, то запись закона эквивалентов выражается формулой:

где m(Me) и mэ(Me) – соответственно масса металла и его эквивалентная
V и Vэ – объем вступившего в реакцию газа и объем эквивалентной
массы этого газа.
Для расчета объемов реагирующих газов необходимо знание закона Авогадро и его следствий.
Закон Авогадро (1911): В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Следствия из закона Авогадро:
1. Один моль любого газа при нормальных условиях (н. у. — температура 0 ºС и давление 760 мм рт. ст.) занимает один и тот же объем, равный 22,4 литра. Этот объем называют – молярным объемом газа: Vm = 22,4 л/моль.
2. Один моль любого газа содержит одно и то же число молекул, а именно 6,02 · 1023.
3. Относительная плотность одного газа по другому равна отношению их молярных (M) или относительных молекулярных масс:

На основании этих следствий можно проводить различные расчеты:

где ν – количество моль вещества.
Пример 5. Рассчитать массу 3 л хлора, взятого при н. у.
Решение: Т. к. молярная масса хлора (Cl2) равна 35,5 ∙ 2 = 71 г/моль, то из пропорции легко найти массу искомого объема:


Пример 6. Сколько молей и сколько молекул содержится в 2,2 г углекислого газа? Какой объем они занимают при н. у.?
Решение: Т. к. молярная масса углекислого газа (СО2) равна 44 г/моль, то




Найдем объем газа при н. у.:


Пример 7. Определите массу молекулы газа, если масса 2 л газа (н. у.) равна 0,357 г.
Решение: Исходя из молярного объема газа определим молярную массу газа:


Число молекул в 1 моль любого вещества равно постоянной Авогадро. Следовательно, масса молекул газа m равна:

Первое следствие из закона Авогадро позволяет рассчитать объемы эквивалентных масс различных газов.
Так, если эквивалентная масса водорода равна 1,008 г/моль, то её объем равен:


Подобным образом находится объем эквивалентной массы О2, который оказывается равным:

Пример 8. При растворении 0,506 г металла в серной кислоте выделилось 100,8 мл водорода, измеренного при н. у. Определить эквивалентную массу металла.
Задачу можно решить двумя способами:
а) прямой, подстановкой данных в (2):


где mэ(H) = 1,008 г/ моль.
Для решения задачи в этом случае надо найти m(H2). Согласно следствию из закона Авогадро


Теперь найденное значение m(H) подставим в (1):

Значения эквивалентных масс позволяют определить атомную массу металлов по формуле:
Где В – валентность металла;
А – его молярная масса атома, г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость. В данных расчетах используется правило Дюлонга и Пти: Произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково.
Полученная величина имеет среднее значение, равное 26,8 Дж/моль·К (6,3 кал/моль·град). Эта величина носит название атомной теплоемкости металлов (СА) и представляет собой количество тепла, необходимого для нагревания 1 моля атомов металла на один Кельвин. Математически это правило имеет вид:
где С – удельная теплоемкость металла, Дж/г·К;
А – атомная масса взятого металла, г/моль.
Под удельной теплоемкостью понимается то количество тепла, которое необходимо затратить для нагревания 1 г вещества на 1 Кельвин.
Пример 9. При окислении 0,16 г металла образовалось 0,223 г оксида. Вычислить точную атомную массу металла, зная, что удельная теплоемкость 0,635 Дж/г·К.
Решение: По правилу Дюлонга и Пти найдем приближенное значение атомной массы данного металла:

По (1) найдем эквивалентную массу этого металла. Масса кислорода 0,223 – 0,16 = 0,063 г.

Зная приближенную атомную массу металла и его эквивалентную массу, можно найти валентность этого металла.
Полученное значение В округляем до целого числа:

Точная молярная масса металла находится из соотношения:

1. Требования безопасности труда
Перед началом экспериментальной части внимательно изучите методику выполнения работы. Эксперимент требует осторожности, неторопливости, особенно в начале практической части. Соляную кислоту, необходимую для реакции с металлом в объеме 5 мл, нужно отмерить с помощью градуированной пробирки либо пипетки, строго соблюдая при этом все указания преподавателя (см. также рис. 2 а, б в методических указаниях).
2. Порядок выполнения работы
Прибор для определения эквивалента и эквивалентной массы металла состоит из бюретки (емкостью 50 мл), воронки и пробирки, соединенных резиновыми трубками (рис. 1 а). Бюретка и воронка наполнены дистиллированной водой.
Для проведения опыта необходимо:
1. Проверить прибор на герметичность. Для этого нужно переместить воронку (не снимая пробирки) на несколько больших делений бюретки вниз и закрепить её (рис. 1 а, б). Если прибор герметичен, уровень воды в бюретке окажется постоянным. Непрерывное понижение уровня воды в бюретке означает, что прибором пользоваться нельзя. В этом случае следует устранить негерметичность прибора с помощью лаборанта.
2. Получить у преподавателя или лаборанта навеску металла.
3. Снять пробирку и, передвигая воронку, установить уровень воды в бюретке на делении 0 или несколько ниже (рис. 1 в).
4. Отмерить с помощью градуированной пробирки или пипеткой на 5 мл разбавленной HCl (рис. 2 а, б), влить кислоту в пробирку, стараясь не смочить ее стенок. Держа пробирку наклонно (как это изображено на рис. 3), поместить всю навеску металла на верхнюю сухую стенку пробирки так, чтобы металл раньше времени не упал в кислоту.
5. Плотно закрыть пробирку пробкой, следя за тем, чтобы металл раньше времени не упал в кислоту (рис. 4 а). Отметить и записать начальный уровень воды в бюретке (а1) и стряхнуть металл в кислоту.
6. Наблюдать выделение водорода, сопровождающееся вытеснением воды из бюретки в воронку.
7. Когда закончится реакция, дать пробирке остыть, опустить воронку (не снимая пробирки) до одинакового уровня воды в бюретке и воронке (рис. 4 б). Отметить и записать конечный уровень воды в бюретке (а2).
8. Записать показания термометра и барометра и приступить к расчетам.
3. Обработка результатов эксперимента
1. Определите объем водорода, вытесненного взятой навеской металла, при температуре t и давлении Р :

где 
a1 и a2 – соответственно начальный и конечный уровни воды в бюретке, мл.
2. Приведите найденный объем водорода к нормальным условиям 

где P – атмосферное давление по барометру, мм рт. ст.;
t – температура по термометру, ºС;
h – давление водяных паров при температуре опыта (по табл. 1), мм рт. ст.
3. Рассчитайте эквивалентную массу взятого металла по формуле:

Vэ(H) = 11,2 л/моль = 11200 мл/моль.
Источник