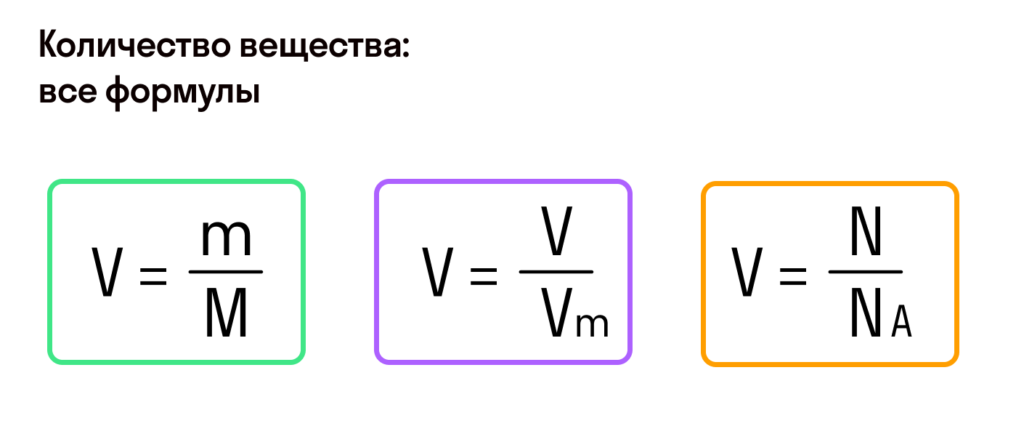
В этой статье мы собираемся проанализировать, как найти массу из молей и молярной массы.
Найти массу из молей и молярной массы очень просто. Это можно сделать, используя приведенное ниже соотношение:
Где,

n = количество молей (моль)
m = масса в граммах (г)
M = молярная масса (г/моль)
Мы можем лучше понять это, решив несколько примеров:
Как найти массу из молей и молярной массы Примеры:
1. Рассчитайте массу О2, если молярная масса равна 10.2 моль.
Решение:
Молярная масса = O2 = 16×2 = 32 г/моль
n = 10.2 моль
m = n × M = 10.2 моль × 32 г/моль = 326.4 г
2. На пляже XYZ в песке много минералов. SiO2 был одним из них, который был оценен, и у него было 12.5 молей, так какова масса SiO2 ?
Решение:
Молярная масса = SiO2 = 28 + 16×2 = 60 г.
n = 12.5 моль
m = n × M = 12.5 моль × 60 г/моль = 750 г
3. Рассчитайте массу 7.86 моль Хлорид кальция?
Решение:
Мы знаем, что формула хлорида кальция CaCl2.
Молярная масса = CaCl2 = 40 + 35.45×2 = 110.90 г/моль
n = 7.86 моль
m = n × M = 7.86 моль × 110.90 г/моль = 871.674 г
4. Студент в лаборатории приготовил 6.8 моль KNO3 и использовал его для титрования, поэтому для проведения расчетов какова будет его масса?
Решение:
Молярная масса = KNO3 = 39 + 14 + 3×16 = 110 г/моль
n = 6.8 моль
m = n×M = 6.8 моль × 110 г/моль = 748 г
5. Рассчитайте массу FeCl3 с числом молей, равным 5.7 моля.
Решение:
Молярная масса = FeCl3 = 55.845 +35.453×3 = 162.204 г/моль
n = 5.7 моль
m = n × M = 5.7 × 162.204 = 924.562 г
6. Рассчитайте массу 2.7 молей сульфата бария.
Решение:
Молярная масса = BaSO4 = 137.33 + 32.06 + 64 = 233.39 г/моль
n = 2.7 моль
м = п × М = 2.7 × 233.39 = 630.153 г
7. Рассчитайте массу 3.98 моль хлорида стронция.
Решение:
Молярная масса = SrCl2 = 87.62 + 35.453 + 35.453 = 158.52 г/моль.
n = 3.98 моль
м = п × М = 3.98 × 158.52 = 630.90 г
8. Рассчитайте массу 4.32 моля фосфата аммония.
Решение:
Молярная масса = (NH4)3PO4 = 14.01 × 3 + 12 + 30.97 + 16 = 149.12 г/моль.
n = 4.32 моль
м = п × М = 4.32 × 149.12 = 644.198 г
9. Рассчитайте массу 3.7 молей нитрата магния.
Решение:
Молярная масса = Mg(NO3)2 = 24 + 2×14 + 6×16 = 148 г/моль
n = 3.7 моль
м = п × М = 3.7 × 148 = 547.6 г
10.Рассчитайте массу 4.24 моль гидроксида алюминия.
Решение:
Молярная масса = Al(OH)3 = 27 + 16×3 + 3 = 78 г/моль
n = 4.24 моль
m = n × M = 4.24 × 78 = 330.72 г
11. Рассчитайте массу 1.49 моль йодида свинца (II).
Решение:
Молярная масса = PbI2 = 207.2 + 253.80 = 461 г/моль
n = 1.49 моль
m = n × M = 1.49 × 461 = 686.89 г
12. Рассчитайте массу 5.34 молей карбоната магния.
Решение:
Молярная масса = МгСО3 = 24 +12 + 16×3 =84 г/моль
n = 5.34 моль
m = n×M = 5.34 + 84 = 448.56 г
13.Рассчитайте массу 6.136 молей мышьяковой кислоты.
Решение:
Молярная масса = H3AsO4 = 3 + 74.9 + 3×16 = 141.9 г/моль
n = 6.136 моль
m = n × M = 6.136 × 141.9 = 870.69 г
14. Рассчитайте массу 4.59 моль карбоната лития.
Молярная масса = Li2CO3 = 13.88 + 12 + 3×16 = 73.89 г/моль
n = 4.59 моль
m = n × M = 4.59 × 73.89 = 339.15 г
15. Рассчитайте массу 4.999 молей бытового отбеливателя.
Решение:
Молярная масса = NaOCl = 23 + 16 + 35.4 = 74.4 г/моль
n = 4.999 моль
m = n × M = 4.99 × 74.4 = 371.92 г
16. Рассчитайте массу 2.156 моль дихромата калия.
Решение:
Молярная масса = K2Cr2O7 = 78 + 104 + 112 = 294 г/моль
n = 2.156 моль
m = n × M = 2.156 × 294 = 633.96 г
Узнайте больше о: Как Чтобы найти молярную массу из молярности: подробное объяснение
Как рассчитать молярную массу без массы ?
Обычно наиболее распространенным методом нахождения молярной массы является использование формулы M = m/n, которая подробно обсуждалась в предыдущем разделе.
Используя метод коллигативных свойств, мы можем вычислить молярную массу, не вдаваясь в картину. Давайте проанализируем, как в следующем разделе:
Бензол используется для растворения вещества (неизвестного вещества, молярная масса которого должна быть оценена) и доводится до 1.55 % (% массы неизвестной смеси к бензолу). Температура кипения бензола повышается примерно на 2.3%.
Учитывая коллигативные свойства:
Фактическая температура кипения бензола = 80 градусов по Цельсию.
ΔT = изменение температура кипения (1.84 градуса) 80×0.023
I = Вант-Гофф (коэффициент), для бензола считается быть одним, поскольку это не электролит.
m = моляльность
K = константа для бензола (точка кипения) составляет около 2.53.
Теперь,

= 1.84/1× 2.53
m = 0.728 моль (неизвестно)/кг бензола
Мы взяли смесь 1.55%.
Таким образом, на 1.55 г раствора приходится 1.55% массы, что означает 100 г неизвестного вещества.
Следовательно, неизвестная молярная масса будет отношением:
Молярная масса = рассчитанная из бензольного метода/ 0.728 моль
Голосование за лучший ответ
Free Sweeper
Искусственный Интеллект
(136364)
5 лет назад
массу КАКОГО В-ВА?
Воздушный потокЗнаток (342)
5 лет назад
H2S
Free Sweeper
Искусственный Интеллект
(136364)
тогда давай количество молекул.
Мля, что взяли за привычку написать какую-то хрень, а потом из вас тащить клещами ПОЛНОЕ задание.
Странник
Искусственный Интеллект
(306075)
5 лет назад
Высчитываете молекулярную массу вещества по его формуле, умножаете на количество молекул, видимо…
Патриция Творогова
Знаток
(407)
5 лет назад
m=M*n
M=Mr вещества (смотришь по таблице менделееа)
n=N/Na
Na=6*10 в 23 степени (постоянная)
получается что
m=Mr*N/Na
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
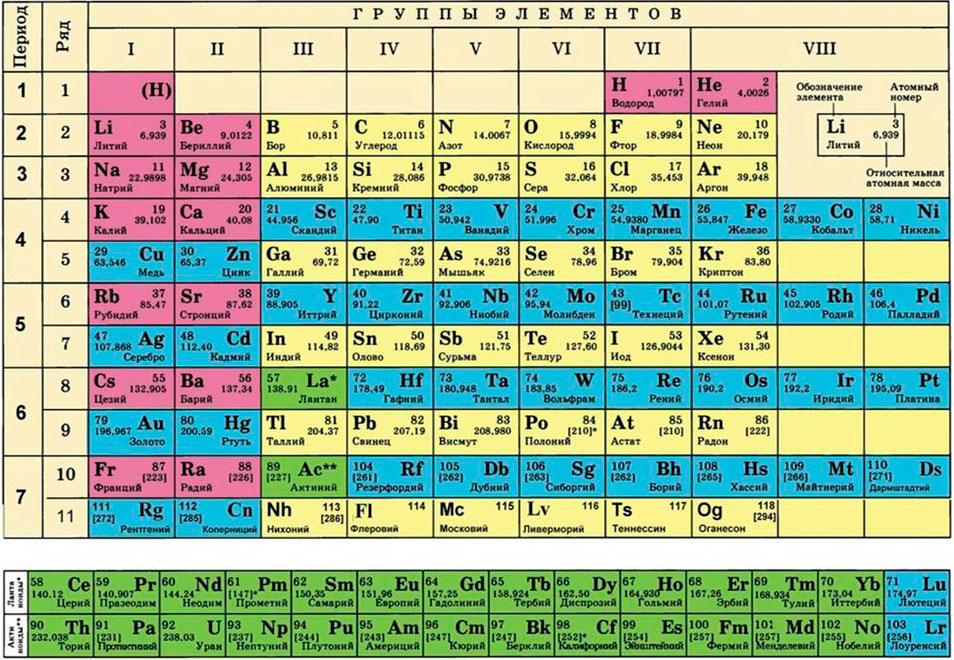
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Данная тема будет посвящена решению задач на определение
массы молекул и количества вещества.
Задача 1. Вычислите массу одной молекулы кислорода.
РЕШЕНИЕ
Как известно, в одном моле любого вещества содержится одно и
то же число молекул — число Авогадро
Если обозначить молярную массу вещества через M, то массу одной молекулы можно определить, как
отношение молярной массы вещества и числа Авогадро
Молярная масса молекулы кислорода
Тогда масса 1 молекулы кислорода равна
Ответ: масса одной молекулы кислорода
равна 5,3 ∙ 10−26 кг.
Задача 2. Молярная масса водорода 2 г/моль, а воды —
18 г/моль. Определите отношение числа молекул в 3 г водорода к числу молекул в
9 г воды.
|
ДАНО: |
РЕШЕНИЕ Число молекул в заданной порции любого вещества можно Тогда число молекул водорода в данной порции: Число молекул воды в данной порции: Тогда |
|
|
Ответ: молекул водорода в 3 раза
больше, чем молекул воды.
Задача 3. Из открытого стакана за 5 суток полностью
испарилось 50 г воды. Сколько молекул в среднем вылетало с поверхности
воды за 1 с?
|
ДАНО: |
СИ |
РЕШЕНИЕ Пусть в стакане содержалось N Число молекул воды в данной порции: Тогда искомое число молекул |
|
|
Ответ: в среднем с поверхности воды за
1 с вылетало 3,9 ∙ 1018 молекул.
Задача 4. Определите число молекул, содержащихся в 36
см3 ртути.
|
ДАНО: |
РЕШЕНИЕ Известно, что число молекул в одном моле любого вещества Для определения числа молекул ртути в заданной порции, необходимо |
|
|
Ответ: в 36 см3 ртути содержится 14,7
∙ 1023 молекул.
Задача 5. В озеро, имеющее среднюю глубину 10 м и
площадь поверхности 20 км2, бросили кристаллик поваренной соли
массой 0,01 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом
2 см3, зачерпнутой из озера, если полагать, что соль, растворившись,
равномерно распределилась по всему объему воды в озере?
|
ДАНО: |
СИ |
РЕШЕНИЕ Запишем формулу, по которой можно рассчитать число молекул соли Масса соли в данной порции раствора: Тогда число молекул соли в данной порции раствора: Химическая формула соли NaCl Тогда молярная масса соли равна |
|
|
Ответ: в наперстке оказалось бы
порядка 1 млн. молекул соли.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.