Раствор – однородная система, состоящая из растворителя и растворенного в нем вещества (или нескольких). Количественная характеристика определяется концентрацией веществ, входящих в их состав.
Массовая доля
Массовая доля – это отношение массы растворённого вещества к массе всего раствора.
ω(%)=mxmX×100%omega left(% right)= frac{m_{x}}{m_{X}} times 100%
Сколько калия хлорида (в граммах) содержится в 100г 10% раствора?
Решение:
Масса калия хлорида (молярная масса MM для KClKCl 75г/моль):
mKCl=ω×M100%=10%×75100%=7,5m_{KCl}=frac{omega times M}{100%}=frac{10% times 75}{100%}=7,5г
Ответ: 7,5г.
Сколько необходимо добавить натрия гидроксида к 120г 3% раствора этой же соли, что бы концентрация увеличилась в три раза?
Решение:
Масса натрия гироксида исходная (MNaOH=40M_{NaOH}=40 г/моль:
m1NaOH=ω×M100%=3%×40100%=1,2m_{1NaOH}=frac{omega times M}{100%}=frac{3%times 40}{100%}=1,2г
Массовая доля натрия гидроксида в необходимом растворе:
ω2%=ω%×3=3%×3=9%omega _{2}%=omega%times3=3%times3=9%
Масса NaOH в необходимом растворе:
m2NaOH=9%×40100%=3,6m_{2NaOH}=frac{9%times 40}{100%}=3,6г
Необходимое количество рассчитываем как разность:
mNaOH=m2NaOH−m1NaOH=3,6−1,2=2,4m_{NaOH}=m_{2NaOH}-m_{1NaOH}=3,6-1,2=2,4г
Ответ: 2,4г.
Молярная концентрация
Молярная концентрация – количество вещества (в молях) в объеме раствора.
Количество растворенного вещества (в молях) выражается как масса вещества (в граммах), деленная на молярную массу (г/моль).
η=mxMeta =frac{m_{x}}{M}
Молярная концентрация выражается в формуле:
Cx=ηV=η=mxM×VC_{x} = frac{eta }{V} = eta =frac{m_{x}}{M}times V
Определите молярную концентрацию калия иодида. В 120мл воды содержится 15г KI.
Решение:
Выражаем молярную концентрацию (моль/л) KI по формуле ($M_(KI)=$166г/моль):
CKI=mKIMKI×VC_{KI} =frac{m_{KI}}{M_{KI}}times V=15166×0,12=0,01=frac{15}{166}times 0,12=0,01моль/л
Т.к. молярная концентрация выражается в моль/л миллилитры переводим в литры.
Ответ: 3,61 моль/л.
Какая масса лития хлорида содержится в 200мл 3М раствора?
Решение:
Находим количество растворенного лития хлорида (моль):
η=CLiCl×V=3×0,2=0,6eta =C_{LiCl}times V=3times 0,2=0,6г
Выражаем массу M(LiCl)=M_ (LiCl)= 42,3г/моль):
mLiCl=ηLiCl×MLiCl=0,6×42.3=25,4m_{LiCl}=eta_{LiCl} times M_{LiCl}=0,6times 42.3=25,4г
Ответ: 25,4г.
Молярная (мольная) доля
Молярная (мольная) доля – отношения количества вещества в растворе к количеству всех веществ, образующих раствор.
Nx%=nx∑n×100%N_{x}%=frac{n_{x}}{sum{n}}times 100%
Концентрация бария хлорида в 100мл водного раствора равна 20%. Определите его мольную долю.
MBaCl2=208M_{BaCl_{2}}=208моль/л, MH2O=18M_{H_{2}O}=18моль/л.
Решение:
Находим содержание воды:
ωH2O=100%−ωBaCl2=100%−20%=80%omega _{H_{2}O}=100%-omega BaCl_{2}=100%-20%=80%
Т.к. объем раствора равен 100мл, то массы каждого компонента равны значениям массовой доли. Следовательно:
mBaCl2=20m_{BaCl_{2}}=20г
mH2O=80m_{H_{2}O}=80г
Определим количество ηeta для бария хлорида и воды:
ηBaCl2=mBaCl2MBaCl2=20208=0,01eta_{BaCl_{2}}=frac{m_{BaCl_{2}}}{M_{BaCl_{2}}}=frac{20}{208}=0,01моль
ηH2O=mH2OMH2O=2018=1,1eta_{H_{2}O}=frac{m_{H_{2}O}}{M_{H_{2}O}}=frac{20}{18}=1,1моль
Определяем мольную долю NBaCl2N_{BaCl_{2}}:
NBaCl2=ηBaCl2ηBaCl2+ηH2O×100%=0,010,01+0,1×100%=9%N_{BaCl_{2}}=frac{eta BaCl_{2}}{eta BaCl_{2}+eta H_{2}O}times 100%=frac{0,01}{0,01+0,1}times 100%=9%
Ответ: 9%
Молярная концентрация эквивалента
Молярная концентрация эквивалента (нормальность) – число моль эквивалентов в объеме раствора.
C1/z=mxM1/z×VC_{1/z} = frac{m_{x}}{M_{1/z}times V}моль*экв/литр
Фактор эквивалентности f1/zf_{1/z} – показывает часть реальной частицы, составляющую эквивалент.
Молярная масса эквивалента M1/zM_{1/z} – произведение молярной массы и фактора эквивалентности:
M1/z=M×f1/zM_{1/z} = M times f_{1/z}г/моль
Определите молярную концентрацию эквивалента 4.6г серной кислоты, нейтрализованной раствором гидроксида натрия. В результате реакции общий объём составил 100мл.
Решение:
MH2SO4=98M_{H_{2}SO_{4}}=98г/моль, f1/z=1/2f_{1/z=1/2}.
Находим молярную массу эквивалента для серной кислоты:
M1/zH2SO4=MH2SO4×f1/zM_{1/z H_{2}SO_{4}} = M _{H_{2}SO_{4}}times f_{1/z} = 98times 1/2=49$г/моль
Находим нормальность:
C1/zH2SO4=mH2SO4M1/zH2SO4×V=4,649×0,1=0,94C_{1/z H_{2}SO_{4}} = frac{m_{H_{2}SO_{4}}}{M_{1/z H_{2}SO_{4}}times V}=frac{4,6}{49times
0,1}=0,94моль*экв/л
Ответ: 0,94моль*экв/л.
Моляльность
Моляльность – количество вещества в килограмме растворителя.
Сm=ηxmС_{m}=frac{eta _{x}}{m}моль/кг
В 300г воды растворили 20г калия гидроксида. Определите моляльную концентрацию раствора.
Решение:
MKOH=98M_{KOH}=98г/моль.
Находим количество калия гидроксида:
ηKOH=mKOHM=2056=0,36eta _{KOH} = frac{m_{KOH}}{M}=frac{20}{56}=0,36моль
Находим моляльность (граммы переводим в килограммы):
CKOH=ηKOHm=0,360,3=1,2C_{KOH}=frac{eta _{KOH}}{m}=frac{0,36}{0,3}=1,2моль/кг
Ответ: 1,2 моль/кг.
Молярная концентрация (молярность)
– это количество моль вещества,
содержащееся в 1 литре раствора.
С(Х) =
![]() ,
,
моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора
следующим образом:
V =
![]() ,
,
мл,
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента
– это количество моль вещества
эквивалента, содержащееся в 1 литре
раствора.
С(![]() Х)
Х)
=
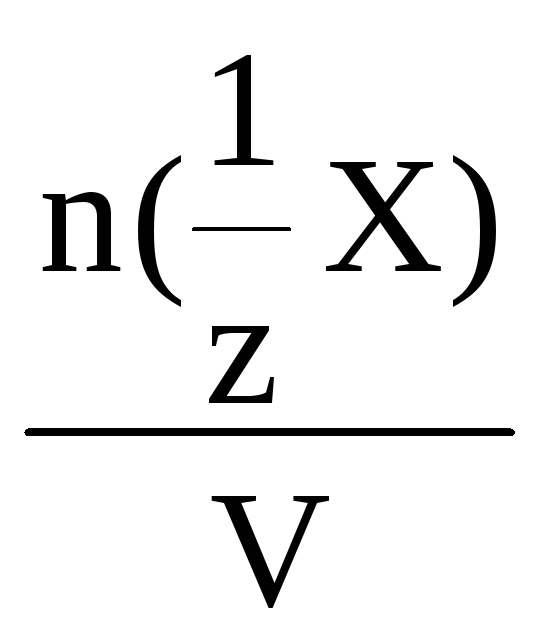 ,
,
моль/л
где n(![]() Х)
Х)
– количество вещества эквивалента,
моль;
V – объем раствора, л.
n(![]() Х)
Х)
=
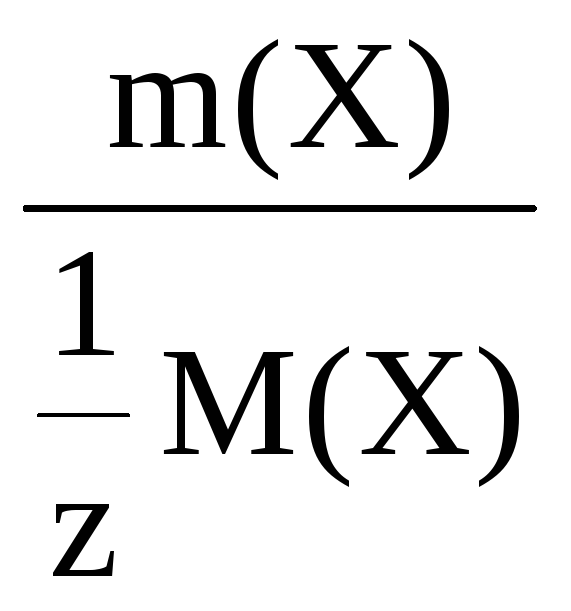
=
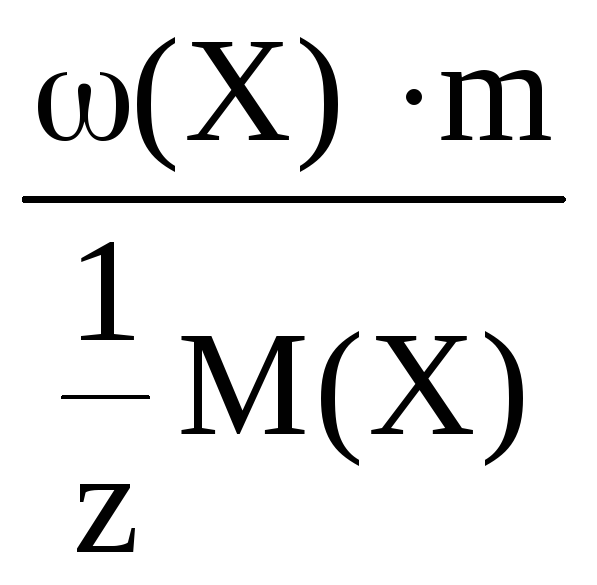
где m(X) –
молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента
всегда больше или равна молярной
концентрации. Это положение используется
при проверке полученных данных.
С(![]() Х)
Х)
=
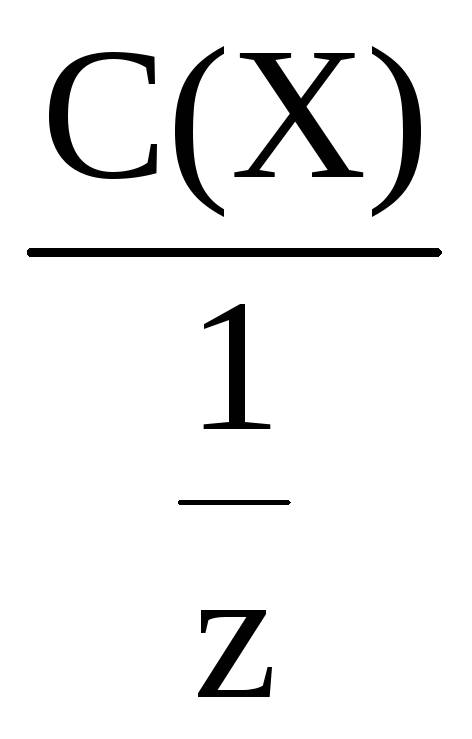
Молярную концентрацию эквивалента
часто называют нормальной и обозначают
1,0
н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы
позволяют определять объем раствора,
количество вещества и количество
вещества эквивалента:
V =
![]() или V
или V
=
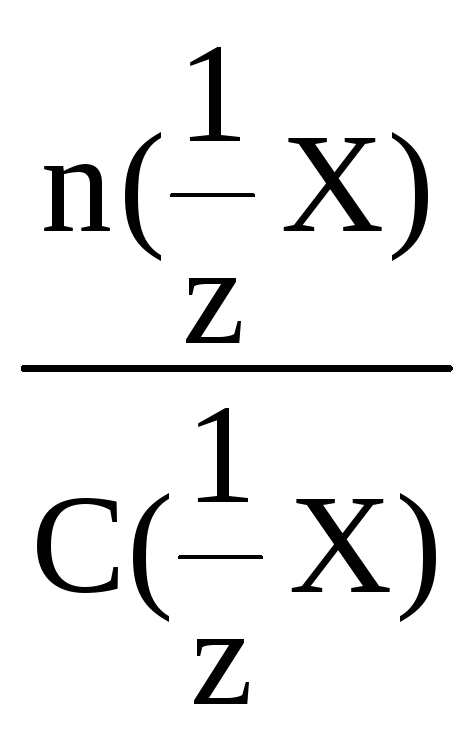
n(X) = C(X)·V или n(![]() X)
X)
= C(![]() X)·V
X)·V
2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
Пример 1. Рассчитать молярную
концентрацию и молярную концентрацию
эквивалента K2CrO4, если в 0,55
л раствора растворено 14,7 г вещества
(реакции обменные).
Решение:
С(K2CrO4) =
![]()
=
![]()
=
![]()
= 0,14 моль/л
Далее определяем фактор эквивалентности
K2CrO4, он равен
![]() .
.
С(![]() K2CrO4)
K2CrO4)
=
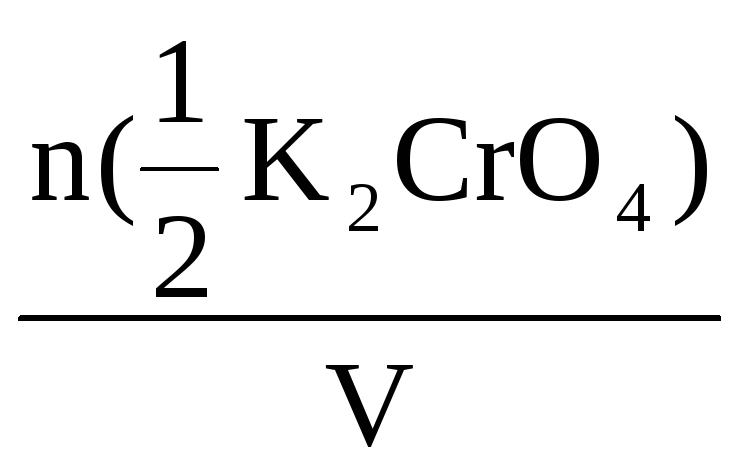
=
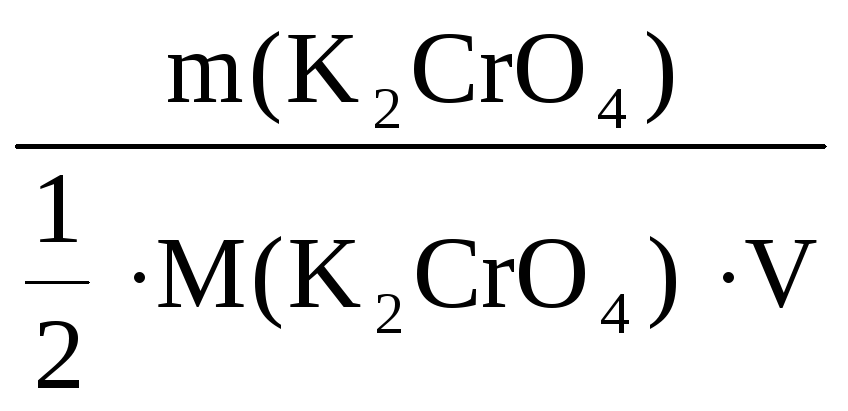
=
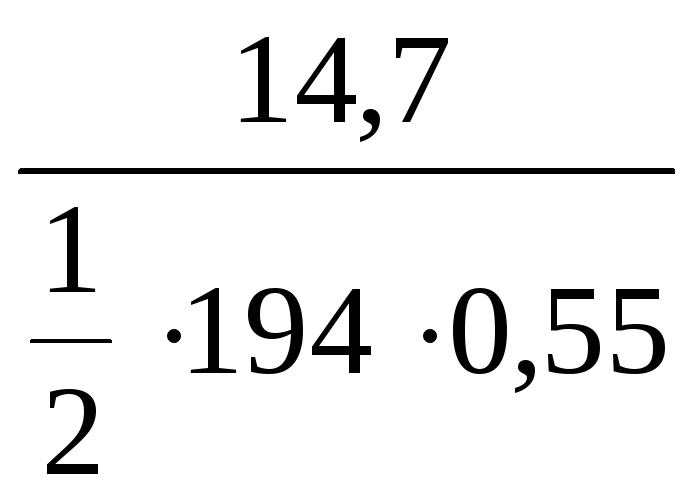
= 0,28 моль/л
или С(![]() K2CrO4)
K2CrO4)
= z·С(K2CrO4) = 0,14·2 = 0,28 моль/л.
Ответ: С(K2CrO4) = 0,14 моль/л;
С(![]() K2CrO4)
K2CrO4)
= 0,28 моль/л
Пример 2. Определить массу вещества,
содержащегося в 200 мл раствора нитрата
никеля с молярной концентрацией
С(Ni(NO3)2) = 0,125 моль/л.
Решение:
m(Ni(NO3)2) = n(Ni(NO3)2)·m(Ni(NO3)2)
Объем раствора необходимо перевести в
литры: 200 мл = 0,2 л.
n(Ni(NO3)2) = C(Ni(NO3)2)·V
= 0,125·0,2 = 0,025 моль
m(Ni(NO3)2) = 0,025·183 = 4,575 г
Ответ: m(Ni(NO3)2) = 4,575 г.
Пример 3. Рассчитать молярную
концентрацию эквивалента в растворе
HCl. ω(HCl) = 25%, ρ = 1,15 г/мл.
Решение:
С(HCl) =
![]()
=
![]()
m(HCl) = ω(HCl)·m(р-ра) = ω(HCl)·V(р-ра) ρ
Если объем раствора не задан, то удобно
принимать его равным 1 л (1000 мл).
m(HCl) = 0,25·1000·1,15 = 287,5 г
С(HCl) =
![]()
= 7,877 моль/л
Фактор эквивалентности HCl = 1, поэтому
молярная концентрация и молярная
концентрация эквивалента равны.
Ответ: молярная концентрация
эквивалента С(HCl) = 7,877 моль/л.
Пример 4. В 0,6 л воды растворили
100 л бромоводорода. Рассчитать С(HBr) в
растворе, если ρ = 1,15 г/мл.
Решение:
С(HBr) =
![]()
Рассчитываем количество вещества
бромоводорода:
n(HBr) =
![]() =
=
![]() =
=
4,464 моль
Рассчитываем объем раствора:
V =
![]()
=
![]()
=
![]()
V =
![]()
= 836 мл = 0,836 л
Находим молярную концентрацию раствора
HBr:
С(HBr) =
![]()
= 5,34 моль/л
Ответ: С(HBr) = 5,34 моль/л
Пример 5. Рассчитать молярную и
молярную концентрацию эквивалента
раствора мышьяковой кислоты (H3AsO4).
Плотность раствора 1,08 г/мл, массовая
доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4
=
![]()
С(H3AsO4) =
![]() С(
С(![]() H3AsO4)
H3AsO4)
=
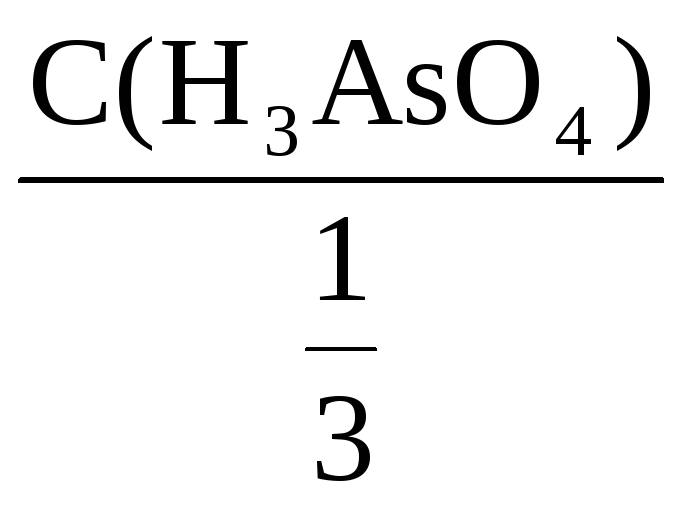
= 3С(H3AsO4)
Объем раствора принимаем равным 1 л =
1000 мл.
m(H3AsO4) = V·ρ·ω(H3AsO4)
= 1000·1,08·0,09 = 97,2 г
n(H3AsO4) =
![]()
=
![]()
= 0,68 моль
С(H3AsO4) =
![]()
= 0,68 моль/л; С(![]() H3AsO4)
H3AsO4)
= 3·0,68 = 2,04 моль/л
Ответ: С(H3AsO4) = 0,68 моль/л,
С(![]() H3AsO4)
H3AsO4)
= 2,04 моль/л
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор


Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.

Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
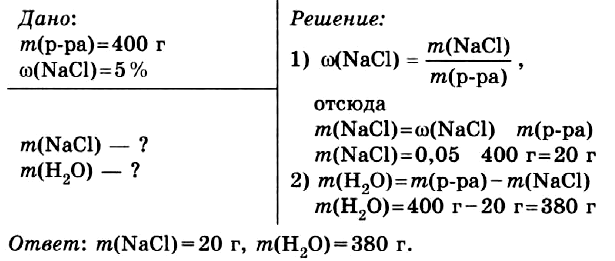
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради

Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ученик
(75),
закрыт
9 лет назад
Екатерина Ганженко
Высший разум
(132658)
9 лет назад
Mr(LiOH) = 24 г/моль – молярная масса . m (LiOH) = Mr*n = 24*0.005 =0.12 г – масса гидроксида лития в 1 литре раствора . m (раствора) = p*V = 1*1000 = 10000г – масса 1л раствора, w:LiOH) = 0.12*100/1*1000 = 0.012% -массовая доля гидроксида в растворе
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Растворы. Способы выражения концентрации растворов
Способы выражения концентрации растворов
Существуют различные способы выражения концентрации растворов.
Массовая доля ω компонента раствора определяется как отношение массы данного компонента Х, содержащегося в данной массе раствора к массе всего раствора m. Массовая доля – безразмерная величина, её выражают в долях от единицы:
ωр.в. = mр.в./mр-ра (0 < ωр.в. < 1) (1)
Массовый процент представляет собой массовую долю, умноженную на 100:
ω(Х) = m(Х)/m · 100% (0% < ω(Х) < 100%) (2)
где ω(X) – массовая доля компонента раствора X; m(X) – масса компонента раствора X; m – общая масса раствора.
Мольная доля χ компонента раствора равна отношению количества вещества данного компонента X к суммарному количеству вещества всех компонентов в растворе.
Для бинарного раствора, состоящего из растворённого вещества Х и растворителя (например, Н2О), мольная доля растворённого вещества равна:
χ(X) = n(X)/(n(X) + n(H2O)) (3)
Мольный процент представляет мольную долю, умноженную на 100:
χ(X), % = (χ(X)·100)% (4)
Объёмная доля φ компонента раствора определяется как отношение объёма данного компонента Х к общему объёму раствора V. Объёмная доля – безразмерная величина, её выражают в долях от единицы:
φ(Х) = V(Х)/V (0 < φ(Х) < 1) (5)
Объёмный процент представляет собой объёмную долю, умноженную на 100.
φ(X), % = (φ(X)·100)%
Молярность (молярная концентрация) C или Cм определяется как отношение количества растворённого вещества X, моль к объёму раствора V, л:
Cм(Х) = n(Х)/V (6)
Основной единицей молярности является моль/л или М. Пример записи молярной концентрации: Cм(H2SO4) = 0,8 моль/л или 0,8М.
Нормальность Сн определяется как отношение количества эквивалентов растворённого вещества X к объёму раствора V:
Cн(Х) = nэкв.(Х)/V (7)
Основной единицей нормальности является моль-экв/л. Пример записи нормальной концентрации: Сн(H2SO4) = 0,8 моль-экв/л или 0,8н.
Титр Т показывает, сколько граммов растворённого вещества X содержится в 1 мл или в 1 см3 раствора:
T(Х) = m(Х)/V (8)
где m(X) – масса растворённого вещества X, V – объём раствора в мл.
Моляльность раствора μ показывает количество растворённого вещества X в 1 кг растворителя:
μ(Х) = n(Х)/mр-ля (9)
где n(X) – число моль растворённого вещества X, mр-ля – масса растворителя в кг.
Мольное (массовое и объёмное) отношение – это отношение количеств (масс и объёмов соответственно) компонентов в растворе.
Необходимо иметь ввиду, что нормальность Сн всегда больше или равна молярности См. Связь между ними описывается выражением:
См = Сн · f(Х) (10)
Для получения навыков пересчёта молярности в нормальность и наоборот рассмотрим табл. 1. В этой таблице приведены значения молярности См, которые необходимо пересчитать в нормальность Сн и величины нормальности Сн, которые следует пересчитать в молярность См.
Пересчёт осуществляем по уравнению (10). При этом нормальность раствора находим по уравнению:
Сн = См/f(Х) (11)
Результаты расчётов приведены в табл. 2.
Таблица 1. К определению молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2 M Na2SO4 | ? | 6 н FeCl3 | ? |
| 1,5 M Fe2(SO4)3 | ? | 0,1 н Ва(ОН)2 | ? | |
| Реакции окисления-восстановления | 0,05 М KMnO4
в кислой среде |
? | 0,03 М KMnO4
в нейтральной среде |
? |
Таблица 2
Значения молярности и нормальности растворов
| Тип химического превращения | См | Сн | Сн | См |
| Реакции обмена | 0,2M Ma2SO4 | 0,4н | 6н FeCl3 | 2М |
| 1,5M Fe2(SO4)3 | 9н | 0,1н Ва(ОН)2 | 0,05М | |
| Реакции окисления-восстановления | 0,05М KMnO4 в кислой среде | 0,25н | 0,03М KMnO4
в нейтральной среде |
0,01М |
Между объёмами V и нормальностями Сн реагирующих веществ существует соотношение:
V1 Сн,1 =V2 Сн,2 (12)
Примеры решения задач
Задача 1. Рассчитайте молярность, нормальность, моляльность, титр, мольную долю и мольное отношение для 40 мас.% раствора серной кислоты, если плотность этого раствора равна 1,303 г/см3.
Решение.
Масса 1 литра раствора равна М = 1000·1,303 = 1303,0 г.
Масса серной кислоты в этом растворе: m = 1303·0,4 = 521,2 г.
Молярность раствора См = 521,2/98 = 5,32 М.
Нормальность раствора Сн = 5,32/(1/2) = 10,64 н.
Титр раствора Т = 521,2/1000 = 0,5212 г/см3.
Моляльность μ = 5,32/(1,303 – 0,5212) = 6,8 моль/кг воды.
Обратите внимание на то, что в концентрированных растворах моляльность (μ) всегда больше молярности (См). В разбавленных растворах наоборот.
Масса воды в растворе: m = 1303,0 – 521,2 = 781,8 г.
Количество вещества воды: n = 781,8/18 = 43,43 моль.
Мольная доля серной кислоты: χ = 5,32/(5,32+43,43) = 0,109. Мольная доля воды равна 1– 0,109 = 0,891.
Мольное отношение равно 5,32/43,43 = 0,1225.
Задача 2. Определите объём 70 мас.% раствора серной кислоты (r = 1,611 г/см3), который потребуется для приготовления 2 л 0,1 н раствора этой кислоты.
Решение.
2 л 0,1н раствора серной кислоты содержат 0,2 моль-экв, т.е. 0,1 моль или 9,8 г.
Масса 70%-го раствора кислоты m = 9,8/0,7 = 14 г.
Объём раствора кислоты V = 14/1,611 = 8,69 мл.
Задача 3. В 5 л воды растворили 100 л аммиака (н.у.). Рассчитать массовую долю и молярную концентрацию NH3 в полученном растворе, если его плотность равна 0,992 г/см3.
Решение.
Масса 100 л аммиака (н.у.) m = 17·100/22,4 = 75,9 г.
Масса раствора m = 5000 + 75,9 = 5075,9 г.
Массовая доля NH3 равна 75,9/5075,9 = 0,0149 или 1,49 %.
Количество вещества NH3 равно 100/22,4 = 4,46 моль.
Объём раствора V = 5,0759/0,992 = 5,12 л.
Молярность раствора См = 4,46/5,1168 = 0,872 моль/л.
Задача 4. Сколько мл 0,1М раствора ортофосфорной кислоты потребуется для нейтрализации 10 мл 0,3М раствора гидроксида бария?
Решение.
Переводим молярность в нормальность:
0,1 М Н3РО4 0,3 н; 0,3 М Ва(ОН)2 0,6 н.
Используя выражение (12), получаем: V(H3P04)=10·0,6/0,3 = 20 мл.
Задача 5. Какой объем, мл 2 и 14 мас.% растворов NaCl потребуется для приготовления 150 мл 6,2 мас.% раствора хлорида натрия?
Плотности растворов NaCl:
| С, мас.% | 2 | 6 | 7 | 14 |
| ρ, г/см3 | 2,012 | 1,041 | 1,049 | 1,101 |
Решение.
Методом интерполяции рассчитываем плотность 6,2 мас.% раствора NaCl:
6,2% =6% + 0,2(7% —6% )/(7 – 6) = 1,0410 + 0,0016 = 1,0426 г/см3.
Определяем массу раствора: m = 150·1,0426 = 156,39 г.
Находим массу NaCl в этом растворе: m = 156,39·0,062 = 9,70 г.
Для расчёта объёмов 2 мас.% раствора (V1) и 14 мас.% раствора (V2) составляем два уравнения с двумя неизвестными (баланс по массе раствора и по массе хлорида натрия):
156,39 = V1 1,012 + V2 1,101 ,
9,70 = V1·1,012·0,02 + V2·1,101·0,14 .
Решение системы этих двух уравнений дает V1 =100,45 мл и V2 = 49,71 мл.
Задачи для самостоятельного решения
3.1. Рассчитайте нормальность 2 М раствора сульфата железа (III), взаимодействующего со щёлочью в водном растворе.
12 н.
3.2. Определите молярность 0,2 н раствора сульфата магния, взаимодействующего с ортофосфатом натрия в водном растворе.
0,1 M.
3.3. Рассчитайте нормальность 0,02 М раствора KMnO4, взаимодействующего с восстановителем в нейтральной среде.
0,06 н.
3.4. Определите молярность 0,1 н раствора KMnO4, взаимодействующего с восстановителем в кислой среде.
0,02 M.
3.5. Рассчитать нормальность 0,2 М раствора K2Cr2O7, взаимодействующего с восстановителем в кислой среде.
1,2 M.
3.6. 15 г CuSO4·5H2O растворили в 200 г 6 мас.% раствора CuSO4. Чему равна массовая доля сульфата меди, а также молярность, моляльность и титр полученного раствора, если его плотность составляет 1,107 г/мл?
0,1; 0,695М; 0,698 моль/кг; 0,111 г/мл.
3.7. При выпаривании 400 мл 12 мас.% раствора KNO3 (плотность раствора 1,076 г/мл) получили 2М раствор нитрата калия. Определить объём полученного раствора, его нормальную концентрацию и титр.
255 мл; 2 н; 0,203 г/мл.
3.8. В 3 л воды растворили 67,2 л хлороводорода, измеренного при нормальных условиях. Плотность полученного раствора равна 1,016 г/мл. Вычислить массовую, мольную долю растворённого вещества и мольное отношение растворённого вещества и воды в приготовленном растворе.
0,035; 0,0177; 1:55,6.
3.9. Сколько граммов NaCl надо добавить к 250 г 6 мас.% раствору NaCl, чтобы приготовить 500 мл раствора хлорида натрия, содержащего 16 мас.% NaCl? Плотность полученного раствора составляет 1,116 г/мл. Определить молярную концентрацию и титр полученного раствора.
74,28 г; 3,05 М; 0,179 г/мл.
3.10. Определить массу воды, в которой следует растворить 26 г ВaCl2·2H2O для получения 0,55М раствора ВaCl2 (плотность раствора 1,092 г/мл). Вычислить титр и моляльность полученного раствора.
192,4 г; 0,111 г/мл; 0,56 моль/кг.
