- Формула: C2H6 или CH3CH3
- Относительная молекулярная масса C2H6: 30.06904
- Молярная масса C2H6: 30.06904 г/моль (0.03007 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| C (углерод) | 2 | 12.0107 | 24.0214 |
| H (водород) | 6 | 1.00794 | 6.04764 |
| 30.06904 |
Расчёт молярной и относительной молекулярной массы C2H6
- Mr[C2H6] = Ar[C] * 2 + Ar[H] * 6 = 12.0107 * 2 + 1.00794 * 6 = 30.06904
- Молярная масса (в кг/моль) = Mr[C2H6] : 1000 = 30.06904 : 1000 = 0.03007 кг/моль
Расчёт массовых долей элементов в C2H6
- Массовая доля углерода (C) = 24.0214 : 30.06904 * 100 = 79.887 %
- Массовая доля водорода (H) = 6.04764 : 30.06904 * 100 = 20.113 %
Калькулятор массы
Тема: Помогите вычислить массу молекулы этана, относительную плотность … (Прочитано 3122 раз)
0 Пользователей и 1 Гость просматривают эту тему.
1) Вычислите массу 1 молекулы этана и относительную плотность его по водороду и воздуху.
2) Вычислить осмотическое давление 0,25 молярного раствора сахара при температуре 38
« Последнее редактирование: 22 Ноября 2010, 12:54:20 от Asix »

#1:
( Mleft( C_{2}H_{6}right)=30 )
( mleft( C_{2}H_{6}right)=frac{m}{N_{a}}=frac{30}{6cdot 10^{23} }=5cdot 10^{-23} )
( Mleft( H_{2}right)=2 )
( M_{BO3}=29 )
( Mleft( C_{2}H_{6}right)=30 )
( rho _{H_{2}}=frac{30}{2}=15 )
( rho_{BO3}=frac{30}{29}=1.03 )
« Последнее редактирование: 22 Ноября 2010, 12:54:26 от Asix »

за помощь неплохо было бы и плюсик поставить))
#2:
( Mleft( C_{12}H_{22}O_{11}right)=342 )
1моль-342г
хмоль-25г
х=0.07 моль
( T=273+38=311K )
( rho =Ccdot Rcdot T )
( rho =0.07cdot 8.31cdot 311=181 )кДж
« Последнее редактирование: 22 Ноября 2010, 12:54:33 от Asix »

за помощь неплохо было бы и плюсик поставить))
Найдите правильный ответ на вопрос ✅ «Вычислите массу 5 л этана (С^2H^6) …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Вычислите массу 5 л этана (С^2H^6)
1. (н.у.) нормальные условия – условия, при которых работают стандартные химические формулы связанные с объёмами газов
*кхем-кхем*
101 325 Па и т. 273.15К(0°С) – лишь определение нормальных условий. Эти данные нам абсолютно бесполезны.
Итак, воспользуемся стандартной формулой: n = V(газа)V(молярный),
где n – количество вещества (моль).
V(молярный) – константа, всегда равен 22,4 лмоль :
n (C₂H₆) = 3,3622,4 = 0,15 моль
Далее нам понадобится формула: m = n × M
M (C₂H₆) = 12×2+1×6= 30 гмоль
m (C₂H₆) = 0,15×30 = 4,5 г
Ответ: 4,5 г
2. используем уже ранее названные формулы:
n = mM,
M (СH₄) = 12+1×4= 16 гмоль
n (CH₄) = 6,416 = 0,4 моль
V(газа) = n×V(молярный)
V (CH₄) = 0,4×22,4 = 9 л
Ответ: 9 л
3. Перед началом исчислений необходимо привести все значения к стандарту С.И:
9 мг = 0,009 г
теперь воспользуемся формулой:
N = m/M × N(aв),
N(ав) – константа, всегда равняется 6,02×10²³
M (C₂H₂O₄) = 12×2 + 1×2 + 16×4 = 68 гмоль
N (C₂H₂O₄) = 0,00968 × 6,02×10²³ = 9×10²⁰
Ответ: 9×10²⁰
Как найти массу этана
На чтение 2 мин Опубликовано 18.02.2022
Определение истинной формулы этана по плотности его паров
Задача 1.27.
В результате анализа некоторого образца газообразного углеводорода в нем обнаружено 5,92 г углерода и 1,48 г водорода. Плотность паров этого вещества при нормальных условиях составляла 1,34 г/л. Найти молекулярную формулу углеводорода.
Дано:
масса углерода: m(С) = 5,92 г;
масса водорода: m(Н) = 18,33 г;
плотность паров искомого вещества: р(СхНу) = 1,34 г/л.
Найти: молекулярную формулу углеводорода.
Решение:
Шаг 1. В состав углеводорода входит только углерод и водород. Обозначим формулу как СхНу. Следовательно, требуется определить неизвестные индексы х, у.
Шаг 2. В условии нет указаний на химическую реакцию.
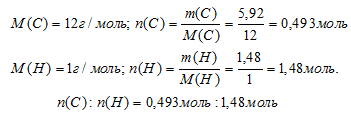
Шаг 4. Находим простейшую формулу.
Выбираем наименьшее значение (в данном случае «0,493») и делим на него оба числа:
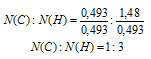
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1Н3.
Шаг 5. Выявление истинной формулы.
Вещества с формулой СН3 не существует. В истинной формуле индексы будут в некоторое число раз больше, чем в простейшей. Для определения, во сколько раз необходимо увеличить индексы в простейшей формуле, сравним истинную молярную массу искомого вещества с молярной массой простейшей формулы. Молярную массу истинной формулы можно определить, используя данные о плотности вещества из условия, по алгоритму:
Плотность искомого газообразного вещества составляет 1,34 г/л при н.у. Это значит, что 1 л этого газа имеет массу 1,34 г. Определим массу 22,4 л по пропорции:
1,34 г — масса 1 л газа
х г — масса 22,4 л газа
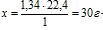 — масса 22,4 л искомого газообразного вещества при нормальных условиях.
— масса 22,4 л искомого газообразного вещества при нормальных условиях.
По закону Авогадро 22,4 л — это объем одного моля любого газа при нормальных условиях. Следовательно, 30 г — это масса 1 моль искомого газа, а это и есть его молярная масса:
Определим значение молярной массы для простейшей формулы:
Истинная молярная масса больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
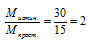
Источник

