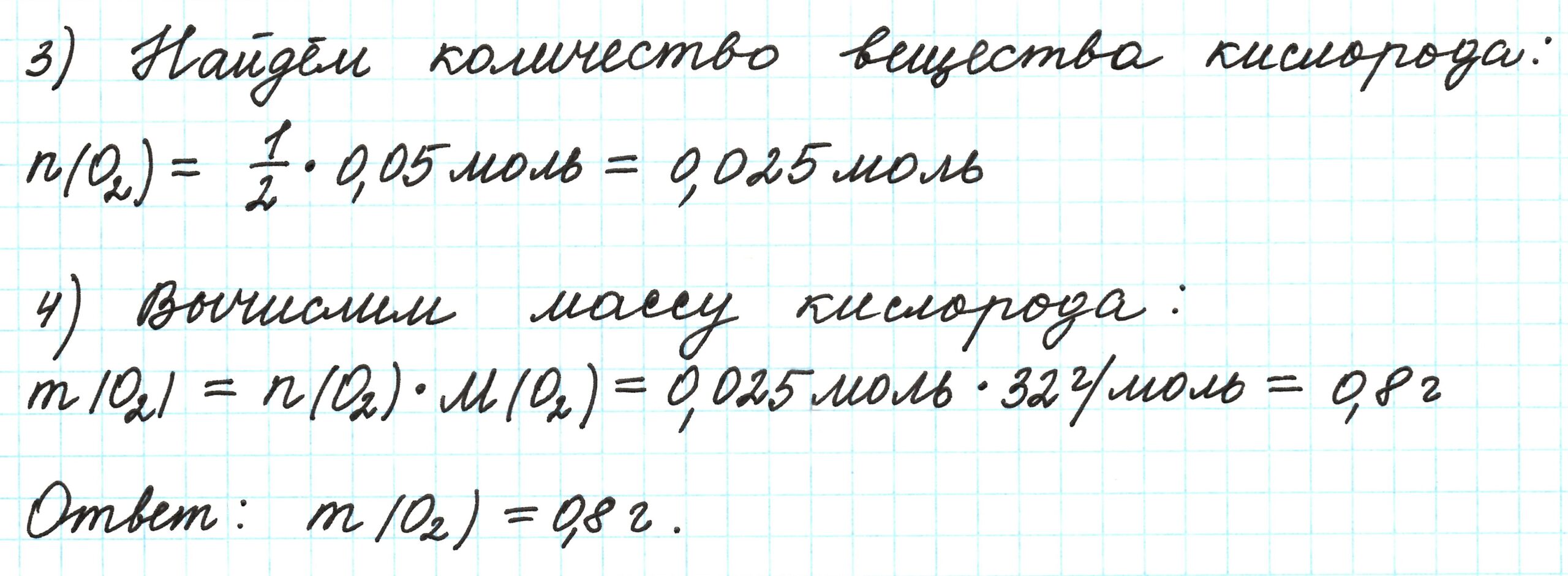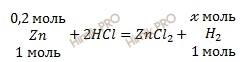РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Вычислить объем водорода
13,5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H2) составляет 85 % . Вычислить объем водорода, который выделился?
Решение задачи
Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Учитывая, что молярная масса цинка (Zn) равна 65 г/моль (смотри таблицу Менделеева), найдем химическое количество цинка (Zn) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (Zn) = 13,5 / 65 = 0,2 (моль).
Вычислить объем водорода. По уравнению реакции найдем химическое количество водорода (H2) (теоретический выход), который выделяется в ходе реакции:
1 моль Zn вытесняет 1 моль водорода (H2)
0,2 моль Zn вытесняет х моль водорода (H2)
Откуда:
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем водорода, который образуется в ходе реакции:
Получаем:
V теор.(H2) = 0,2 ∙ 22,4 = 4,48 (л).
Вычислим объем водорода практический по формуле:
Получаем:
V практ. (H2) = 85 ⋅ 4,48 / 100 = 3,81 (л).
Ответ:
объем водорода равен 3,81 литра.
В данном задании вам необходимо определить массу водорода и кислорода, полученного при разложении воды, исходя из следующих данных:
Масса воды равна – 72 г.
Запишите порядок решения задачи
- Запишите уравнение реакции;
- Определите массу водорода;
- Определите массу кислорода.
Запишите решение для определения массы водорода и кислорода
- Сначала запишите уравнение реакции.
2Н2О = 2Н2 + О2.
- По уравнению реакции определите массу водорода. Для этого сначала необходимо посчитать молярную массу воды и водорода.
М (Н2О) = 1 * 2 + 16 = 18 г/моль.
М (Н2) = 1 * 2 = 2 г/моль.
Составьте пропорцию.
72 г воды – х г водорода.
2 * 18 г/моль воды – 2 * 2 г/моль водорода.
Определите неизвестное значение х.
Х = 72 * 2 * 2 : (2 * 18) = 8 г.
Следовательно, будет получено 8 грамм водорода.
- Далее определите массу кислорода.
М (О2) = 2 * 16 = 32 г/моль.
72 г воды – у г кислорода.
2 * 18 г/моль воды – 32 г/моль кислорода.
Определите неизвестное значение у.
у = 72 * 32 : (2 * 18) = 64 г.
Следовательно, масса кислорода равна 64 грамм.
Ответ: m (H2) = 8 г; m (O2) = 64 г.
Расчёты по химическим уравнениям в 8 классе – одна из важнейших тем. Уметь делать такие расчёты нужно и тем, кто просто изучает химию в рамках школьного курса, и химикам, которым требуется узнать, сколько нужно взять тех или иных веществ, чтобы провести реакцию. Ключевыми понятиями в таких расчётах являются моль, молярная масса и молярный объём (когда речь идёт о газообразных веществах.).
Перед тем, как проводить расчёты по химическим уравнениям, нужно первым делом правильно записать само уравнение. Коэффициенты уже будут подсказкой и покажут, в каких соотношениях вступают в реакцию исходные вещества и в каком количестве они получаются. Будьте внимательны при уравнивании уравнений, от правильности расстановки коэффициентов зависит правильность ответа. Ну а чтобы всё стало понятнее, давайте прорешаем несколько задач.
Пример 1
Натрий вступил в реакцию с водой. При этом образовался гидроксид натрия и газообразный водород. Известно, что было использовано 57,5 г натрия. Определите, сколько граммов гидроксида натрия получилось и сколько литров водорода выделилось.
Решение.
Для начала запишем уравнение:
2Na + 2Н2О = 2NaОН + Н2
Их уравнения видно, что 2 моля натрия дают после реакции 2 моля гидроксида натрия и 1 моль водорода (об этом нам говорят коэффициенты перед формулами в уравнении). Давайте теперь узнаем, сколько моль натрия взяли для проведения реакции. В условии говорится, что взяли 57,5 г натрия. Тогда используя молярную массу (для простых веществ она совпадает с атомной и рассчитывается по таблице Менделеева. Для натрия атомная масса 23, как следует из таблицы), получаем, что число молей натрия, взятого для реакции 57,5/23=2,5. Напомню, что число молей рассчитывается по формуле:
где m – масса вещества в граммах, M – молярная масса в граммах/моль, рассчитанная по таблице Менделеева.
В нашем случае m=57,5 г (дано в условии), М – 23 г/моль (взяли из таблицы).
Таким образом, для реакции взяли 2,5 моль натрия. Вспомните, что чуть раньше мы узнали, что 2 моля натрия дают после реакции 2 моля гидроксида натрия и 1 моль водорода. Давайте запишем для краткости так:
2 моль → 2 моль + 1 моль
У нас же имеется 2,5 моль натрия, тогда:
2,5 моль → X моль + Y моль
Рассчитаем Х=2,5*2/2=2,5 моль
Y=2.5*1/2=1,25 моль
Таким образом, если мы берём 2,5 моль натрия, то получим 2,5 моль гидроксида натрия и 1,25 моль водорода. Теперь мы можем рассчитать массу гидроксида натрия в граммах и объём водорода в литрах.
Молярная масса гидроксида натрия NaOH 23+16+1=40 г/моль (значения берём из таблицы Менделеева). Выше мы нашли, что у нас при реакции образуется 2,5 моль гидроксида, поэтому его масса 2,5*40=100 г.
Для водорода мы будем использовать молярный объём, поскольку речь идёт о газе. В нормальных условиях молярный объём любого газа – 22,4 л/моль. Выше мы нашли, что в нашей реакции получится 1,25 моль водорода. Отсюда получаем объём водорода 1,25*22,4=28 л.
Ответ: образуется 100 г гидроксида натрия и 28 л водорода.
Пример 2
При взаимодействии сульфата меди (II) и гидроксида калия образовался гидроксид меди (II) массой 343 г. Сколько потребовалось для реакции сульфата меди?
Решение.
Уравнение реакции выглядит так: CuSO4 + 2KOH = Cu(OH)2 + K2SO4
Коэффициенты говорят, что 1 моль сульфата меди дадут 1 моль гидроксида меди:
1 моль → 1 моль
Найдем, сколько моль гидроксида меди образовалось, используя формулу из первого примера. Молярная масса гидроксида меди, рассчитанная по периодической таблице, – 98 г/моль. В условии дано, что масса полученного гидроксида 343 г, значит количество вещества 343/98=3,5 моль. То есть в нашей реакции получилось 3,5 моль гидроксида меди. То есть:
1 моль → 1 моль (из уравнения реакции)
Х моль → 3,5 моль
Отсюда Х=3,5 моль, то есть для реакции потребовалось 3,5 моль сульфата меди. Молярная масса сульфата меди (её рассчитываем по таблице Менделеева) – 160 г/моль. Тогда масса сульфата меди 3,5*160=560 г.
Ответ: потребовалось 560 г сульфата меди.
Пример 3
При разложении пероксида водорода образовалось 15,68 л кислорода. Сколько при этом образовалось воды в граммах?
Решение.
Уравнение химической реакции здесь такое:
2Н2О2 = 2Н2О + О2
Из уравнения мы видим, что в результате реакции образуется 2 моль вода и 1 моль кислорода. В условии дано, что образовалось 15,68 литров кислорода. Находим, сколько это моль: 15,68/22,4=0,7 моль. То есть в нашей реакции образовалось 0,7 моль кислорода. Тогда:
2 моль Н2О и 1 моль О2
Х моль Н2О и 0,7 моль О2
Х=2*0,7/1=1,4 моль
Следовательно, если образовалось 0,7 моль кислорода, то воды образовалось 1,4 моль. Тогда находим массу вода (молярная масса воды – 18 г/моль, это следует из таблицы Менделеева): 1,4*18=25, 2 г.
Ответ: при разложении пероксида водорода образовалось 25,2 г воды.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как найти массу водорода
Молекулярная масса представляет собой молекулярный вес, который также можно назвать значением массы молекулы. Выражается молекулярная масса в атомных единицах массы. Если разобрать значение молекулярной массы по частям, то получится, что сумма масс всех атомов, входящих в состав молекулы и представляет собой её молекулярную массу. Если говорить о единицах измерения массы, то преимущественно все измерения производятся в граммах.
Инструкция
Само понятие молекулярной массы связано с понятием молекулы. Но нельзя сказать, что это условие можно применить только к таким веществам, где молекула, например, водорода, находится отдельно. Для случаев, когда молекулы находятся не отдельно от остальных, а в тесной взаимосвязи, все вышеперечисленные условия и определения также действительны.
Для начала, чтобы определить массу водорода, вам потребуется какое-либо вещество, в состав которого входит водород и из которого его можно будет несложно выделить. Это может быть какой-либо спиртовой раствор или другая смесь, часть компонентов которой при определённых условиях меняет своё состояние и легко освобождает раствор от своего присутствия. Найдите раствор, из которого можно и спарить необходимые или ненужные вещества при помощи нагревания. Это самый лёгкий способ. Теперь определитесь, будете вы испарять вещество, которое вам не нужно или же это будет водород, молекулярную массу которого вы и планируете измерять. Если испарится ненужное вещество – ничего страшного, главное, чтобы оно было не токсично. в случае же испарения искомого вещества, вам необходимо приготовить оборудование, что все испарения сохранились в колбе.
После того, как вы отделили от состава всё ненужное, приступайте к измерениям. Для этого вам подойдёт число Авогадро. Именно с его помощью вы сможете вычислить относительную атомную и молекулярную массу водорода. Найдите все необходимые параметры водорода которые присутствуют в любой таблице, определите плотность полученного газа, так как она пригодится для одной из формул. Затем подставьте все полученные результаты и, если необходимо, поменяйте единицу измерения на граммы, о чём уже говорилось выше.
Понятие молекулярной массы наиболее актуально для случаев, когда речь идёт о полимерах. Именно для них важнее вводить понятие средней молекулярной массы, ввиду неоднородности входящих в их состав молекул. Также по средней величине молекулярной массы можно судить о том, насколько высока степень полимеризации того или иного вещества.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.