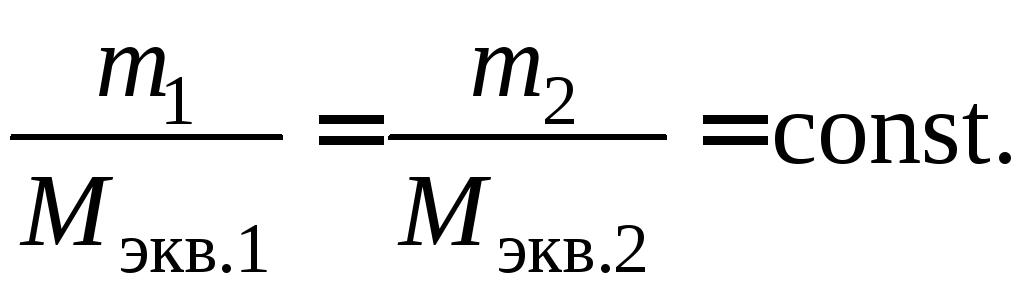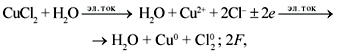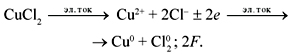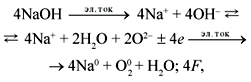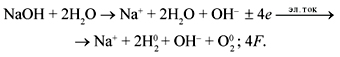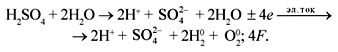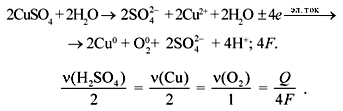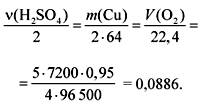Количественные соотношения при электролизе
Количественные расчеты процессов
электролиза осуществляются на основании
законов М. Фарадея.
Первый закон Фарадея.
Масса вещества, выделяющегося на
электроде при электролизе, пропорциональна
количеству прошедшего через раствор
электричества.
m
= k
· Q,
где m– масса восстановленного или
окисленного вещества (г);k–
коэффициент пропорциональности
(электрохимический эквивалент) (г/Кл);
Q– количество электричества, прошедшего
через электролит (Кл).
Напомним, что кулон (Кл) – количество
электричества, проходящее по проводнику
при силе тока 1 ампер (А) за время 1 с.
Количество электричества Qрассчитывается как произведение силы
тока I в амперах на времяtв секундах.
Q
= I
· t.
Электрохимический эквивалент (k)
представляет собой массу вещества,
которая восстанавливается на катоде
или окисляется на аноде при прохождении
через раствор 1 Кл электричества. Величину
электрохимического эквивалента можно
рассчитать по формуле:
k
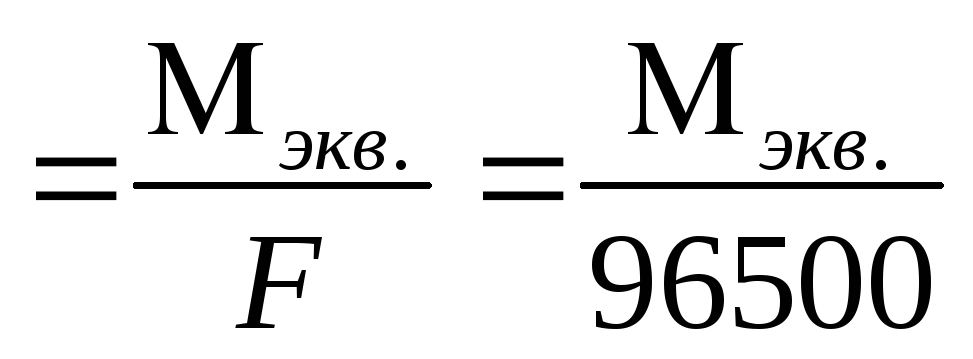
где Mэкв. – молярная масса
эквивалента этого вещества (г/моль);F– постоянная Фарадея.
Постоянная Фарадея представляет собой
количество электричества, необходимое
для выделения из раствора 1 моль
эквивалентов вещества (F = 96500 Кл/моль).
Это количество электричества равно
заряду 1 моль (6,02 ∙ 1023)
электронов.
Молярная масса эквивалента для элемента,
в свою очередь, может быть найдена как
частное от деления молярной массы
элемента на его валентность:
Mэкв =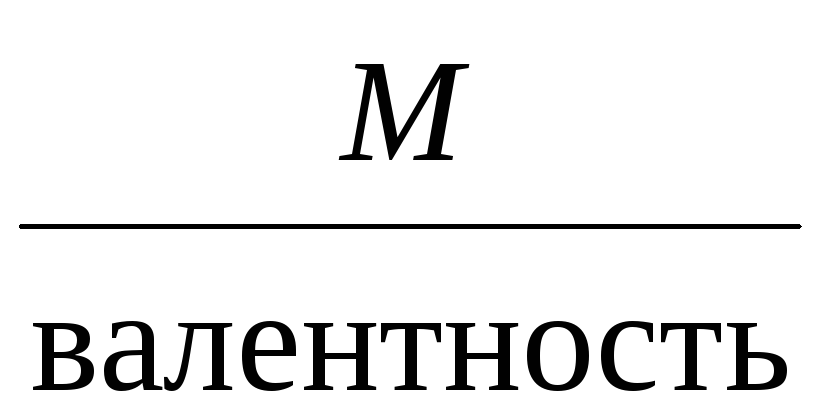
Например, молярные массы эквивалентов
для серебра, меди и алюминия будут,
соответственно, равны:
Mэкв(Ag) =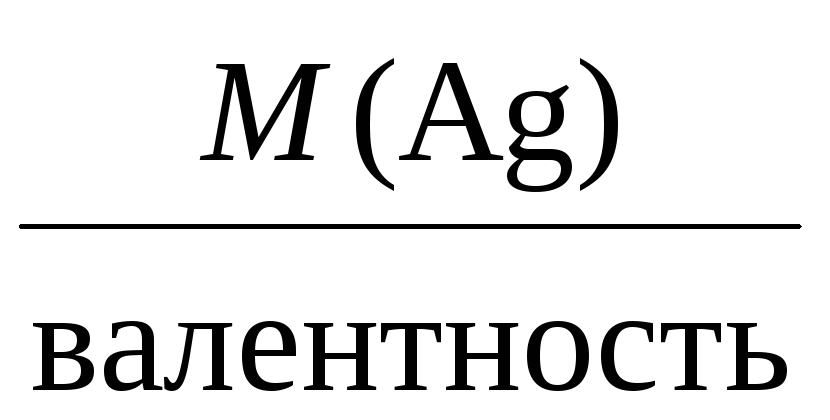
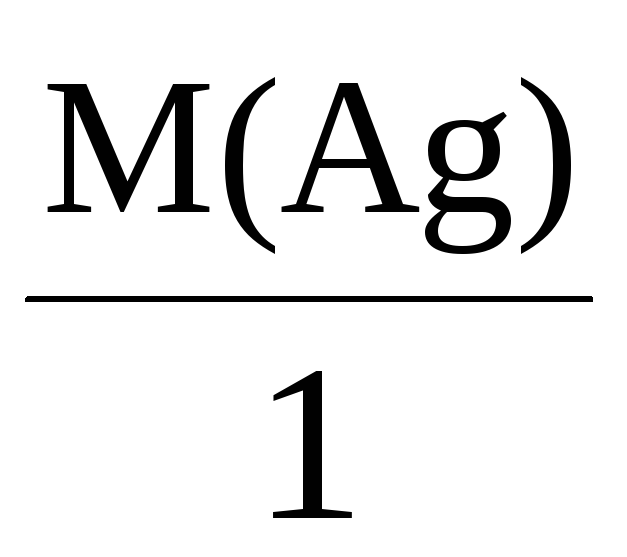
= 108 г/моль,
Mэкв(Ag) =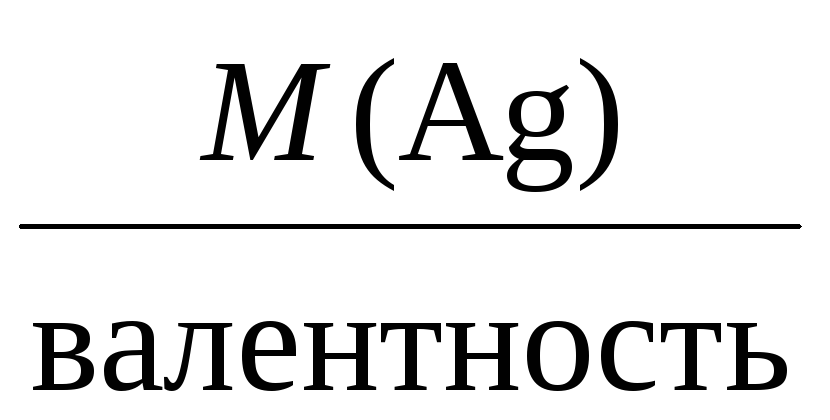
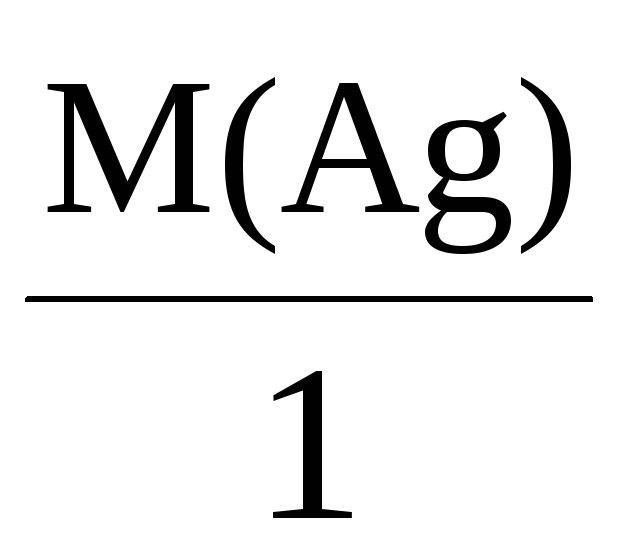
= 108 г/моль,
Mэкв(Cu) =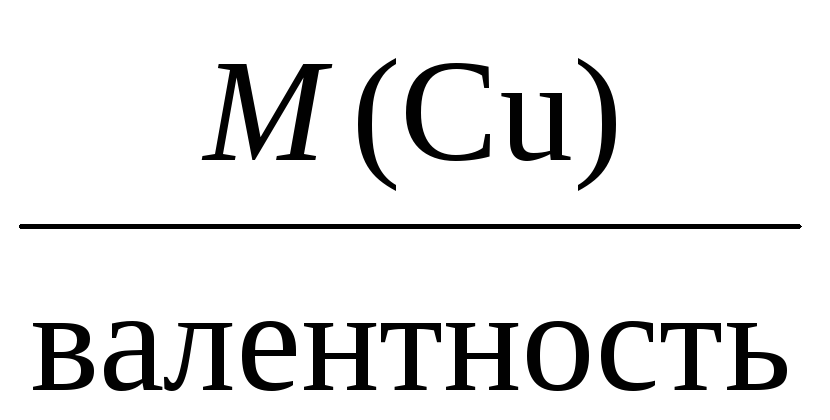
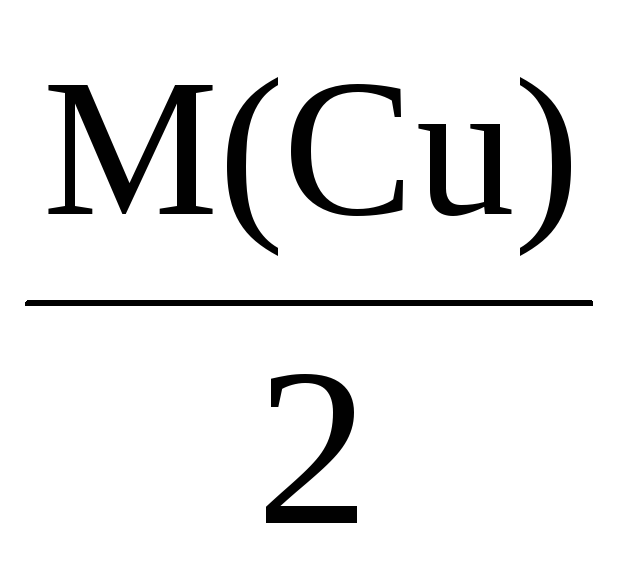
= 32 г/моль,
Mэкв(Al) =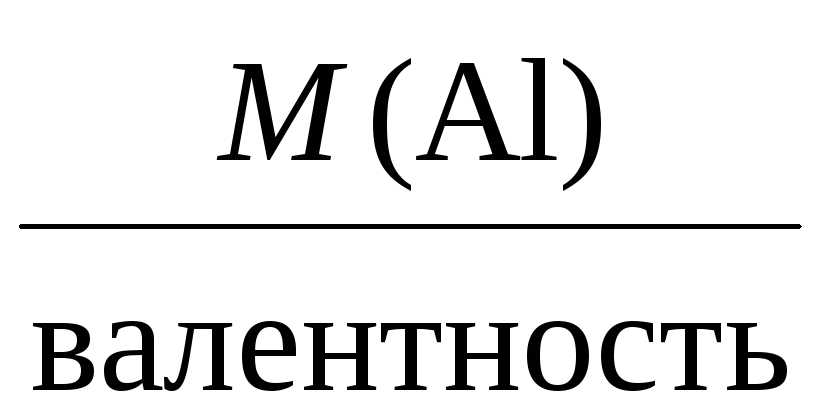
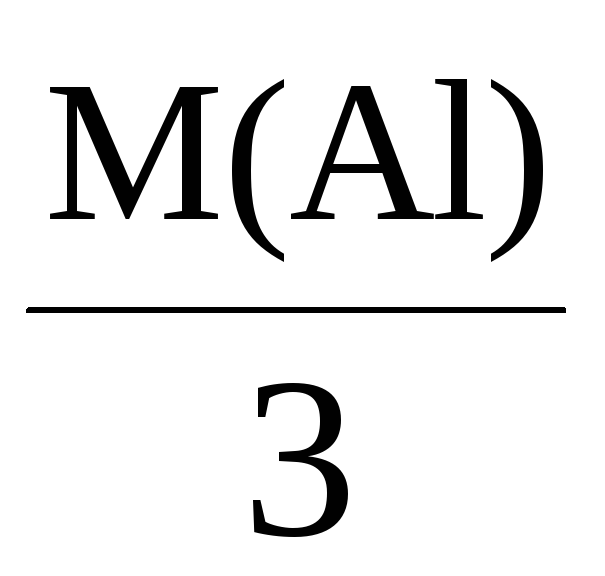
= 9 г/моль.
При пропускании через раствор 96500 Кл
электричества на катоде выделится,
соответственно, 108 г серебра, 32 г меди
или 9 г алюминия.
Таким образом, при количественных
расчетах процесса электролиза можно
пользоваться следующими формулами:
m=k
· Q=k
∙ I ·
τ,
m=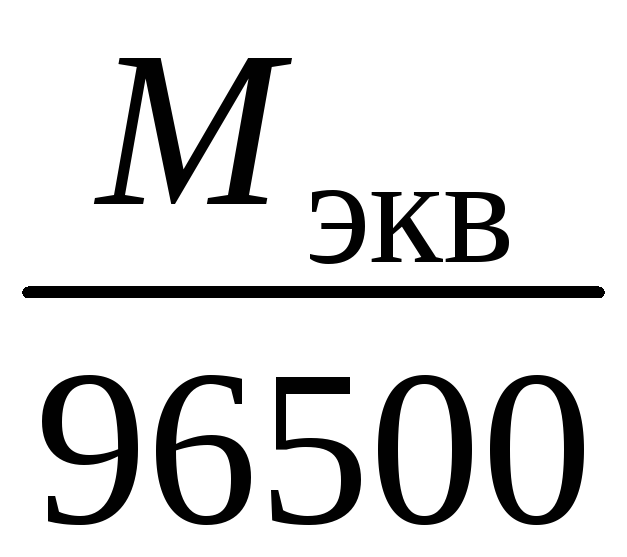
τ.
Второй закон Фарадея.
Массы окисляющихся и восстанавливающихся
на электродах веществ, при пропускании
через раствор одного и того же количества
электричества, пропорциональны молярным
массам их эквивалентов.
Полезно иметь в виду, что если для разряда
одного однозарядного иона (например,
Na+, Cl–) требуется 1 электрон,
то для выделения из раствора электролита
1 моль таких же ионов, требуется число
электронов, равное числу Авогадро –
6,02·1023(1 моль электронов). Это
количество электронов как раз и имеет
общий заряд, равный 96500 Кл. Соответственно,
для разряда 1 моль двухзарядных ионов,
потребуется 2 моль электронов, или
количество электричества, равное 2
· 96500 Кл и т.д.
Используя вышеприведенные формулы,
можно производить ряд расчетов, связанных
с процессом электролиза, например:
вычислять количества веществ,
выделяемых или разлагаемых определенным
количеством электричества;
находить силу тока по количеству
выделившегося вещества и времени,
затраченному на его выделение;
устанавливать, сколько времени
потребуется для выделения определенного
количества вещества при заданной силе
тока.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Закон Фарадея для электролиза

4.3
Средняя оценка: 4.3
Всего получено оценок: 268.
4.3
Средняя оценка: 4.3
Всего получено оценок: 268.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
m = kIt,
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Лиза Шифр
4/5
-
Евгений Пшеничный
5/5
-
Татьяна Батарон
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 268.
А какая ваша оценка?
ПЕРЕПИСКА С ЧИТАТЕЛЕМ
Полемика
Проблемы теории электролиза
в школьной практике
При изучении электролиза
школьная программа ограничивается только
полуреакциями окисления и восстановления,
проходящими на электродах в электролизере. В
некоторых задачниках представлены задачи,
которые, хотя и находятся в разделе «Электролиз»,
на самом деле к нему не относятся. Электролиз
напрямую связан с законами Фарадея, но, к
сожалению, имя Фарадея в учебниках иногда даже не
упоминается.
Обращаю особое внимание на «теорию»
электролиза, представленную в гл. 10 (с. 132)
учебного пособия «2500 задач по химии с решениями,
для поступающих в вузы» (М.: Экзамен, 2006, авторы
Н.Е.Кузьменко и В.В.Еремин). Приведу текст
«теории» дословно: «Количество веществ,
выделившихся на электродах, определяют по
уравнениям электродных реакций. Для этого
находят количество электронов с помощью
уравнения
(e) = It/F,
где I – cила тока, А; t –
продолжительность электролиза, с; F =
96 500 Кл/моль – постоянная Фарадея, равная
заряду 1 моль электронов».
Следует заметить, что Майкл Фарадей к
изложенной «теории» не имеет никакого отношения.
Приведем формулировки законов Фарадея.
1-й закон. Масса m вещества,
выделившегося на электроде при прохождении
электрического тока, прямо пропорциональна Q
– количеству пропущенного через электролит
электричества.
2-й закон. Отношение масс разложившихся
веществ, претерпевающих превращения на
электродах при прохождении одинаковых
электрических зарядов, равно отношению
химических эквивалентов этих веществ.
Законы Фарадея можно выразить в виде формулы:
m = k•Q = (M/nF)•Q,
где k – электролитический эквивалент
вещества, выделившегося на электроде; M –
молярная масса, n – валентность ионов этого
вещества; F – постоянная Фарадея.
(Политехнический словарь, изд. 2-е. М.: Советская
энциклопедия, 1980.)
Фарадей установил, что если через электролизер
пропустить количество электричества, равное
96 500 Кл, то на электродах выделится по одному
молю веществ (если ионы, образующие данное
вещество, являются однозарядными). Это
количество электричества назвали числом Фарадея
и обозначили буквой F:
F = 96 500 Кл/моль.
Число Фарадея можно рассчитать и теоретическим
путем.
Пусть один моль вещества, диссоциируя на ионы,
образует NA катионов и NA
анионов. Один однозарядный анион несет на себе
заряд одного электрона. При электролизе
количество электричества, которое необходимо
затратить для передачи электронов от NA
однозарядных анионов к NA однозарядным
катионам, равно:
Q = NA•e,
где NA – число Авогадро, e – заряд
электрона, Кл.
NA•e = 6,02209•1023•1,60219•10–19
= 96 485 Кл.
Рассчитанное количество электричества с
достаточно большой точностью совпадает с
постоянной Фарадея.
Для двухзарядных ионов – на каждом электроде
выделится по одному молю веществ, если через
электролизер пройдет количество электричества,
равное 2F Кл/моль. Для трехзарядных ионов,
соответственно, потребуется 3F кл/моль, для n-зарядных
ионов – nF Кл/моль. Следовательно, nF Кл/моль
есть молярное количество электричества для n-зарядных
ионов.
Если через электролизер пропустить Q Кл
электричества, то на электроде выделится
количество вещества, равное:
Именно эта функция является законом Фарадея.
Иными словами, количество вещества (), выделенное на
электроде, равно отношению количества
электричества (Q), прошедшего через электролизер,
к молярному количеству электричества (nF).
Поскольку = m/M,
а Q = I•t (где m – масса, г; М –
молярная масса, г/моль; I – сила тока, A; t –
время, сек.), то:
откуда следует:
В школьных учебниках
электродные реакции (анодные и катодные)
рассматриваются отдельно друг от друга, и это
вполне оправданно, поскольку механизм
электродных процессов в этом случае
раскрывается наиболее полно. Однако для
расчетных задач намного удобнее электродные
процессы объединить в одну
окислительно-восстановительную реакцию. Покажем
это на примере электролиза расплава хлорида
алюминия. Реакции на катоде и аноде представим
совместно с формулой расчета в следующем виде:
где Al0 и Cl02 – простые
вещества, выделенные на электродах;
(Al),
(Cl2) – количества
вещества алюминия и хлора;
6e – число «балансовых» электронов (равно
произведению степени окисления элемента на его
собственный коэффициент из уравнения химической
реакции);
Q – количество электричества, прошедшего
через электролизер;
F – число Фарадея.
Отношение Q/F равно условному количеству
вещества (усл),
выделившегося на электроде. Чтобы уравнять усл с
реальными количествами веществ, выделившихся на
электродах, необходимо усл разделить на число
«балансовых» электронов (n) и умножить на
коэффициент, стоящий при данном веществе в
уравнении реакции.
Исходя из формулы расчета, количества алюминия
и хлора будут соответственно равны:
что соответствует первому закону Фарадея для
каждого электрода.
Рассмотрим, как согласуется формула расчета со
вторым законом Фарадея.
Для этого заменим количество вещества отношением массы к
молярной массе:
Теперь представим массы веществ, а также их
молярные массы с коэффициентами в виде отдельных
отношений:
где Э(Al) = M(Al)/3, Э(Cl2) = M(Cl2)/2 –
химические эквиваленты соответственно алюминия
и хлора.
Полученная формула отражает закон
эквивалентов для реакции электролиза расплава
хлорида алюминия.
Как видим, закон эквивалентов и второй закон
Фарадея тождественны, этим, вероятно, можно
объяснить то, что в задачниках в разделе
«Электролиз» расчетные задачи составлены без
учета расхода количества электричества.
В школьных учебниках не
дано четкого разграничения между уравнениями
реакций электролиза расплавов солей и оснований
и уравнениями реакций электролиза их водных
растворов. Некоторые реакции записывают
одинаково, одним и тем же уравнением. Чтобы
сделать различие между ними, надо при написании
уравнения реакций электролиза водных растворов
дополнительно написать воду.
Так, реакция электролиза водного раствора
CuCl2 записывается следующим образом:
а реакция электролиза расплава CuCl2:
Электролиз расплава NaOH выражается
следующей реакцией:
а электролиз водного раствора NaOH:
Реакция электролиза водного раствора
серной кислоты:
На основании изложенной выше теории решим
задачу по электролизу.
Задача. Через электролизер, содержащий
водный раствор сульфата меди, пропускали в
течение 2 часов ток силой 5А. Рассчитайте массу
меди, осевшей на катоде, объем кислорода,
выделившегося на аноде, а также количество
образовавшейся в растворе серной кислоты. Потери
электричества в электролизере составляют 5%.
| Дано:
I = 5А, t = 2•3600 = 7200 с, F = 96 500 Кл/моль,
|
Найти:
m(Cu), V(O2). |
Решение
Переведем в удобную для расчета форму:
и подставим данные из условия задачи:
(H2SO4)
= 2•0,0886 = 0,1772 моль,
m(Cu) = 2•64•0,0886 = 11,3408 г,
V(O2) = 22,4•0,0886 = 1,985 л.
О т в е т. На катоде осело 11,34 г меди,
на аноде выделилось 1,985 л кислорода,
в растворе образовалось 0,18 моль серной кислоты.
Таким образом, в статье обсуждены некоторые
проблемы теории электролиза и предложена новая
методика расчета количеств веществ,
выделившихся на электродах.
В.И.МАРТЫНОВ
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Закон электролиза
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время? Это определяет закон электролиза.
Очевидно, что масса выделившегося вещества m равна произведению массы одного иона m0i на число ионов достигших электрода за время :
Масса иона m0i согласно формуле (8.4) равна:
где М – молярная (или атомная) масса вещества, а NA – постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:
где – заряд, прошедший через электролит за время
;
– заряд иона, который определяется валентностью n атома:
(е – элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов (n = 1), возникают однозарядные ионы. Например, при диссоциации молекул КВr возникают ионы K+ и Вr. Диссоциация молекул медного купороса ведет к появлению двухзарядных ионов Cu2+ и SO42-, так как атомы меди в данном соединении двухвалентны (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что , получаем
Закон Фарадея. Обозначим через k коэффициент пропорциональности между массой вещества m и зарядом :
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем:
Следовательно, масса вещества, выделившегося на электроде за время при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея.
Из формулы (16.8) видно, что коэффициент k численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл. Величину k называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Электрохимический эквивалент имеет простой физический смысл. Так как , то согласно формуле (16.7)
, т. е. k – отношение массы иона к его заряду.
Измеряя величины m и , можно определить электрохимические эквиваленты различных веществ.
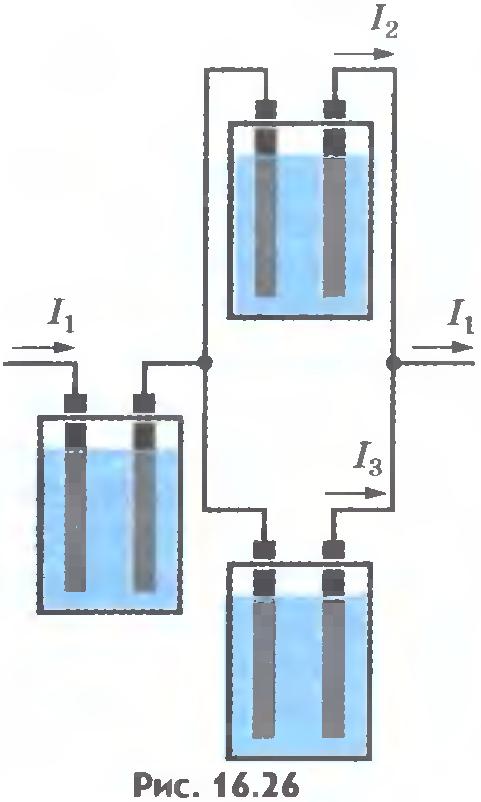
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 16.26. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов черезI1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона. Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:
Зная массу m выделившегося вещества при прохождении заряда , молярную массу М, валентность атомов n и постояннуюАвогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным е = 1,6•10-19 Кл.
Именно таким путем и было впервые в 1874 г. получено значение элементарного электрического заряда.
Произведение силы тока на время определяет массу вещества, выделяемого при электролизе. Закон электролиза позволяет найти значение элементарного электрического заряда.
???
1. Сформулируйте закон электролиза Фарадея.
2. Почему отношение массы вещества, выделившегося при электролизе, к массе иона равно отношению прошедшего заряда к заряду иона?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Планирование уроков по физике, ответы на тесты, задания и ответы по классам, домашнее задание и работа по физике для 10 класса
Содержание урокаконспект урока
опорный каркас
презентация урока
акселеративные методы
интерактивные технологии Практика
задачи и упражнения
самопроверка
практикумы, тренинги, кейсы, квесты
домашние задания
дискуссионные вопросы
риторические вопросы от учеников Иллюстрации
аудио-, видеоклипы и мультимедиа
фотографии, картинки
графики, таблицы, схемы
юмор, анекдоты, приколы, комиксы
притчи, поговорки, кроссворды, цитаты Дополнения
рефераты
статьи
фишки для любознательных
шпаргалки
учебники основные и дополнительные
словарь терминов
прочие Совершенствование учебников и уроков
исправление ошибок в учебнике
обновление фрагмента в учебнике
элементы новаторства на уроке
замена устаревших знаний новыми Только для учителей
идеальные уроки
календарный план на год
методические рекомендации
программы
обсуждения Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь – Образовательный форум.
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний – Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов –
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других “взрослых” тем.
Разработка – Гипермаркет знаний 2008-
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: 
Закон электролиза. Определение заряда электрона
Закон Фарадея для электролиза связывает массу выделяющегося вещества с прошедшим через электролит электрическим зарядом. При прохождении электрического тока через электролит происходит выделение на электродах составных частей электролита. Это явление называется электролизом (от греческого “лио” — разделяю). Электролиз связан с процессами обмена зарядами между ионами и электродами. На аноде отрицательно заряженные ионы (анионы) отдают свои лишние электроны (окислительная реакция), а на катоде положительные ионы (катионы) получают недостающие электроны (восстановительная реакция). Отдав свои избыточные заряды, ионы превращаются в нейтральные атомы. Эти атомы (или образованные из них молекулы выделяются на электродах, либо вступают в реакцию с электродами или растворителем. Химические реакции, в которые вступают нейтрализовавшиеся ионы, называются вторичными. Продукты вторичных реакций выделяются на электродах или переходят в раствор.
Рассмотрим несколько примеров, выражающих суть электролиза.
Пример 1
Пусть в электролитической ванне находится водный раствор соляной кислоты. Молекулы соляной кислоты при растворении в воде почти полностью диссоциируют на ионы водорода и ионы хлора:
(~HCl leftrightarrows H^+ + Cl^-.)
При прохождении электрического тока через раствор на электродах происходит нейтрализация ионов.
Подойдя к аноду, Cl– отдает избыточный электрон, превращается в нейтральный атом Cl, атомы Cl сразу же объединяются попарно в молекулы Cl2:
(~Cl^- + Cl^- – 2e to Cl_2,)
и на аноде выделяется молекулярный хлор.
Атомы водорода, нейтрализовавшиеся у катода, объединяются попарно в молекулы H2:
(~H^+ + H^+ + 2e to H_2,)
и на катоде выделяется молекулярный водород.
Таким образом, в результате прохождения электрического тока через водный раствор HCl на катоде выделяется водород, на аноде — хлор. Вторичных реакций не происходит.
Пример 2
Молекулы серной кислоты при растворении в воде диссоциируют на ионы водорода и ионы кислотного остатка:
(~H_2SO_4 leftrightarrows 2H^+ + SO_4^{2-}.)
При прохождении электрического тока через раствор на электродах протекают следующие реакции:
(~2H^+ + 2e to H_2,)
(~SO_4^{2-} – 2e to SO_4.)
Водород выделяется в виде пузырьков на катоде. Нейтральная группа SO4 химически очень активна и вступает во вторичную реакцию. Если электроды изготовлены, например, из платины или никеля, то SO4 реагирует с водой:
(~2SO_4 + 2H_2O to 2H_2SO_4 + O_2.)
Молекула серной кислоты поступает в раствор, кислород выделяется в виде пузырьков у анода, т.е. вторичная реакция протекает с растворителем.
Пример 3
Пусть в электролитической ванне находится водный раствор сульфата меди. Под действием растворителя молекулы сульфата меди диссоциируют на ионы меди и ионы кислотного остатка:
(~CuSO_4 leftrightarrows Cu^{2+} + SO_4^{2-}.)
При прохождении электрического тока через раствор на катоде ионы меди превращаются в нейтральные атомы (~Cu^{2+} + 2e to Cu), и медь откладывается на катоде. На аноде происходит нейтрализация комплекса SO42-[~SO_4^{2-} – 2e to SO_4.].
Если электроды медные, то нейтральная группа SO4 предпочтительнее вступает в реакцию с медью, чем с водой[~SO_4 + Cu to CuSO_4.].
Молекула CuSO4 поступает в раствор. Вторичная реакция протекает с электродом из меди. Происходит отложение меди на катоде и растворение анода. Химический состав электролита при этом остается неизменным.
Необходимым условием электролиза является прохождение через электролит постоянного электрического тока.
Массу вещества, выделившегося при электролизе, можно рассчитать, пользуясь электронной теорией. Эта масса определяется массой всех N ионов, которые осели на электроде: m = m0N, где m0 — масса одного иона, N — число ионов, которое можно рассчитать, зная массу вещества m и его молярную массу М[~N = frac mM N_A], где NA — число Авогадро.
С другой стороны, число ионов можно выразить через заряд q, про-шедший через электролит, и заряд одного иона qi[~N = frac{q}{q_i}].
Следовательно, (~frac{q}{q_i} = frac mM N_A Rightarrow m = frac{qM}{q_i N_A}).
Заряд иона любого вещества кратен заряду одновалентного иона, т.е. заряду электрона qi = ne, где n — валентность иона.
Таким образом,
(~m = frac{M}{ne N_A} q . qquad (1))
Величины Μ и n постоянны для данного вещества. Поэтому выражение (~frac{M}{ne N_A} = k) — величина постоянная для данного вещества. Ее называют электрохимическим эквивалентом. Тогда m = kq.
Приведенная зависимость впервые была экспериментально установлена М. Фарадеем в 30-х годах XIX века. Эта формула выражает закон Фарадея: масса вещества, выделившегося на электроде, прямо пропорциональна заряду q. прошедшему через электролит:
(~m = kq .)
Электрохимический эквивалент численно равен массе вещества, выделившегося на электроде при прохождении через раствор электролита заряда в 1 Кл. В СИ единицей электрохимического эквивалента является килограмм на кулон (кг/Кл) .
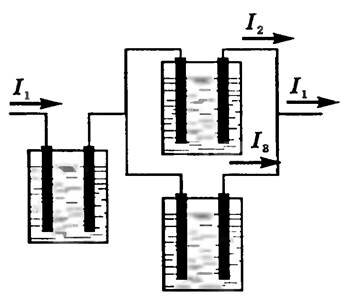
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 1. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 выделившихся на электродах веществ в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам тока I1, I2, I3.
Рис. 1
Закон Фарадея сыграл важную роль в истории развития физики. Именно закон, полученный Фарадеем опытным путем, послужил толчком к выдвижению гипотезы о существовании в природе элементарного электрического заряда. Закон Фарадея позволяет определить заряд одновалентного иона (заряд электрона). Из формулы (1) (~e = frac{Mq}{m N_A n} = frac{Mq}{m N_A} = frac{MIt}{m N_A}), т.е. надо измерить на опыте только массу выделившегося вещества m и силу тока в цепи I.
Литература
Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 283-286.