Как найти массу ядра
Ядро атома ничтожно мало по сравнению с его общими размерами. Представить это поможет, например, такая образная модель атома водорода: если в самом центре футбольного поля положить небольшое яблоко, изображающее ядро, то орбита электрона прошла бы приблизительно по вратарской линии. Абсолютное большинство объема атома занимает пустота. И при этом столь же абсолютное большинство массы атома сосредоточено в его ядре. Достаточно сказать, что в том же атоме водорода его ядро тяжелее, чем электрон, в 1836 раз! А как же найти массу атомного ядра?

Инструкция
Упомянутый атом водорода имеет простейшее строение ядра из всех химических элементов. Оно состоит из единственной частицы, которая называется «протон». Все другие элементы имеют более сложное строение, и в состав их ядер, помимо протонов, входят так называемые «нейтроны». Запомните, что масса протона практически совпадает с массой нейтрона. Это очень важно.
За единицу измерения принята «атомная единица массы», или по-другому «Дальтон». Это масса 1/12 атома изотопа углерода. Она приблизительно равна 1,66*10^-24грамм. Именно из этой величины вам надо исходить, рассчитывая массу ядра того или иного химического элемента.
Легко можно понять, что поскольку масса электронов ничтожно мала по сравнению с массой протонов и нейтронов, ею в расчетах можно пренебречь. Разумеется, если не требуется очень высокая точность. Поэтому, решая задачу о нахождении массы ядра, можно рассматривать только «тяжелые» частицы – протоны и нейтроны. Их сумма дает вам «массовое число». Его необходимо умножить на величину атомной единицы массы и получить требуемый результат.
А как узнать массовое число? Тут на помощь придет знаменитая Таблица Менделеева. Каждому элементу в ней отведено строго определенное место, а заодно дана вся необходимая информация. В частности указана атомная масса элемента, которую можно принять за массовое число, поскольку общая масса электронов атома ничтожно мала по сравнению с массой протонов и нейтронов.
Рассмотрите конкретный пример. Вот хорошо знакомый металл – золото (Au). Его атомная масса – 196,97. Округлите ее до 197 и умножьте на величину атомной единицы массы. Получите:(197*1,66)*10^-24 = 327,02*10^-24 = 3,2*10^-22 грамм. Вот такова приблизительная масса ядра атома золота.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как устроено атомное ядро?
Ядра всех атомов состоят из протонов и нейтронов, имеющих почти одинаковую массу, но лишь протон несет электрический заряд. Полное число протонов называется атомным номером Z атома, который совпадает с числом электронов в нейтральном атоме.
Чему равна масса ядра атома?
1а. е. м = 1.6606 10-27 кг. Масса ядра всегда меньше суммы масс составляющих его нуклонов.
Как найти массу ядра по таблице Менделеева?
Ядро состоит из протонов и нейтронов, относительные массы которых равны 1. Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Как определить дефект массы и энергию связи ядра?
Теория:
- Дефект массы ядра
- Энергия связи
- Энергия связи и дефект массы ядра связаны между собой уравнением Эйнштейна: E св = Δ m c 2 .
- Удельнойэнергией связи ядра называют энергию связи, приходящуюся на 1 нуклон: f = E св A .
Как Заряженно атомное ядро?
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса. Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом.
Что находится в атомном ядре?
Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным.
Чему равна масса ядра формула?
Eсв(A,Z) = [Zmp + (A — Z)mn) — M(A,Z)]c2. Она определяет минимальную энергию, которую надо затратить, чтобы разделить ядро на отдельные нуклоны.
Каков состав ядра 39 19 К?
содержит 19 протонов и 39 − 19 = 20 нейтронов.
Как найти массу ядра химического элемента?
м. принимают 1/12 часть массы нуклида 12C. Стандартная масса, которая обычно приводится для нуклида — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов (более точное значение получится, если учесть ещё и энергию связи электронов с ядром).
Как найти массу ядра зная массу атома?
Если известно массовое число, то масса М атома и его ядра оценивается из следующего соотношения М ≈ А·mN, где mN ≈ 1,67·10−27 кг — масса нуклона, то есть протона или нейтрона. Например, в состав атома алюминия-27 и его ядра входит 27 нуклонов (13 протонов и 14 нейтронов).
Как определить дефект массы?
ДЕФЕКТ МАССЫ — см. ДЕФЕКТ МАССЫ — атомного ядра величина Am, равная отношению энергии связи атомного ядра WCB к квадрату скорости света в вакууме с: Дельта m = WCB /с2 …
Как найти массу ядра в а е м?
Массу ядра можно найти следующим образом: mяд = N·mn + Z·mp. Так как mn ≈ mp ≈ 1.66·10−27 кг, а Z + N = A, получим: mяд = 1.66·10−27·A кг.
Кто рассчитал заряд ядра атома?
Затем Резерфорд рассчитал, какая доля пучка α-частиц с энергией E рассеивается на угол θ в зависимости от заряда ядра Z2e и заряда α-частицы Z1e. Так исходя из классических законов Ньютона и Кулона была получена знаменитая формула рассеяния Резерфорда.
Какие характерные размеры атомных ядер?
Большинство ядер имеют форму, близкую к сферической. Ядро имеет размер ≈ 10-12 см, что на четыре порядка меньше размера атома (10-8 см). Плотность вещества в ядре – около 230 млн.
Чему равно число протонов в атоме?
Протон имеет положительный заряд +1. Заряд электрона — отрицательный и по величине равен заряду протона: –1. Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице.
Сколько нейтронов в ядре элемента?
4 Вычтите атомный номер из атомной массы. е. атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
Как найти массу ядра углерода?
Масса ядра равна массе нейтрального атома за вычетом массы шести электронов.
Принятой единицей
измерения масс ядер является атомная
единица массы (а.е.м.), определяемая как
1/12 массы атома углерода 12С
(ядро атома и шесть электронов). Измерения
дают: 1 а.е.м.
= 1,6605402·10-27
кг.
В ядерной физике
неудобно пользоваться массами, выраженными
в кг, и энергиями, измеренными в Дж.
Каждая область физики требует для
наиболее адекватного описания своих
единиц измерения. Так, в данном случае
удобнее всего пересчитать массы в
эквивалентные значения энергии покоя
по формуле Эйнштейна Е0
= mc2
и выразить эти значения энергии в эВ
или, что еще удобнее, в МэВ (миллионах
электрон-вольт).
Приближенно 1 а.е.м. =
931,5 МэВ.
Масса ядра меньше
массы составляющих его нуклонов.
Это можно легко понять, если представить
себе, что ядро разбито на составные
части, которые затем удалены на большие
расстояния друг от друга. Ясно, что на
это требуется затратить работу против
ядерных сил притяжения нуклонов друг
к другу. Следовательно, по закону
сохранения энергии, полная энергия
покоя ядра равна сумме энергий покоя
составных частей за вычетом энергии
связи, численно равной той работе,
которую нужно затратить, чтобы разбить
ядро.
Энергию связи В
можно подсчитать по формуле: В
= (Zmp
+ Nmn
– Mя)с2.
Этой энергии можно сопоставить дефект
массы Dm =
В/с2.
Для
сравнения энергий связи разных ядер
удобно ввести новую характеристику:
энергия связи на нуклон В/А.
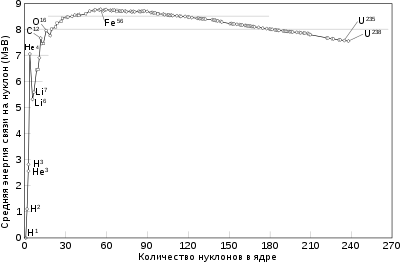
Максимальную энергию связи на нуклон
(8,6 МэВ)
имеют ядра Fe, Ni и Со.
4. Радиоактивность. Виды радиоактивного распада. Закон радиоактивного распада
В настоящее время
известны следующие виды радиоактивного
распада:
1)
Альфа-распад, при котором исходное ядро
испускает α-частицу, которая по своему
составу соответствует ядру гелия. При
таком виде распада исходное ядро
превращается в ядро нового элемента с
зарядовым числом Z на 2 единицы меньше
(то есть смещается в таблице Менделеева
на два места влево) и массовым числом
на 4 единицы меньше по сравнению с
исходным.
Спектр альфа-частиц
линейчатый (дискретный), поскольку
переход осуществляется между дискретными
состояниями материнского и дочернего
ядра. Диапазон энергий – несколько
мегаэлектронвольт (МэВ). Если возможны
переходы на возбужденные состояния
дочернего ядра, то альфа-распад будет
сопровождаться гамма-излучением.
Гамма-излучение
представляет собой электромагнитное
излучение с очень короткой длиной волны
(менее 10-10
м). Оно обладает выраженными корпускулярными
свойствами и поэтому может быть
представлено как поток частиц (фотонов)
– квантов электромагнитного поля. Гамма
кванты могут рождаться как во время
перехода ядер между возбужденными
состояниями, так и при торможении быстрых
заряженных частиц в поле ядра. Особый
случай представляет собой рождение
гамма-квантов при встрече электрона с
позитроном (антиэлектроном). При этом
происходит реакция аннигиляции, то есть
материя из формы вещества переходит в
форму электромагнитного поля,
представленного двумя фотонами, имеющими
энергию, определяемую массой покоя
электрона (511 кэВ). Поскольку аннигиляция
происходит из связанного состояния,
кванты разлетаются в строго противоположных
направлениях в соответствии с требованием
закона сохранения импульса.
2)
Бета‑распад, при котором испускается
электрон (β–‑распад)
или позитрон (β
+‑распад).
При β
‑‑распаде
один из нейтронов ядра превращается в
протон, а при β
+‑распаде
один из протонов превращается в нейтрон,
и массовое число у вновь возникшего
ядра не отличается от исходного. Однако
при β
‑‑распаде
получаемый в результате химический
элемент смещается от исходного положения
в таблице Менделеева на одну клетку
правее, а при β
+‑распаде
– на одну клетку левее.
При всех видах
бета-распада испускается еще одна
частица – нейтрино ().
Эта частица не имеет электрического
заряда и ее масса очень мала. Поэтому
нейтрино очень слабо взаимодействует
с веществом. Однако нейтрино уносит
часть энергии, выделяющейся при
бета-распаде. Это приводит к тому, что
спектр бета-частиц сплошной (от 0 до
Еmax),
а его форма определяется из законов
квантовой механики.
3)
Электронный захват (ЭЗ), при котором
исходное ядро захватывает электрон
К-оболочки
атома, при этом один из протонов исходного
ядра превращается в нейтрон. Иначе
говоря, по своим последствиям, связанным
с изменением нуклонного состава ядра,
электронный захват эквивалентен
β+‑распаду.
Однако в отличие от β+‑распада
ядра, подвергающиеся ЭЗ, не испускают
заряженных частиц.
4)
Спонтанное (самопроизвольное) деление
ядер, при котором исходное ядро делится
на два (реже три) осколка, образование
которых сопровождается испусканием
2–3 нейтронов, а также γ‑излучением.
Спонтанное деление как вид радиоактивного
распада характерно для всех тяжелых
ядер (начиная с тория 90Th).
Обычно оно идет параллельно с α‑распадом
(реже β‑распадом). Для сверхтяжелых
ядер (A > 260) спонтанное деление является
основным каналом распада ядер, то есть
его период полураспада значительно
меньше величины других видов распада.
5)
Нейтронный распад, при котором исходное
ядро испускает нейтрон, в результате
чего возникает новое ядро, являющееся
изотопом ядра исходного элемента с
массовым числом А‑1.
Явление нейтронного распада характерно
для ядер – осколков, образующихся при
делении тяжелых ядер. Испускаемые при
таком распаде нейтроны называются
запаздывающими. Период полураспада
этого вида лежит в пределах от долей
секунды до нескольких десятков секунд.
6)
Протонный распад (р‑распад),
двухпротонный распад (2р‑распад),
двухнейтронный распад (2n‑распад)
– недавно обнаруженные виды радиоактивного
распада, характерные для сверхтяжелых
элементов.
Закон радиоактивного
распада.
Для характеристики
радиоактивных изотопов вводят величину,
называемую активностью, которая
характеризует скорость распада:
A=
–dN/dt
Она измеряется в
беккерелях (1Бк = 1распад/с). Внесистемной
единицей измерения активности являеся
Кюри. 1Ки = 3,7*1010
Бк.
Процесс радиоактивного
распада характеризуется определенной
вероятностью распада, различной для
различных изотопов. Это значит, что за
определенное время распадается
определенная доля радиоактивных атомов.
Математически это записывается так:
dN/dt
= – N
где
– постоянная распада, которая и
характеризует его вероятность. Эта
формула называется законом радиоактивного
распада в дифференциальной форме. Она
может быть переписана в виде: A
= N
или, выражая число атомов N
через число Авогадро NA:
A
= mNA/M
где m
–масса радиоактивного изотопа, а M
– его молярная масса.
Используя это
уравнение, можно определять ничтожно
малые количества радиоактивных веществ,
измеряя их активности. Этот принцип
лежит в основе изотопной диагностики
по принципу «меченых атомов». Поскольку
лишь малая доля атомов вещества может
оказаться радиоактивной, вводят величину,
называемую удельной активностью:
a
= A/m
или a
= A/V
Знание удельной
активности позволяет отмерить заданную
активность без всяких специальных
приборов, пользуясь весами для твердых
радиоактивных веществ или пипеткой для
жидкостей.
Формула может быть
проинтегрирована по времени после
разделения переменных:

– lnN0
=-t
Здесь Nt
– число
атомов радиоактивного вещества к моменту
времени t,
а N0
– число
атомов в начальный момент времени.
Потенцируя последнее выражение, получим
закон радиоактивного распада в
интегральной форме:
Nt
= N0e
–t
или
At
= A0e–t
Часто этот
закон пишут, используя период полураспада
Т –
время, за которое распадается ровно
половина радиоактивных атомов:
At
= A0
e-0,693t/T
Использование
периода полураспада Т
позволяет переписать формулу к виду:
А
= 0,693 mNa/MT
Изотопы с
периодом полураспада до нескольких
суток принято называть короткоживущими,
а с большими периодами – долгоживущими.
Это различие существенно при оценке
радиоактивного загрязнения, последствий
попадания радиоактивных веществ в
организм и в ряде других случаев.
Некоторые из радиоактивных изотопов
встречаются в природе (уран, торий, радий
и др.). Такие изотопы называют
естественно-радиоактивными. Другая
часть изотопов изготавливаются в научных
лабораториях и на предприятиях атомной
промышленности. Их называют искусственно-
радиоактивными.
Соседние файлы в папке Тексты лекций физика
- #
- #
- #
- #
- #
- #
|
В таблице Менделеева под каждым элементом написана масса атома в атомных единицах массы. Ее можно легко пересчитать в те единицы, которые вам нужны. Для практического измерения в настоящее время используется масс-спектрометрами, где массу летящей заряженной частицы измеряют по ее отклонению в магнитном поле под действием силы Лоренца, с высокой точностью. При этом можно измерять массы не только атомов, но и молекул или их частей. Namenname2 9 лет назад В таблице Менделеева. Электроны по сравнению с ядром весят несущественно мало. Знаете ответ? |
| Ядерная физика |
|---|
 |
| Атомное ядро · Радиоактивный распад · Ядерная реакция · Термоядерная реакция |
|
Основные термины Атомное ядро · Изотопы · Изобары · Капельная модель ядра · Период полураспада · Массовое число · Составное ядро · Цепная ядерная реакция · Ядерное эффективное сечение |
|
Распад ядер Закон радиоактивного распада · Альфа-распад · Бета-распад · Кластерный распад |
|
Сложный распад Электронный захват · Двойной бета-распад · Двойной электронный захват · Внутренняя конверсия · Изомерный переход |
|
Излучения Ионизирующее излучение · Нейтронный распад · Позитронный распад · Протонный распад · Гамма излучение · Фоторасщепление |
|
Захваты Электронный захват · Нейтронный захват (r-процесс · s-процесс) · Протонный захват (p-процесс · rp-процесс) · Нейтронизация |
|
Деление ядра Спонтанное деление |
|
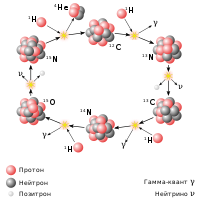
Нуклеосинтез Первичный нуклеосинтез · Протон-протонный цикл · CNO-цикл · Тройная гелиевая реакция · Гелиевая вспышка · Ядерное горение углерода · Углеродная детонация · Ядерное горение кислорода · Ядерное горение неона · Ядерное горение кремния · Реакции скалывания |
| См. также: Портал:Физика |
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома. Атомные ядра изучает ядерная физика.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным 
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы, у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом 



Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами[1][2][3].
История[править | править код]
В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил[4]:
Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала.
Таким образом Резерфорд открыл атомное ядро, с этого момента и ведёт начало ядерная физика, изучающая строение и свойства атомных ядер.
После обнаружения стабильных изотопов элементов, ядру самого лёгкого атома была отведена роль структурной частицы всех ядер. С 1920 года ядро атома водорода имеет официальный термин — протон. В 1921 году Лиза Мейтнер предложила[5] первую, протон-электронную, модель строения атомного ядра, согласно которой оно состоит из протонов, электронов и альфа-частиц[6]:96. Однако в 1929 году произошла «азотная катастрофа» — В. Гайтлер и Г. Герцберг установили[7], что ядро атома азота подчиняется статистике Бозе — Эйнштейна, а не статистике Ферми — Дирака, как предсказывала протон-электронная модель[8][9]:374. Таким образом, эта модель вступила в противоречие с экспериментальными результатами измерений спинов и магнитных моментов ядер[10]. В 1932 году Джеймсом Чедвиком была открыта новая электрически нейтральная частица, названная нейтроном. В том же году Иваненко[11] и, ссылаясь на работу первого[12], Гейзенберг выдвинули гипотезу о протон-нейтронной структуре ядра. В дальнейшем, с развитием ядерной физики и её приложений, эта гипотеза была полностью подтверждена[13].
Теории строения атомного ядра[править | править код]
В процессе развития физики выдвигались различные гипотезы строения атомного ядра; тем не менее, каждая из них способна описать лишь ограниченную совокупность ядерных свойств. Некоторые модели могут взаимоисключать друг друга.
Наиболее известными являются следующие:
- Капельная модель ядра — предложена в 1936 году Нильсом Бором.
- Оболочечная модель ядра — предложена в 30-х годах XX века.
- Обобщённая модель Бора — Моттельсона
- Кластерная модель ядра
- Модель нуклонных ассоциаций
- Оптическая модель ядра
- Сверхтекучая модель ядра
- Статистическая модель ядра
Ядерно-физические характеристики[править | править код]
Зарядовым числом 


Заряд[править | править код]
Число протонов в ядре 
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы 
, где


Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли[2].
Масса[править | править код]
Из-за разницы в числе нейтронов 

Кроме того, в ядерной физике часто используется энергетический эквивалент массы. Согласно соотношению Эйнштейна, каждому значению массы 
, где
— скорость света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
,
а так как 1 электронвольт = 1,602176⋅10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен[1][3]:
.
Радиус[править | править код]
Анализ распада тяжёлых ядер уточнил оценку Резерфорда[сн 3] и связал радиус ядра 

, где
— константа.
Так как радиус ядра не является чисто геометрической характеристикой и связан прежде всего с радиусом действия ядерных сил, то значение 



Моменты ядра[править | править код]
Как и составляющие его нуклоны, ядро имеет собственные моменты.
Спин[править | править код]
Поскольку нуклоны обладают собственным механическим моментом, или спином, равным 

Несмотря на то, что число нуклонов в ядре может быть очень велико, спины ядер обычно невелики и составляют не более нескольких 
Магнитный момент[править | править код]
Измерения спинов стали возможными благодаря наличию непосредственно связанных с ними магнитных моментов. Они измеряются в магнетонах и у различных ядер равны от −2 до +5 ядерных магнетонов. Из-за относительно большой массы нуклонов магнитные моменты ядер очень малы по сравнению с магнитными моментами электронов, поэтому их измерение гораздо сложнее. Как и спины, магнитные моменты измеряются спектроскопическими методами, наиболее точным является метод ядерного магнитного резонанса.
Магнитный момент чётно-чётных пар, как и спин, равен нулю. Магнитные моменты ядер с непарными нуклонами образуются собственными моментами этих нуклонов и моментом, связанным с орбитальным движением непарного протона[10].
Электрический квадрупольный момент[править | править код]
Атомные ядра, спин которых больше или равен единице, имеют отличные от нуля квадрупольные моменты, что говорит об их не точно сферической форме. Квадрупольный момент имеет знак плюс, если ядро вытянуто вдоль оси спина (веретенообразное тело), и знак минус, если ядро растянуто в плоскости, перпендикулярной оси спина (чечевицеобразное тело). Известны ядра с положительными и отрицательными квадрупольными моментами. Отсутствие сферической симметрии у электрического поля, создаваемого ядром с ненулевым квадрупольным моментом, приводит к образованию дополнительных энергетических уровней атомных электронов и появлению в спектрах атомов линий сверхтонкой структуры, расстояния между которыми зависят от квадрупольного момента[2].
Энергия связи[править | править код]
Большая энергия связи нуклонов, входящих в ядро, говорит о существовании ядерных сил, поскольку известные гравитационные силы слишком малы, чтобы преодолеть взаимное электростатическое отталкивание протонов в ядре. Связь нуклонов осуществляется чрезвычайно короткодействующими силами, которые возникают вследствие непрерывного обмена частицами, называемыми пи-мезонами, между нуклонами в ядре.
Экспериментально было обнаружено, что для всех стабильных ядер масса ядра меньше суммы масс составляющих его нуклонов, взятых по отдельности. Эта разница называется дефектом массы или избытком массы и определяется соотношением:
,
где 


Согласно принципу эквивалентности массы и энергии дефект массы представляет собой массу, эквивалентную работе, затраченной ядерными силами, чтобы собрать все нуклоны вместе при образовании ядра. Эта величина равна изменению потенциальной энергии нуклонов в результате их объединения в ядро.
Энергия, эквивалентная дефекту массы, называется энергией связи ядра и равна:
,
где 
Другим важным параметром ядра является энергия связи, приходящаяся на один нуклон ядра, которую можно вычислить, разделив энергию связи ядра на число содержащихся в нём нуклонов:
Эта величина представляет собой среднюю энергию, которую нужно затратить, чтобы удалить один нуклон из ядра, или среднее изменение энергии связи ядра, когда свободный протон или нейтрон поглощается в нём.
Как видно из поясняющего рисунка, при малых значениях массовых чисел удельная энергия связи ядер резко возрастает и достигает максимума при 



Такой характер поведения средней энергии связи указывает на свойство ядерных сил достигать насыщения, то есть на возможность взаимодействия нуклона только с малым числом «партнёров». Если бы ядерные силы не обладали свойством насыщения, то в пределах радиуса действия ядерных сил каждый нуклон взаимодействовал бы с каждым из остальных и энергия взаимодействия была бы пропорциональна 

Общая закономерность зависимости энергии связи от массового числа описывается формулой Вайцзеккера в рамках теории капельной модели ядра[1][2][14][15].
Устойчивость ядер[править | править код]
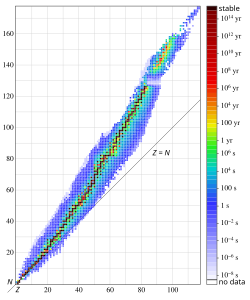
Зависимость числа нейтронов N от числа протонов Z в атомных ядрах (N=A-Z).
Из факта убывания средней энергии связи для нуклидов с массовыми числами больше или меньше 50-60 следует, что для ядер с малыми 

Детальные исследования показали, что устойчивость ядер также существенно зависит от параметра 



Если рассмотреть таблицу стабильных нуклидов, встречающихся в природе, можно обратить внимание на их распределение по чётным и нечётным значениям 







| Z | N=A-Z | A | Число нуклидов |
|---|---|---|---|
| Чётное | Чётное | Чётное | 167 |
| Чётное | Нечётное | Нечётное | 55 |
| Нечётное | Чётное | Нечётное | 53 |
| Нечётное | Нечётное | Чётное | 4 |
Таким образом, чётность числа протонов или нейтронов создаёт некоторый запас устойчивости, который приводит к возможности существования нескольких стабильных нуклидов, различающихся соответственно по числу нейтронов для изотопов и по числу протонов для изотонов. Также чётность числа нейтронов в составе тяжёлых ядер определяет их способность делиться под воздействием нейтронов[2].
Ядерные силы[править | править код]
Ядерные силы — это силы, удерживающие нуклоны в ядре, представляющие собой большие силы притяжения, действующие только на малых расстояниях. Они обладают свойствами насыщения, в связи с чем ядерным силам приписывается обменный характер (с помощью пи-мезонов). Ядерные силы зависят от спина, не зависят от электрического заряда и не являются центральными силами[2].
Уровни ядра[править | править код]
В отличие от свободных частиц, для которых энергия может принимать любые значения (так называемый непрерывный спектр), связанные частицы (то есть частицы, кинетическая энергия которых меньше абсолютного значения потенциальной), согласно квантовой механике, могут находиться в состояниях только с определёнными дискретными значениями энергий, так называемый дискретный спектр. Так как ядро — система связанных нуклонов, оно обладает дискретным спектром энергий. Обычно оно находится в наиболее низком энергетическом состоянии, называемым основным. Если передать ядру энергию, оно перейдёт в возбуждённое состояние.
Расположение энергетических уровней ядра в первом приближении:
, где:






С ростом энергии возбуждения уровни сближаются быстрее у тяжёлых ядер, также плотность уровней зависит от чётности числа нейтронов в ядре. Для ядер с чётными (особенно магическими) числами нейтронов плотность уровней меньше, чем для ядер с нечётными, при равных энергиях возбуждения первый возбуждённый уровень в ядре с чётным числом нейтронов расположен выше, чем в ядре с нечётным.
Во всех возбуждённых состояниях ядро может находиться лишь конечное время, до тех пор, пока возбуждение не будет снято тем или иным путём. Состояния, энергия возбуждения которых меньше энергии связи частицы или группы частиц в данном ядре, называются связанными; в этом случае возбуждение может сниматься лишь гамма-излучением. Состояния с энергией возбуждения, превышающей энергию связи частиц, называются квазистационарными. В этом случае ядро может испустить частицу или гамма-квант[1].
Ядерные реакции[править | править код]
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом.
Радиоактивность[править | править код]
Лишь небольшая часть нуклидов являются стабильными. В большинстве случаев ядерные силы оказываются неспособны обеспечить их постоянную целостность, и ядра рано или поздно распадаются. Это явление получило название радиоактивности.
Система обозначений ядер[править | править код]
Для обозначения атомных ядер используется следующая система:
Таким образом, состав ядра оказывается полностью определён, так как 
Пример такого обозначения:

Иногда, однако, для полноты вокруг обозначения элемента указывают все характеризующие ядро его атома числа:
- слева снизу — зарядовое число
, то есть, то же самое, что указано символом элемента;
- слева сверху — массовое число
;
- справа снизу — изотопическое число
[источник не указан 1372 дня (обс.)];
- если речь идёт о ядерных изомерах, к массовому числу приписывается буква из последовательности m, n, p, q, … (иногда используют последовательность m1, m2, m3, …). Иногда эту букву указывают в качестве самостоятельного индекса справа сверху.
Примеры таких обозначений:




Обозначения атомных ядер совпадают с таковыми для нуклидов.
По историческим и иным причинам, некоторые ядра имеют самостоятельные названия. Например, ядро 4He называется α-частицей, ядро дейтерия 2H (или D) — дейтроном, а ядро трития 3H (или T) — тритоном. Последние два ядра являются изотопами водорода и поэтому могут входить в состав молекул воды, давая в итоге так называемую тяжёлую воду.
Примечания[править | править код]
- Использованная литература
- ↑ 1 2 3 4 5 6 7 Бартоломей Г.Г., Байбаков В.Д., Алхутов М.С., Бать Г.А. Основы теории и методы расчета ядерных энергетических реакторов. — М.: Энергоатомиздат, 1982. — С. 512.
- ↑ 1 2 3 4 5 6 7 8 Климов А. Н. Ядерная физика и ядерные реакторы. — М.: Энергоатомиздат, 1985. — С. 352.
- ↑ 1 2 Ганев И. Х. Физика и расчёт реактора. — М.: Энергоиздат, 1981. — С. 368.
- ↑
Кудрявцев П. С. Открытие атомного ядра // Курс истории физики. — 2-е изд., испр. и доп. — М.: Просвещение, 1982. — 448 с. - ↑ Meitner, L. Über die verschiedenen Arten des radioaktiven Zerfalls und die Möglichkeit ihrer Deutung aus der Kernstruktur (нем.) // Zeitschrift für Physik : magazin. — 1921. — Bd. 4. — S. 146—156.
- ↑ Мухин К. Привлекательный мир микрофизики // Наука и жизнь. — 2015. — № 10. — С. 96—103.
- ↑ W. Heitler, G. Herzberg. Gehorchen die Stickstoffkerne der Boseschen Statistik? (нем.) // Naturwissenschaften (англ.) (рус. : magazin. — 1929. — Bd. 17. — S. 673.
- ↑ А. И. Ахиезер, М. П. Рекало. Биография элементарных частиц. — Киев: Наукова думка, 1979. — С. 18.
- ↑ Ю. А. Храмов. Физики:Биографический справочник. — 2-е изд. — М.: Наука, 1983.
- ↑ 1 2 Мухин К. Н. Экспериментальная ядерная физика. — М.: Энергоатомиздат, 1983.
- ↑ Iwanenko, D.D., The neutron hypothesis, Nature 129 (1932) 798.
- ↑ Г. А. Сарданашвили. Дмитрий Иваненко – суперзвезда советской физики. Ненаписанные мемуары. — Либроком. — 2010. — С. 12.
- ↑ Глесстон С. Атом. Атомное ядро. Атомная энергия. — М.: Изд-во иностр. лит., 1961.
- ↑ I.R.Cameron, University of New Brunswick. Nuclear fission reactors. — Canada, New Brunswick: Plenum Press, 1982.
- ↑ Камерон И. Ядерные реакторы. — М.: Энергоатомиздат, 1987. — С. 320.
- ↑ Rohlf, James William. Modern Physics from α to Z°. — John Wiley & Sons, 1994. — С. 664. — ISBN 0471572705.
Литература[править | править код]
- М. Айзенберг, В. Грайнер. Модели ядер, коллективные и одночастичные явления. — М.: Атомиздат, 1975. — 454 c.
- М. Айзенберг, В. Грайнер. Микроскопическая теория ядра. — М.: Атомиздат, 1976. — 488 с.
- К. Бракнер Теория ядерной материи. — М., Мир, 1964. — 302 с.
- О. Бор, Б. Моттельсон. Структура атомного ядра. — В 2-х т. — М.: Мир, 1971—1977.
- В. П. Крайнов. Лекции по микроскопической теории атомного ядра. — М.: Атомиздат, 1973. — 224 с.
- В. В. Маляров. Основы терии атомного ядра. 2-ое изд. — М.: Наука, 1967. — 512 с.
- Р. Натаф. Модели ядер и ядерная спектроскопия. — М.: Мир, 1968. — 404 с.
- С. М. Поликарпов. Необычные ядра и атомы. — М.: Наука, 1977. — 152 с.
- Дж. Рейнуотер. Как возникла модель сфероидальных ядер. Успехи физических наук, 1976, Том 120. Вып. 4, с. 529—541. (Нобелевская лекция по физике 1975 г.)
- А. Г. Ситенко. Теория ядерных реакций. — М.: Энергоатомиздат, 1983. — 352 с.
- А. Г. Ситенко, В. К. Тартаковский. Лекции по теории ядра. — М.: Атомиздат, 1972. — 352 с.
- Л. Слив М. И. Стрикман, Л. Л. Франкфурт. Проблемы построения микроскопической теории ядра и квантовая хромодинамика, Успехи физических наук, 1976, Том 145. Вып. 4, с. 553—592.
- В. Г. Соловьев. Теория атомного ядра. Ядерные модели. — М.: Энергоиздат, 1981. — 296с.
- В. Г. Соловьев. Теория сложных ядр. — М.: Наука, 1971. — 560 с.
- Журнал: Физика элементарных частиц и атомного ядра (ЭЧАЯ) (Архив статей с 1970 г.)
Ссылки[править | править код]
- Ядро атомное — Физическая энциклопедия
- Колебательные возбуждения ядер — Физическая энциклопедия
- Ядерные модели — Физическая энциклопедия
- Капельная модель ядра — Физическая энциклопедия
- Ядерная материя — Физическая энциклопедия
- Ядерные цепные реакции — Физическая энциклопедия
- Деформированные ядра — Физическая энциклопедия
- Б. С. Ишханов, Э. И. Кэбин, Физика ядра и частиц, XX век. МГУ, 2000.
- Ядерная энергия