Валентина Вавилова(Серкова)
Гений
(62183)
10 лет назад
Масса молекулы ( атома) определяется по формуле
m0=M / Na. ( m0-масса молекулы (атома) , М-молярная масса ( атома водорода) =0,001кг/моль, Na-постоянная Авогадро=6,02*10^23 ( 1 / моль) .
m0=0,001 / 6,02*10^23=1,66*10^27кг. ( это атома, молекулы в 2 раза больше, так как Н2.)
Арагами
Мудрец
(15832)
10 лет назад
Масса атома водорода = масса протона + масса электрона
Масса атома водорода = 1,6726485(86)·10^-27 кг + 9,10938291(40)·10^−31 кг = 1,674 10^-27 кг
Алексей Бараев
Гений
(69534)
10 лет назад
Ядро атома составляет более 99.9% массы атома. Ядро атома водорода состоит из одного протона.
Масса протона 1,007 276 атомных единиц массы, что составит 1,672 621 * 10^(-27) кг.
Можно пойти другим путем. Масса протона равна массе 1836,153 электронов, таким образом масса АТОМА водорода будет равна массе 1837,153 электронов.
Как найти массу ядра
Ядро атома ничтожно мало по сравнению с его общими размерами. Представить это поможет, например, такая образная модель атома водорода: если в самом центре футбольного поля положить небольшое яблоко, изображающее ядро, то орбита электрона прошла бы приблизительно по вратарской линии. Абсолютное большинство объема атома занимает пустота. И при этом столь же абсолютное большинство массы атома сосредоточено в его ядре. Достаточно сказать, что в том же атоме водорода его ядро тяжелее, чем электрон, в 1836 раз! А как же найти массу атомного ядра?

Инструкция
Упомянутый атом водорода имеет простейшее строение ядра из всех химических элементов. Оно состоит из единственной частицы, которая называется «протон». Все другие элементы имеют более сложное строение, и в состав их ядер, помимо протонов, входят так называемые «нейтроны». Запомните, что масса протона практически совпадает с массой нейтрона. Это очень важно.
За единицу измерения принята «атомная единица массы», или по-другому «Дальтон». Это масса 1/12 атома изотопа углерода. Она приблизительно равна 1,66*10^-24грамм. Именно из этой величины вам надо исходить, рассчитывая массу ядра того или иного химического элемента.
Легко можно понять, что поскольку масса электронов ничтожно мала по сравнению с массой протонов и нейтронов, ею в расчетах можно пренебречь. Разумеется, если не требуется очень высокая точность. Поэтому, решая задачу о нахождении массы ядра, можно рассматривать только «тяжелые» частицы – протоны и нейтроны. Их сумма дает вам «массовое число». Его необходимо умножить на величину атомной единицы массы и получить требуемый результат.
А как узнать массовое число? Тут на помощь придет знаменитая Таблица Менделеева. Каждому элементу в ней отведено строго определенное место, а заодно дана вся необходимая информация. В частности указана атомная масса элемента, которую можно принять за массовое число, поскольку общая масса электронов атома ничтожно мала по сравнению с массой протонов и нейтронов.
Рассмотрите конкретный пример. Вот хорошо знакомый металл – золото (Au). Его атомная масса – 196,97. Округлите ее до 197 и умножьте на величину атомной единицы массы. Получите:(197*1,66)*10^-24 = 327,02*10^-24 = 3,2*10^-22 грамм. Вот такова приблизительная масса ядра атома золота.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Атомная единица массы (а. е. м.)
Для характеристики массы атомов и молекул используют понятие атомной массы М.
Атомная масса — относительная величина. Она определяется по отношению к массе атома углерода
| 12 |
|---|
| 6 |
C, которая принимается равной 12.000 000.
Хотя в химии также используют относительные атомные или молекулярные массы Аотн и Мотн, отнесенные к массе атома
| 12 |
|---|
| 6 |
C, их нельзя считать идентичными атомной массе М, поскольку они относятся к естественной смеси изотопов соответствующего элемента. Таким образом, они определяют среднюю атомную массу элемента. Однако поскольку изотопы одного элемента обладают разными физическими свойствами, в атомной физике принято указывать атомную массу М каждого изотопа.
Для абсолютного определения атомной массы была введена атомная единица массы (а. е. м.).
Атомная единица массы (а. е. м.) равна 1/12 массы атома углерода
| 12 |
|---|
| 6 |
C.
Отсюда следует, что углерод обладает относительной атомной массой М = 12.000 и абсолютной атомной массой m = 12.000 а. е. м. Атомную единицу массы можно перевести в единицу массы СИ — килограмм.
[ 1 enspace а. е. м. = frac{1}{12} m_{C_{12}} = 1.66057 cdot 10^{-27} enspace кг ]
[ 1 enspace кг = 6.022045 cdot 10^{26} enspace а. е. м. ]
Отсюда следует для массы атома
[ m_{а} = M cdot 1 enspace а. е. м. = M cdot 1.66057 cdot 10^{-27} enspace кг ]
Справочная таблица
Массы некоторых элементарных частиц и атомов
| Наименование частицы | Обозначение | Число протонов | Число нейтронов | Число электронов | Масса m, а. е. м. | ||
|---|---|---|---|---|---|---|---|
| Электрон |
e |
– | – | 1 | 0.00054858 | ||
| Протон(ядро атома водорода) |
p |
1 | – | – | 1.00727647 | ||
| Нейтрон |
n |
– | 1 | – | 1.00866501 | ||
| Атом водорода |
H |
1 | – | 1 | 1.00782504 | ||
| Дейтрон (ядро атома дейтерия) |
d |
1 | 1 | – | 2.01354 | ||
| Атом дейтерия |
H |
1 | 1 | 1 | 2.01410179 | ||
| α-частица (ядро атома гелия) |
α |
2 | 2 | – | 4.001488 | ||
| Атом гелия |
He |
2 | 2 | 2 | 4.00260327 |
Атомная единица массы а. е. м. |
стр. 737 |
|---|
Найдите массу атома водорода и гелия.
Если вам необходимо получить ответ на вопрос Найдите массу атома водорода и гелия?, относящийся
к уровню подготовки учащихся 5 – 9 классов, вы открыли нужную страницу.
В категории Физика вы также найдете ответы на похожие вопросы по
интересующей теме, с помощью автоматического «умного» поиска. Если после
ознакомления со всеми вариантами ответа у вас остались сомнения, или
полученная информация не полностью освещает тематику, создайте свой вопрос с
помощью кнопки, которая находится вверху страницы, или обсудите вопрос с
посетителями этой страницы.
Когда Резерфорд опровергнул модель Томсона о строении атома, возник другой вопрос: из чего состоит ядро? Ответ на этот вопрос был получен спустя пару десятков лет. До этого в качестве элементарного ядра принимали протон — положительную частицу, которая имеет заряд, по модулю равный заряду электрона: е = 1,6*10-19 Кл. Масса же частицы равна 1,6726 · 10−27 кг.
Изотопы
В результате наблюдения огромного числа радиоактивных превращений было обнаружено, что существуют вещества, идентичные по химическим свойствам, но имеющие совершенно различные радиоактивные свойства — в одних и тех же условиях их распад происходил по-разному. Эти вещества не удавалось разделить ни одним из известных химических способов. Поэтому английский радиохимик Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но разной радиоактивностью. Эти элементы, по его мнению, нужно было помещать в одну и ту же клетку периодической системы Д. И. Менделеева. Содди назвал такие элементами изотопами (т. е. занимающими одинаковые места).
Предположение Содди о существовании веществ с разной радиоактивностью, но одинаковыми химическими свойствами, было подтверждено экспериментально. Когда английский физик Томсон проводил точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях, он установил, что неон есть смесь двух видов атомов. Большая часть атомов имела относительную массу 20, но некоторая часть атомов имела массу, равную 22 а. е. м. В результате относительная атомная масса смеси атомов неона была принята равной 20,2. Причем атомы обладали одинаковыми химическими свойствами, но масса их была различна.
С тех пор изотопы были обнаружены у разных химических элементов. Так, они есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Было установлено, что:
- Изотопы имеют разную массу.
- Заряды ядер изотопов одинаковы;
- Количество электронов у атомов изотопов одинаково.
- Химические свойства изотопов тоже одинаковые.
- Радиоактивность у изотопов разная — ядра одних атомов радиоактивны, в то время как другие могли быть стабильными или менее радиоактивными.
Эти обобщения помогли сделать вывод, что свойства радиоактивности изотопов зависят от их массы. Причем некоторые элементы могут иметь только нестабильные, или радиоактивные изотопы.
Особый интерес для физиков того времени представлял атом водорода, изотопы которого могли отличаться по массе в 2 и 3 раза:
- Дейтерий — изотоп водорода с атомной массой 2. Это стабильный химический элемент, который можно обнаружить в качестве примеси в обычном водороде. На 4500 атомов обычного водорода приходится 1 атом дейтерия. Совместно с кислородом дейтерий образует тяжелую воду. Ее свойства несколько отличаются от обычной воды. Так, при нормальном атмосферном давлении ее температура кипения составляет 101,2 °С, а температура кристаллизации — 3,8 °С.
- Тритий — изотоп водорода с атомной массой 3. Это нестабильный химический элемент. Он претерпевает β-распад. Период полураспада этого вещества составляет 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Открытие нейтрона
При бомбардировке бериллия α-частицами, испускаемыми нестабильным полонием, возникает сильное проникающее излучение, которое легко преодолевает преграду в виде слоя свинца толщиной до 10–20 см. Это излучение изучали английский физик Чедвик и супруги Жолио-Кюри Ирен и Фредерик из Франции независимо друг от друга примерно в одно и то же время. Ученые предположили, что это излучение создано γ-лучами большой энергии. Но затем выяснилось, что если на пути излучения бериллия поставить пластинку из парафина, то ионизирующая способность излучения резко возрастает.
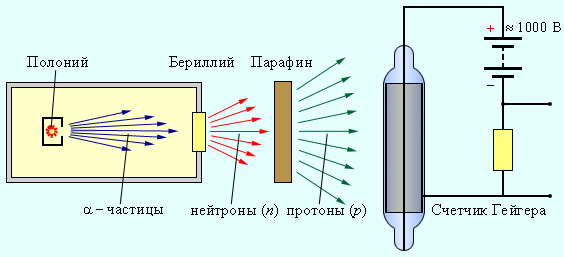
Было установлено, что излучение бериллия выбивает из парафиновой пластинки протоны, которые в большом количестве имеются в этом веществе. Ученые рассчитали длину свободного пробега протонов в воздухе они оценили энергию γ-квантов, которые сообщают при столкновении с протонами необходимую скорость. Расчеты показали слишком большое значение — 50 МэВ. протонам необходимую скорость. Она оказалась огромной – порядка 50 МэВ. Из-за малой массы γ-кванты не могли обладать такой энергией. Поэтому Чедвик сделал вывод, что из бериллия под действием α-частиц вылетают не безмассовые γ-кванты, а довольно тяжелые частицы. Эти частицы обладали большой проникающей способностью и не ионизировали газ в счетчике Гейгера. Это значит, что такие частицы были электрически нейтральными. Этой частице дали название — нейтрон.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
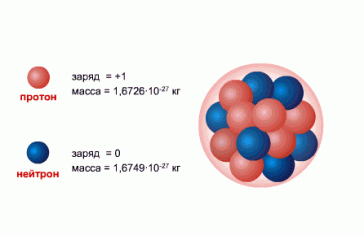
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
AZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:

Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Ядерные силы
Ядра атомов обладают устойчивостью, несмотря на то, что между протонами действуют колоссальные силы кулоновского отталкивания. Чем же объясняется это явление? Видимо, между ними существует и другая сила, которая не дает протонам отталкиваться друг от друга. Такие силы назвали ядерными.
Ядерные силы — силы, действующие между протонами и нейтронами.
Ученые установили, что ядерные силы обладают следующими свойствами:
- Ядерные силы заметно проявляются только на расстояниях, сравнимых с размером атомных ядер (10–12–10–13 см). То есть, эти силы являются короткодействующими.
- Ядерные силы примерно в 100 раз превосходят силы электрического взаимодействия. На сегодня это самые мощные силы из всех сил, известных в природе. Именно благодаря им ядра атомов химических элементов сохраняются в устойчивом состоянии.
Энергия связи атомных ядер
Нуклоны в ядре прочно удерживаются ядерными силами. Если совершить работу по их преодолению, придется совершить некоторую работу. Энергию, которую нужно затратить для совершения работы по разделению на отдельные нуклоны, называют энергией связи ядра.
Энергия связи ядра атома — энергия, которая необходима для полного расщепления ядра на отдельные протоны и нейтроны.
На основании закона сохранения энергии можно сделать вывод, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
В настоящее время рассчитать энергию связи теоретически, подобно тому, как это можно сделать для электронов в атоме, не удается. Выполнить соответствующие расчеты можно, лишь применяя соотношение Эйнштейна между массой и энергией:
Е = mс2
Измерения масс ядер показали, что масса покоя ядра всегда меньше суммы масс входящих в его состав протонов и нейтронов:
Mя< Zmp + Nmn
Mя — масса покоя ядра, Z — число протонов, N — число нейтронов, mp — масса протона, mn — масса нейтрона.
На основании этого был сделан вывод о существовании дефекта (разности масс). Дефект масс определяется разностью суммы масс протонов и нейтронов, входящих в состав ядра, и массы покоя ядра атома:
ΔM=Zmp + Nmn−Mя
ΔM — дефект масс.
Это интересно! Масса ядра атома гелия на 0,75% меньше суммы масс двух протонов и двух нейтронов. Соответственно для гелия в количестве вещества один моль ΔM = 0,03 г.
Уменьшение массы при образовании ядра из нуклонов означает, что при этом уменьшается энергия этой системы нуклонов на значение энергии связи Есв.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
Энергия связи определяется формулой:
Eсв=ΔMс2=(Zmp + Nmn−Mя)с2
Это интересно! Энергия связи настолько велика, что образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельная энергия связи — энергия связи, приходящаяся на один нуклон ядра.
Удельную энергию связи устанавливают опытным путем. Из рисунка ниже видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Примечательно, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
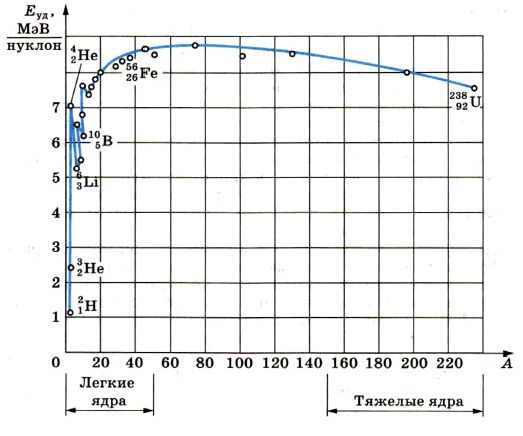
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Пример №2. Чему равна энергия связи ядра тяжелого водорода — дейтрона? Атомная масса ядра дейтрона mD = 2,01355 а. е. м, протона mр = 1,00728 а. е. м, нейтрона mn = 1,00866 а. е. м; масса атома углерода mс = 1,995 ∙ 10-26 кг.
Eсв=(Zmp + Nmn−Mя)с2
Зарядовое число водорода — 1. Количество нейтронов — 1. Чтобы найти суммарную массу всех частиц и ядра, нужно их массу в а. е. м. умножить на массу атома углерода в кг и поделить на 12. Это необходимо потому, что 1 а. е. м. равна 1/12 массы атома углерода. Получим:
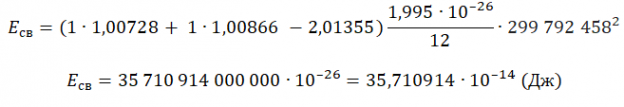
Переведем в МэВ, учитывая, что 1 МэВ = 1,6∙10–13 Дж:
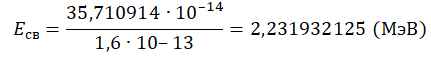
Задание EF17709
Какая из строчек таблицы правильно отражает структуру ядра 49115 In?

Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева. Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17974
Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.
- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18942
На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
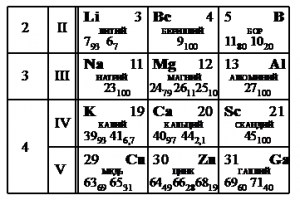
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.

Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 1.8k
