| Медь | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Никель | Цинк → | |||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
| Внешний вид простого вещества | |||||||||||||||||||||||||||

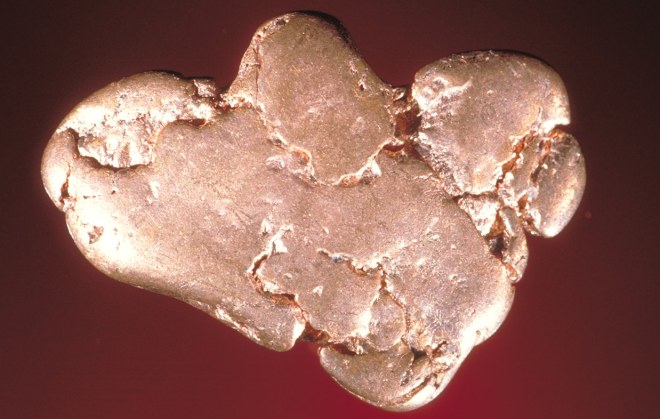
Самородная медь |
|||||||||||||||||||||||||||
| Свойства атома | |||||||||||||||||||||||||||
| Название, символ, номер | Медь/Cuprum (Cu), 29 | ||||||||||||||||||||||||||
| Группа, период, блок |
11 (устар. 1), 4, d-элемент |
||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
63,546(3)[1] а. е. м. (г/моль) | ||||||||||||||||||||||||||
| Электронная конфигурация |
[Ar] 3d104s1 1s22s22p63s23p63d104s1 |
||||||||||||||||||||||||||
| Радиус атома | 128 пм | ||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||
| Ковалентный радиус | 117 пм | ||||||||||||||||||||||||||
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм | ||||||||||||||||||||||||||
| Электроотрицательность | 1,90 (шкала Полинга) | ||||||||||||||||||||||||||
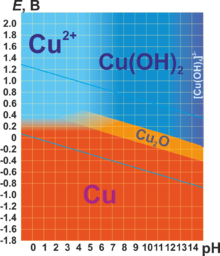
| Электродный потенциал | +0,337 В/ +0,521 В | ||||||||||||||||||||||||||
| Степени окисления | 0; +1; +2; +3; +4 | ||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
745,0 (7,72) кДж/моль (эВ) | ||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||||||||||||||
| Плотность (при н. у.) | 8,92 г/см³ | ||||||||||||||||||||||||||
| Температура плавления | 1356,55 K (1083,4 °С) | ||||||||||||||||||||||||||
| Температура кипения | 2840,15 К (2567 °С) | ||||||||||||||||||||||||||
| Уд. теплота плавления | 13,01 кДж/моль | ||||||||||||||||||||||||||
| Уд. теплота испарения | 304,6 кДж/моль | ||||||||||||||||||||||||||
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) | ||||||||||||||||||||||||||
| Молярный объём | 7,1 см³/моль | ||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||||||||||||||
| Структура решётки | Кубическая гранецентрированая | ||||||||||||||||||||||||||
| Параметры решётки | 3,615 Å | ||||||||||||||||||||||||||
| Температура Дебая | 315 K | ||||||||||||||||||||||||||
| Прочие характеристики | |||||||||||||||||||||||||||
| Теплопроводность | (300 K) 401 Вт/(м·К) | ||||||||||||||||||||||||||
| Номер CAS | 7440-50-8 | ||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | |||||||||||||||||||||||||||
|
Основная статья: Изотопы меди
|
Медь (химический символ — Cu, от лат. Cuprum) — химический элемент 11-й группы (по устаревшей классификации — побочной подгруппы первой группы, IB) четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29.
В виде простого вещества медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
C давних пор широко используется человеком.
История[править | править код]
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк[3]. Медный век, когда значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Экспериментальные исследования С. А. Семёнова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий[4].
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопках. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 см по сторонам и 0,5 мм толщиной. Монета имела хождение по всему западному побережью Южной Америки, в том числе и в государстве Инков[5].
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[6].
Происхождение названия[править | править код]
Латинское название меди Cuprum (древнелат. aes cuprium, aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется χαλκός, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди aes (санскр. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра[7], и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской[7][8]. С Гумёшевским рудником Полевского, — крупнейшим в XVIII−XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломлённым народным сознанием образом богини Венеры[7].
Русское слово медь (и медный) встречается в древнейших русских литературных памятниках: ст.‑слав. *mědь, «медь» не имеет чёткой этимологии, возможно, исконное слово[9][10]. В. И. Абаев предполагал, что, возможно, слово „Медь“ произошло от названия страны Мидия: *Мѣдь из иранского Мādа — через посредство греч. Μηδία[11]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[11].
Нахождение в природе[править | править код]
Среднее содержание меди в земной коре (кларк) — (0,78-1,5)·10−4[12]% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[13].
Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[14].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства[править | править код]
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[15] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5—58 МСм/м[16]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 
Изотопы меди[править | править код]
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[17].
Получение[править | править код]
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод[править | править код]
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5—2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- Также чистую медь можно получить и в процессе экзотермической реакции восстановления оксида меди водородом:
Гидрометаллургический метод[править | править код]
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод[править | править код]
Электролиз раствора сульфата меди:
Химические свойства[править | править код]
Возможные степени окисления[править | править код]
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях и комплексах можно получить соединения со степенью окисления +3, +4 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество[править | править код]
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода в воздухе:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной соляной кислотой в присутствии кислорода:
C разбавленной соляной кислотой в присутствии перекиси водорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода при температуре 200 °C и до оксида меди(II) при избытке кислорода при температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
С йодом (йодида меди(II) не существует):
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
С концентрированной соляной кислотой и хлоратом калия:
С хлоридом железа(III):
Вытесняет менее активные металлы из их солей:
Соединения меди(I)[править | править код]
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы.
Также присутствую не растворимые в воде комплексы(например, дихлорокупрат(I)-ион [CuCl2]− устойчив:
-
)
Следует обратить внимание на то, что сульфат меди(I) нестабилен Он мгновенно разлагается и переходит в устойчивый сульфат меди(II).
- Большинство соединений имеют белую окраску либо бесцветны.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
Примером диспропорционирования может служить реакция оксида меди(I) с разбавленной серной кислотой:
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета, который
разлагается при температуре 1800°С:
Можно восстановить до элементарной меди:
Также протекает процесс алюминотермии:
Реагирует с концентрированными растворами щелочей:
С концентрированной соляной кислотой:
С разбавленными галоген кислотами(Hal = Cl, Br, I):
С разбавленной соляной кислотой в присутствии кислорода:
С концентрированной азотной кислотой:
С концентрированной серной кислотой:
С разбавленной серной кислотой:
С гидросульфитом натрия:
С аммиаком:
С раствором аммиака:
С азотистоводородной кислотой в разных условиях при охлаждении:
С серой:
С Сульфидом меди(I):
С кислородом:
С хлором:
С оксидами щелочных металлов(Ме = Li, Na, K, Rb, Cs):
С оксидом бария:
Соответствующий гидроксид CuOH (жёлтого цвета) разлагается при темперауре 100°С с образованием оксида меди(I).
Гидроксид CuOH проявляет основные свойства.
Также реагирует с раствором аммиака:
Реагирует с гидроксидом калия:
Соединения меди(II)[править | править код]
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует оксид CuO чёрного цвета, который разлагается при температуре 1100 °С:
Реагирует с раствором аммиака с образованием Реактива Швейцера:
Растворяется в концентрированных щелочах с образованием комплексов:
При сплавлении с щелочами образуются купраты металлов:
С азотной кислотой:
Реагирует с йодоводородной кислотой с образованием йодида меди(I), так как йодида меди(II) не существует:
Протекают процессы магниетермии и алюминотермии:
Также можно восстановить до элементарной меди следующими способами:
Оксид меди(II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соответствующий гидроксид Cu(OH)2 (голубого цвета), который при длительном стоянии разлагается, переходя в оксид меди(II) чёрного цвета:
Также в избытке влаги возможно окисление меди, и переход в гидроксид куприла, в котором степень окисления меди +3:
При нагревании до 70 °С разлагается:
Реагирует с растворами концентрированных щелочей с образованием гидроксокомплексов синего цвета (это подтверждает преимущественно основный характер Cu(OH)_2):
С образованием солей меди(II) растворяется во всех кислотах(в том числе кислотах окислителях) кроме йодоводородной:
Реакция с йодоводородной кислотой отличается тем, что образуется йодид меди(I), так как йодида меди(II) не существует:
Реакция с водным раствором аммиака является из важных в химии, так как образуется реактив Швейцера (растворитель целлюлозы):
Также суспензия гидроксида меди реагирует с углекислым газом с образованием дигидроксокарбонатом меди(II):
Большинство солей двухвалентной меди имеют синюю или зелёную окраску.
При растворении солей меди(II) в воде образуются голубые аквакомплексы [Cu(H2O)6]2+.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Соединения меди(III) и меди(IV)[править | править код]
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Оксид меди(III) не получен. Под этим названием описаны различные купраты(III).
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
Аналитическая химия меди[править | править код]
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этом сульфид меди выпадает в далее взвешиваемый осадок.
- В растворах, при отсутствии мешающих ионов, медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение[править | править код]
В электротехнике[править | править код]
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C: 0,01724—0,0180 мкОм·м/[16]), медь широко применяется в электротехнике для изготовления силовых и других кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[18].
Самое частое применение меди — электротехника
Теплообмен[править | править код]
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб[править | править код]
В связи с высокой механической прочностью и пригодностью для механической обработки медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[19], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы[править | править код]
Сплавы на основе меди[править | править код]
Латунная игральная кость, рядом цинк и слиток меди
Статуэтка, отлитая из бронзы
В разнообразных областях техники широко используются сплавы с использованием меди,
самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь.
Оба сплава являются общими названиями для целого семейства материалов,
в которые, помимо олова и цинка, могут входить никель, висмут и другие металлы.
Например, в состав пушечной бронзы, использовавшейся для изготовления артиллерийских орудий вплоть до XIX века, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия.
Большое количество латуни идёт на изготовление гильз артиллерийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25—29 кгс/мм² у технически чистой меди.
Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Медь и её сплавы латунь и бронза обладают высокой коррзионой стойкостью, электро- и теплопроводностью, антифрикционными показателями. При этом медь хорошо сваривается и обрабатывается резанием. [20]
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[21].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 °C , обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей.
Сплавы, в которых медь значима[править | править код]
Повреждённая пожаром дюралевая деталь дирижабля Гинденбург (LZ 129)
Дюраль (дюралюминий) определяют как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы[править | править код]
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к механическим воздействиям.
Соединения меди[править | править код]
Оксиды меди используются для получения оксида иттрия-бария-меди (купрата) YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников.
Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения[править | править код]
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за того, что медь является катализатором полимеризации ацетилена (образует соединения меди с ацетиленом), трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[22].
Медь может быть использована для снижения переноса инфекции в лечебных учреждениях через поверхности, к которым прикасается рука человека. Из меди могут быть изготовлены ручки дверей, водозапорной арматуры, перила, поручни кроватей, столешницы[23].
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 510 и 578 нм[24].
Также медь применяется в пиротехнике для окрашивания в синий цвет.[источник не указан 916 дней]
Стоимость[править | править код]
В январе 2008 года, впервые за всю историю, на Лондонской бирже металлов цены на медь превысили 8000 долларов США за тонну. В начале июля цены возросли до 8940 долларов за тонну, что стало абсолютным рекордом начиная с 1979 года — момента начала ведения торгов на ЛБМ. Цена достигла пика в почти 10,2 тыс. долларов в феврале 2011 года[25].
На 2011 год стоимость меди составляла около 8900 долларов за тонну[26]. Вследствие кризиса мировой экономики цена на большинство видов сырья упала, и стоимость 1 тонны меди на 1 сентября 2016 не превышала 4700 долларов[27]. В мае 2021 цена меди взлетела до 10307$ за тонну на бирже[28].
Биологическая роль[править | править код]
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[29].
Токсичность[править | править код]
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 1 мг/л (СанПиН 2.1.4.1074-01), однако недостаток меди в питьевой воде также нежелателен. Всемирная организация здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[30].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[30]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность[править | править код]
Бактерицидные свойства меди и её сплавов были известны человеку давно.
В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[31] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[32]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/H1N1 (т. н. «свиной грипп»)[33].
Органолептические свойства[править | править код]
Излишняя концентрация ионов меди придаёт воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди[править | править код]
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[34][35]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы[34], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[34]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. т, потребление — 591,4 тыс. т[36].
Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[37].
Мировое производство меди в 2007 году составляло[38] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
США (1,170/1,310),
Перу (1,190/1,220),
Китай (0,946/1,000),
Австралия (0,870/0,850),
Россия (0,740/0,750),
Индонезия (0,797/0,650),
Канада (0,589/0,590),
Замбия (0,520/0,560),
Казахстан (0,407/0,460),
Польша (0,452/0,430),
Мексика (0,347/0,270).
По объёму мирового производства и потребления металлов медь занимает третье место после железа и алюминия.
Выплавка меди в 2019 ожидается 25,5 млн т[39].
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается, что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Современные способы добычи[править | править код]
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская Республика. Эскондида — самый большой в мире карьер, в котором добывают медную руду (расположен в Чили). В зависимости от глубины залегания, руда добывается открытым или закрытым методом[40].
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её растворения в слабом растворе серной кислоты и последующего выделения металлической (черновой) меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки — 1450 °C.
С целью окисления сульфидов и железа полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит раствор серной кислоты с медным купоросом. В ходе электролиза происходит повышение концентрации серной кислоты. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлама, который идёт на переработку с целью извлечения ценных металлов. При получении 1000 тонн электролитической меди можно получить до 3 кг серебра и 200 г золота. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[41].
Влияние на экологию[править | править код]
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в карьере медного рудника.
См. также[править | править код]
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- ↑ Спиридонов, 1989, с. 5—8.
- ↑ Спиридонов, 1989, с. 20—22.
- ↑ Waldemar Espinoza Soriano. Etnohistoria ecuatoriana: estudios y documentos (исп.). — Quito: Abya-Yala, 1988. — С. 135.
- ↑ Спиридонов, 1989, с. 172.
- ↑ 1 2 3 Перфильев А. В. Герб и символы Полевского // Полевской край: Историко-краеведческий сборник. — Екатеринбург : Уралтрейд, 1998. — Вып. 1, № 3. — (Уральское краеведение).
- ↑ Официальные символы Архивная копия от 15 октября 2016 на Wayback Machine, на сайте Администрации Полевского городского округа
- ↑ Этимологический словарь славянских языков, том 18. — М.: Наука, 1993. — С. 144−146.
- ↑ Откупщиков Ю. В. Очерки по этимологии. — СПб.: Издательство Санкт-Петербургского университета. — 2001. — С. 127−130.
- ↑ 1 2 медь // Этимологический словарь русского языка = Russisches etymologisches Wörterbuch : в 4 т. / авт.-сост. М. Фасмер ; пер. с нем. и доп. чл.‑кор. АН СССР О. Н. Трубачёва, под ред. и с предисл. проф. Б. А. Ларина [т. I]. — Изд. 2-е, стер. — М. : Прогресс, 1986—1987.
- ↑ Григорьев Н.А. Распределение химических элементов в верхней части континентальной коры / отв. ред. д.г.-м.н. Сазонов В.Н.. — Екатеринбург: УрО РАН, 2009. — С. 36. — 383 с. — ISBN isbn 978-5-7691-2038-1.
- ↑ Медь самородная — статья из Большой советской энциклопедии.
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны). Дата обращения: 29 ноября 2010. Архивировано из оригинала 19 июня 2010 года.
- ↑ при 20 °С: 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ Применение меди Архивная копия от 14 сентября 2010 на Wayback Machine (недоступная ссылка с 21-05-2013 [3649 дней] — история, копия)
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия. Дата обращения: 24 июля 2008. Архивировано 14 сентября 2008 года.
- ↑ Грудев А. П., Машкин Л. Ф., Ханин М. И. Технология прокатного производства. — М.: Металлургия, 1994. — С. 441. — 656 с. — ISBN 5-229-00838-5.
- ↑ Смирягин А. П., Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. — 3-е изд. — Металлургия, 1974. — С. 321—488.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди. Дата обращения: 25 декабря 2009. Архивировано 8 ноября 2009 года.
- ↑ Hannah Bloch. A Copper Bedrail Could Cut Back On Infections For Hospital Patients. Дата обращения: 11 ноября 2020. Архивировано 8 ноября 2020 года.
- ↑ Исаев А. А. Лазер на парах меди. Дата обращения: 6 января 2015. Архивировано 4 марта 2016 года.
- ↑ Цены на сырьё упали до самого низкого уровня со времен кризиса 2008 г. / Новости / Finance.UA. Дата обращения: 26 апреля 2015. Архивировано 6 октября 2014 года.
- ↑ Цена меди. Дата обращения: 28 мая 2011. Архивировано 1 апреля 2013 года.
- ↑ Графики цены меди за различные периоды. Дата обращения: 1 сентября 2016. Архивировано 29 августа 2016 года.
- ↑ Цена на медь достигла рекордно высокого значения в ходе торгов — Экономика и бизнес — ТАСС. Дата обращения: 13 сентября 2021. Архивировано 13 сентября 2021 года.
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Дата обращения: 29 декабря 2009. Архивировано 22 августа 2011 года.
- ↑ US EPA. Дата обращения: 25 июля 2008. Архивировано 29 сентября 2015 года.
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей. Дата обращения: 25 июля 2008. Архивировано 12 октября 2008 года.
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing. Дата обращения: 11 января 2010. Архивировано из оригинала 23 сентября 2012 года.
- ↑ 1 2 3 Производство меди. Дата обращения: 17 ноября 2007. Архивировано 5 октября 2008 года.
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года. Минпромэнерго РФ (18 марта 2009). Дата обращения: 29 декабря 2009. Архивировано из оригинала 18 октября 2010 года.
- ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009. Дата обращения: 30 сентября 2009. Архивировано 6 августа 2011 года.
- ↑ Мировой рынок столкнется с дефицитом меди в 2019 году — Ведомости. Дата обращения: 10 марта 2020. Архивировано 24 июня 2020 года.
- ↑ Способы и места добычи меди. promzn.ru. Дата обращения: 25 августа 2018. Архивировано 26 августа 2018 года.
- ↑ Получение меди. Дата обращения: 29 января 2011. Архивировано 11 февраля 2011 года.
Литература[править | править код]
- Данные на начало XX века:. Медь // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Спиридонов А. А. В служеньи ремеслу и музам. — 2-е изд. — М.: Металлургия, 1989. — 176 с. — (Научно-популярная библиотека школьника). — 50 000 экз. — ISBN 5-229-00355-3.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
- Максимов М. М., Горнунг М. Б. Очерк о первой меди. — М.: Недра, 1976. — 96 с. — 40 000 экз.
Ссылки[править | править код]
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
Медь сегодня — металл необыкновенно востребованный и широко применяющийся как в быту, так и в промышленности. В природе Cu можно встретить как в чистом состоянии, так и в виде руды. Способов добычи и получения меди из исходных горных пород существует несколько. При этом все они используются в промышленности достаточно широко. О том, как добывают медь, и пойдет речь в статье.
Немного истории
В какой местности медь в древние времена начала добываться и использоваться человеком впервые, археологам, к сожалению, выяснить не удалось. Однако доподлинно известно, что именно этот металл люди начали обрабатывать и применять в повседневной жизни самым первым.
Известна медь человеку стала еще в каменном веке. Некоторые найденные археологами самородки этого металла несут на себе следы обработки каменными топорами. Первоначально люди использовали медь в основном только в качестве украшений. При этом применял для изготовления таких изделий человек в древние времена исключительно найденные им самородки этого металла. Позднее люди научились обрабатывать и содержащую медь руду.
Представление о том, как добывают Cu и как его обрабатывают, имели многие народы древности. Подтверждений тому археологами было найдено множество. После того как человек научился делать сплавы меди с цинком, начался бронзовый век. Собственно само название «медь» придумали когда-то древние римляне. В эту страну такой металл привозили в основном с острова Кипр. Поэтому римляне и назвали его aes cyprium.
Как добывали медь в древности
Поскольку металл этот в быту человеком когда-то использовался очень широко, технологии его добычи были, конечно же, разработаны достаточно совершенные. Наши предки получали медь в основном из малахитовых руд. Смесь такого материала и угля помещали в глиняный сосуд и ставили в яму. Далее массу в горшке поджигали. Выделявшийся в результате угарный газ восстанавливал малахит до меди.
Запасы в природе
Где можно добыть медь в дикой природе сегодня? На настоящий момент залежи этого популярного металла открыты на всех континентах Земли. При этом запасы Cu считаются практически неограниченными. Геологи в наше время находят все новые месторождения чистой меди, а также содержащих ее руд. К примеру, в 1950 г. мировые резервы этого металла составляли 90 млн тонн. К 1970 г. этот показатель уже увеличился до 250 млн т, а к 1998 г — до 340 млн т. На настоящий момент считается, что запасы меди на планете составляют более 2.3 млрд тонн.
Месторождения и способы добычи чистой меди
Как уже упоминалось, изначально человек использовал в быту самородный Cu. Конечно же, добывается такая чистая медь и в наши дни. Образуются самородки этого металла в земной коре в результате экзогенных и эндогенных процессов. Самое большое известное месторождение самородной меди на планете на данный момент находится в США, в районе озера Верхнее. В России самородная медь залегает в Удоканском месторождении, а также в некоторых других местах Забайкалья. Кроме того, ответом на вопрос о том, где можно добывать медь в России в виде самородков, является и уральский регион.
В природе чистый металл этой разновидности образуется в зоне окисления медносульфатных залежей. Обычно в самородках собственно самой меди содержится около 90-99%. Остальное приходится на другие металлы. В любом случае ответом на вопрос о том, как добывают медь самородную, служат две основных технологии. Разрабатывают такие месторождения, как и рудные, закрытым шахтным или открытым карьерным способом. В первом случае при этом используют такие технологические процессы, как бурение и отбойка.
Весить медные самородки могут очень много. Самые большие из них когда-то были найдены на озере Верхнем в США. Вес этих самородков составлял около 500 т.
Где добывают медь в России, мы выяснили. В основном это Забайкалье и Урал. В нашей стране, конечно же, также в разные времена находили очень крупные самородки этого металла. К примеру, медные куски весом до нескольких тонн часто находили на Среднем Урале. Один из таких самородков в 860 кг ныне храниться в Санкт-Петербурге, в музее Горного института.
Медные руды и их месторождения
На настоящий момент получать Cu считается экономически выгодным и целесообразным даже в том случае, если его содержится в породе хотя бы 0.3%.
Чаще всего для выделения меди промышленным способом в природе в наши дни добывают следующие породы:
-
борниты Cu5FeS4 — сульфидные руды, называемые по-другому медным пурпуром или пестрым колчеданом и содержащие около 63.3% Cu;
-
халькопириты CuFeS2 — минералы, имеющие гидротермальное происхождение;
-
халькозины Cu2S, содержащие более 75% меди;
-
куприты Cu2O, часто встречающиеся также и в местах залежей самородной меди;
-
малахиты, представляющие собой углекислую медную зелень.
Самое большое месторождение медных руд в России находится в Норильске. Также такие породы в больших количествах добывают в некоторых местах на Урале, в Забайкалье, на Чукотке, в Туве и на Кольском полуострове.
Как разрабатывают залежи медных руд
Разного рода породы, содержащие Cu, как и самородки, могут добываться на планете по двум основным технологиям:
-
закрытой;
-
открытой.
В первом случае на месторождении строятся шахты, протяженность которых может достигать нескольких километров. Для перемещения рабочих и техники такие подземные туннели оснащаются лифтами и железнодорожными путями. Дробление породы в шахтах производится с использованием специального бурового оборудования, имеющего шипы. Забор медной руды и ее погрузка для отправки наверх осуществляются с применением ковшей.
Если залежи находятся не далее 400-500 м от поверхности земли, их добыча ведется открытым методом. В этом случае на месторождении сначала снимается пласт верхней породы с использованием взрывных устройств. Далее постепенно вынимается собственно сама медная руда.
Способы получения металла из пород
Как добывают медь, а вернее, содержащие ее руды, мы, таким образом, выяснили. Но как же на предприятиях в последующем получают собственно сам Cu?
Основных способов выделения меди из горных пород существует три:
-
электролитический;
-
пирометаллургический;
-
гидрометаллургический.
Пирометаллургический флотационный метод
Эта технология обычно используется для выделения меди из тех пород, в которых Cu содержится 1.5-2%. Такой материал подвергают обогащению флотационным методом. При этом:
-
руду тщательно размалывают до самого мелкого порошка;
-
смешивают полученный материал с водой;
-
добавляют в массу специальные флотореагенты, представляющие собой сложные органические вещества.
Флотореагенты покрывают мелкие крупинки разных соединений меди и передают им несмачиваемость.
На следующем этапе:
-
в воду добавляют вещества, создающие пену;
-
пропускают через взвесь сильный поток воздуха.
Легкие сухие частички соединений меди в результате прилипают к воздушным пузырькам и всплывают наверх. Содержащую их пену собирают, отжимают от воды и тщательно просушивают. В результате и получают концентрат, из которого затем выделяют черновой Cu.
Как добывают медь из руды: обогащение методом обжига
Флотационный метод используется в промышленности достаточно часто. Но иногда для обогащения медной руды применяется и технология обжига. Такая методика чаще всего используется для руд, содержащих большое количество серы. В данном случае материал предварительно нагревается до температуры 700-8000 °С. В результате происходит окисление сульфидов с уменьшением в породе содержания серы.
На следующем этапе подготовленную таким образом руду расплавляют в шахтных печах при температуре в 14500 °С. В конечном итоге при использовании такой технологии получают штейн — сплав меди и железа. Далее это соединение улучшают путем обдувки в конвертерах. В результате оксид железа переходит в шлак, а сера — в SO4.
Получение чистой меди: электролиз
При использовании методов флотации и обжига получают черновую медь. Собственно Cu такой материал содержит около 91%. Чтобы получить более чистую медь, черновую в дальнейшем подвергают рафинированию.
В данном случае из первичной меди сначала отливают толстые пластины-аноды. Далее:
-
набирают в ванну раствор медного купороса;
-
подвешивают в ванной пластины-аноды;
-
в качестве катодов используют тонкие листы из чистой меди.
Во время реакции электролиза на анодах происходит растворение меди, а на катодах — осаждение. Ионы меди продвигаются к катоду, забирают у него электроны и переходят в атомы Cu+2+2e?>Cu.
Примеси, содержащиеся в черновой меди, при очистке могут вести себя по-разному. Цинк, кадмий, железо растворяются на аноде, но не оседают на катоде. Дело в том, что в ряду электрохимического напряжения они находятся левее меди, то есть имеют более отрицательные потенциалы.
Медный купорос получают медленным окислением сульфидной руды кислородом до сульфата меди CuS + 2O2 > CuSO4. В последующем соль выщелачивается водой.
Гидрометаллугический способ
В данном случае для выщелачивания и обогащения меди используется серная кислота. В результате реакции при применении такой технологии получают раствор, насыщенный Cu и другими металлами. Из него затем и выделяют медь. При использовании такой методики, помимо черновой меди, можно получать и другие металлы, включая драгоценные. В любом случае применяется эта технология чаще всего для выделения Cu из не слишком богатых на него пород (менее 0.5%).
Медь в домашних условиях
Выделение этого металла из насыщенных им руд — дело, таким образом, технологически относительно несложное. Некоторые поэтому интересуются тем, как добыть медь в домашних условиях. Получить этот металл из руды, глины и пр. своими руками, без наличия специального оборудования, будет, однако, очень сложно.
Некоторые, к примеру, интересуются тем, как добыть медь из глины своими руками. Ведь в природе существуют залежи этого материала, богатого в том числе и на Cu. Однако, к сожалению, известных проверенных технологий получения в домашних условиях меди из глины, не существует.
Своими руками этот металл дома можно попробовать выделить, пожалуй, только из медного купороса. Для этого последний нужно сначала растворить в воде. Далее в полученную смесь следует просто поместить какой-нибудь железный предмет. Через некоторое время последний – в результате реакции замещения – покроется медным налетом, который в дальнейшем можно будет просто счистить.
- Металлургия России
- О металлах
- Медь
- Нахождение в природе
Медь
Нахождение в природе
В земной коре содержание меди составляет около 5·10-3% по массе. Очень редко медь встречается в
самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко
распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди),
ковеллин CuS (64,4% меди), халькозин, или медный блеск, Cu2S (79,8% меди), борнит Cu5FeS4.(52-65% меди).
Существует также много и оксидных руд меди, например: куприт Cu2O, (81,8% меди), малахит CuCO3·Cu(OH)2
(57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей
страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург.
Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова. Именно он по указу
Петра I в 1704 начал чеканить медные деньги.
Богатые месторождения меди давно выработаны. Сегодня почти весь металл добывается из низкосортных руд, содержащих
не более 1% меди. Некоторые оксидные руды меди могут быть восстановлены непосредственно до металла нагреванием с
коксом. Однако большая часть меди производится из железосодержащих сульфидных руд, что требует более сложной
переработки. Эти руды сравнительно бедные, и экономический эффект при их эксплуатации может обеспечиваться
лишь ростом масштабов добычи.
Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо, цинк,
свинец, и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен,
теллур, галий, германий и другие), а также серебро, а иногда и золото.
В морской воде содержится примерно 1·10-8% меди. Медь энергично мигрирует как в горячих водах глубин,
так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды меди,
имеющие большое промышленное значение.
- Месторождения медных руд
- Природные соединения с содержанием меди
- Технологии производства меди
Медь, активно используемая практически во всех отраслях промышленности, добывается из различных руд, самой распространенной из которых является борнит. Популярность этой медной руды объясняется не только высоким содержанием меди в ее составе, но и значительными запасами борнита в недрах нашей планеты.
Самородная медь
Месторождения медных руд
Медные руды – это скопление минералов, в которых, кроме меди, содержатся и другие элементы, формирующие их свойства, в частности никель. К категории медных причисляют те типы руд, в которых данного металла содержится такое количество, чтобы его было экономически целесообразно извлекать промышленными методами. Таким условиям удовлетворяют руды, содержание меди в которых находится в пределах 0,5–1%. Наша планета располагает запасом медесодержащих ресурсов, основную часть из которых (90%) составляют медно-никелевые руды.
Большая часть запасов медных руд в России находится в Восточной Сибири, на Кольском полуострове, в Уральском регионе. В списке лидеров по суммарным запасам таких руд находится Чили, также разрабатываются месторождения в следующих странах: США (порфировые руды), Казахстане, Замбии, Польше, Канаде, Армении, Заире, Перу (порфировые руды), Конго, Узбекистане. Специалисты подсчитали, что в крупных месторождениях всех стран меди суммарно содержится порядка 680 миллионов тонн. Естественно, вопрос о том, как добывают медь в различных странах, необходимо рассматривать отдельно.
Ковеллин
Все месторождения медных руд делятся на несколько категорий, различающихся по генетическим и промышленно-геологическим характеристикам:
- стратиформная группа, представленная медными сланцами и песчаниками;
- руды колчеданного типа, к которым относятся самородная и жильная медь;
- гидротермальные, включающие руды, называемые медно-порфировыми;
- магматические, которые представлены наиболее распространенными рудами медно-никелевого типа;
- руды скарнового типа;
- карбонатовые, представленные рудами железомедного и карбонатитового типа.
В России добыча меди осуществляется преимущественно на месторождениях сланцевого и песчаного типа, в которых руда содержится в медноколчеданной, медно-никелевой и медно-порфировой формах.
Борнит
Природные соединения с содержанием меди
Чистая медь, которую собой представляют ее самородки, представлена в природе в очень незначительных количествах. В основном медь в природе присутствует в виде различных соединений, наиболее распространенными из которых являются следующие.
- Борнит – минерал, получивший свое название в честь ученого из Чехии И. Борна. Это сульфидная руда, химический состав которой характеризует ее формула – Cu5FeS4. Борнит имеет и другие названия: пестрый колчедан, медный пурпур. В природе эта руда представлена в двух полиморфных видах: низкотемпературной тетрагонально-скаленоэдрической (температура меньше 228 градусов) и высокотемпературной кубически-гексаоктаэдрической (больше 228 градусов). Данный минерал может иметь различные виды и в зависимости от своего происхождения. Так, экзогенный борнит – это вторичный ранний сульфид, который очень неустойчив и легко разрушается при выветривании. Второй тип – эндогенный борнит – характеризуется непостоянством химического состава, в котором могут присутствовать халькозин, галенит, сфалерит, пирит и халькопирит. Теоретически минералы данных видов могут включать в свой состав от 25,5% серы, более 11,2% железа и свыше 63,3% меди, но на практике такое содержание этих элементов никогда не выдерживается.
- Халькопирит – минерал, химический состав которого характеризуется формулой CuFeS2. Халькопирит, имеющий гидротермальное происхождение, раньше называли медным колчеданом. Наряду со сфалеритом и галенитом он входит в категорию полиметаллических руд. Данный минерал, который, кроме меди, содержит в своем составе железо и серу, формируется в результате протекания метаморфических процессов и может присутствовать в двух типах медных руд: контактово-метасоматического вида (скарны) и горные метасоматические (грейзены).
- Халькозин – сульфидная руда, химический состав которой характеризуется формулой Cu2S. Такая руда содержит в своем составе значительное количество меди (79,8%) и серу (20,2%). Эту руду часто называют «медным блеском», что объясняется тем, что ее поверхность выглядит как отблескивающий металл, обладающий различными оттенками – от свинцово-серого до совершенно черного. В медесодержащих рудах халькозин выглядит как плотные или мелкозернистые включения.
Халькопирит
В природе встречаются и более редкие минералы, которые содержат в своем составе медь.
- Куприт (Cu2O), относящийся к минералам оксидной группы, часто можно встретить в местах, где есть малахит и самородная медь.
- Ковеллин – сульфидная порода, сформированная метасоматическим путем. Впервые этот минерал, содержание меди в котором составляет 66,5%, был обнаружен в начале позапрошлого столетия в окрестностях Везувия. Сейчас ковеллин активно добывают на месторождениях в таких странах, как США, Сербия, Италия, Чили.
- Малахит – минерал, хорошо известный всем как поделочный камень. Наверняка все видели изделия из этого красивейшего минерала на фото или даже являются их обладателями. Малахит, который в России очень популярен, – это углекислая медная зелень или дигидрококскарбонат меди, относящийся к категории полиметаллических медесодержащих руд. Найденный малахит свидетельствует о том, что рядом есть месторождения других минералов, содержащих медь. В нашей стране крупное месторождение этого минерала находится в районе Нижнего Тагила, раньше его добывали и на Урале, но сейчас его запасы там значительно истощены и не разрабатываются.
- Азурит – минерал, который из-за своего синего цвета также называют «медной лазурью». Он характеризуется твердостью 3,5–4 единицы, основные его месторождения разрабатываются в Марокко, Намибии, Конго, Англии, Австралии, Франции и Греции. Азурит часто сращивается с малахитом и залегает в тех местах, где поблизости расположены месторождения медесодержащих руд сульфидного типа.
Малахит
Технологии производства меди
Чтобы извлечь медь из минералов и руд, о которых мы говорили выше, в современной промышленности применяются три технологии: гидрометаллургическая, пирометаллургичекая и электролиз. Пирометаллургичекая методика обогащения меди, которая является самой распространенной, в качестве сырья использует халькопирит. Данная технология предполагает выполнение нескольких последовательных операций. На первом этапе производится обогащение медной руды, для чего используется окислительный обжиг или флотация.
Метод флотации основывается на том, что пустая порода и ее части, в которых содержится медь, смачиваются по-разному. При помещении всей массы породы в ванну с жидким составом, в котором формируются воздушные пузырьки, та ее часть, которая содержит в своем составе минеральные элементы, транспортируется этими пузырьками на поверхность, прилипая к ним. В итоге на поверхности ванны собирается концентрат – черновая медь, в котором данного металла содержится от 10 до 35%. Именно из такого порошкообразного концентрата и происходит дальнейшее получение чистой меди.
Несколько иначе выглядит окислительный обжиг, с помощью которого обогащают медные руды, содержащие в своем составе значительное количество серы. Данная технология предусматривает нагрев руды до температуры 700–8000, в результате которого сульфиды окисляются и содержание серы в медной руде уменьшается практически в два раза. После такого обжига обогащенную руду расплавляют в отражательных или шахтных печах при температуре 14500, в результате чего получают штейн – сплав, состоящий из сульфидов меди и железа.
Разлив меди по формам
Свойства полученного штейна следует улучшить, для этого его обдувают в горизонтальных конвертерах без подачи дополнительного топлива. В результате такого бокового обдува железо и сульфиды окисляются, оксид железа переводят в шлак, а серу – в SO2.
Черновая медь, которая получается в результате такого процесса, содержит до 91% данного металла. Чтобы сделать металл еще чище, необходимо выполнить рафинирование меди, для чего из него необходимо удалить посторонние примеси. Это достигается при помощи технологии огневого рафинирования и подкисленного раствора медного купороса. Такое рафинирование меди называют электролитическим, оно позволяет получить металл с чистотой 99,9%.
Существует еще и гидрометаллургический способ обогащения меди, который подразумевает выщелачивание металла при помощи серной кислоты. В результате такого выщелачивания получают раствор, из которого затем и выделяют медь и другие металлы, в том числе и драгоценные. Данная технология применяется для обогащения руд, которые характеризуются очень незначительным содержанием меди в своем составе.
14 ноября 2020 г.
Блестящий металл розового цвета, обладающий высокой пластичностью – вот что такое медь. Минерал отличается высокой электро- и теплопроводностью, хорошо поддаётся механической обработке и образует множество соединений с другими металлами, достаточно широко востребованными в хозяйственной деятельности человека. Кроме того, медь отличается высокой коррозионной стойкостью.
Содержание
- Разновидности медных руд
- Природные минералы, содержащие медь
- Добыча медной руды
- В карьере
- В шахтах
- Бурение скважин
- Получение меди
- Пирометаллургический метод
- Гидрометаллургический метод
- Электролизный метод
- Области применения
- Месторождения в России и мире
- Мировые запасы
- Страны, добывающие медь
Её плотность составляет – 8890 кг/м3.
Температура плавления равняется 10830C.
Разновидности медных руд
Существует девять геологических видов медных руд, имеющих промышленное значение:
- Железно-никелевые руды, залегающие в магматических горных породах.
- Медистые песчаники и сланцы. Стратиформные запасы составляют 30% запасов меди и поэтому занимают второе место в данном списке.
- Медно-никелевые. Залежи отличаются разнообразием форм с крупными вкраплениями искомого металла.
- Медно-порфировые. Они являются безусловными лидером и обеспечивают 40% мировой добычи меди.
- Карбонатитовые. Уникальны тем, что имеется всего лишь одно месторождение в мире, кроме того в их составе присутствуют щелочные соединения.
- Кварцево-сульфидные. Существенной роли в обеспечении добычи не играют.
- Самородные. Располагаются в местах окисления рудников медно-сульфидных руд.
- Скарновые. Размещаются среди известняков и отличаются крайней неоднородностью морфологической структуры.
Медь в перечисленном списке руд бывает представлена в сульфидной, оксидной или смешанной форме, что определяет соответствующие разновидности залежей. По виду своего строения в породах залежи подразделяются на вкраплённые, массивные и сплошные текстуры. В ближайшей перспективе этот список могут пополнить руды, залегающие на дне морей, океанов, а также конкреции урановых месторождений.
Природные минералы, содержащие медь
В природе существую 250 медесодержащих минералов, однако практическое использование находят не более 20. Список самых распространённых из них с указанием процентного содержания меди:
- Самородная медь – 88-100%.
- Куприт – 88,8%.
- Тенорит – 79,9%.
- Хальзокин – 79,8%.
- Ковеллин – 66,5%.
- Борнит – 52-65%
- Атакамит – 59,5%.
- Малахит – 57,4%.
- Брошантит – 56,2%.
- Азурит – 55,3%.
- Блеклые руды – 22-53%.
- Энаргит – 48,3%.
- Хризоколла – 32,8-40,3%.
- Халькопирит – 34,5%.
- Кубанит – 22-24%.
Добыча медной руды
Медь – один из самых первых металлов, освоенных человечеством. В самом начале его добывали, собирая самородки, а затем научились извлекать из руд. С годами технологии добычи полезных ископаемых совершенствовались. Но определяющим фактором при выборе способа добычи, всегда являлась и является глубина расположения залежей. Впрочем, существуют специально разработанные стандарты, учитывающие множество факторов и позволяющие выбрать наиболее удачное с экономической точки зрения решение, в плане выбора рабочей глубины разработки и применяемых технологий.
В карьере
В случае размещения пласта осваиваемого минерала на глубине не более 500 м, наиболее целесообразным является открытый способ добычи. Именно с его помощью извлекается большая часть медных руд. Несмотря на ряд проблем, связанных с освоением значительной площади, перемещением огромных масс пустой породы, привлечением значительного количества технических средств и вредным воздействием на окружающую среду, способ отличается достаточно высокой эффективностью и отсутствием значительных потерь полезного ископаемого. Соотношение выхода металла на добываемую руду составляет: 1:200.
Проведя предварительные геологические исследования в месте будущего карьера или разреза, производится съём и удаление в отвалы верхних слоёв породы. Очень часто это сопровождается бурением твёрдых скальных массивов и взрывными работами. Ископаемый минерал извлекается слоями с дальнейшей разработкой новых массивов. Руда забирается ковшевой техникой (экскаваторами, погрузчиками) и грузится в транспортные средства (конвейера, самосвалы) для перевозки на перерабатывающие предприятия.
В шахтах
Если искомая руда располагается на глубине порядка 1 км, то в дело идёт закрытый способ добычи, то есть – строительство шахты и организация вертикальных, наклонных или горизонтальных выработок. Используя горнопроходческую технику и буровое оборудование, разрабатываются медесодержащие слои. После чего добытая порода загружается и извлекается на поверхность. Для этого подземные сооружения оснащаются лифтами, подъёмным оборудованием, железнодорожными путями.
Медь
Способ достаточно затратный, но в то же время обеспечивающий доступ к глубокозалегающим месторождениям.
Бурение скважин
Существует и третий метод добычи медных руд – с помощью закачки выщелачивающих растворов кислот и щелочей вглубь заранее пробуренной скважины. В результате чего получается полужидкая смесь, извлекаемая на поверхность мощными насосами, подвергаемая в дальнейшем переработке.
Получение меди
После добычи руды возникает следующая проблема: как извлечь из неё необходимый материал? Существует несколько способов.
Одна из древнейших технологий заключалась в сжигании малахитовых руд с ограниченным доступом воздуха. Размещённая в горшках масса, смешанная с углём, сгорала, выделяя при этом угарный газ. Что приводило к достижению желаемого результата – получению достаточно чистой для своего времени меди.
Понятно, что за прошедшие века методы и способы переработки руд претерпевали серьёзные изменения движимые целью достижения наиболее оптимальных результатов при любом виде первичного сырья. Вот почему современная металлургия базируется на трёх основных способах получения меди.
Пирометаллургический метод
Основанный на проведении высокотемпературных процессов, пирометаллургический метод как нельзя лучше подходит для сульфидных руд, подчас достаточно бедных в отношении концентрации меди. Он позволяет извлекать металл даже при содержании его в 0,5%.
Но прежде всего исходное сырьё подвергается обогащению в процессе флотации. Суть его заключается в тщательном измельчении руды, заливке её водой, добавлении туда сложных органических флотореагентов. Они обволакивают частицы минерала, содержащие в своём составе сплавы меди, придавая им несмачиваемость.
На втором этапе этого процесса в растворе создаётся пена, пузырьки которой забирают покрытые органикой частицы. Происходит это под воздействием потока воздуха, в результате чего образования всплывают на поверхность, откуда в дальнейшем забираются. Насыщенная медными соединениями пена собирается, отжимается и высушивается.
После чего полученный концентрат подвергают обжигу при температуре 14000 C. Это необходимо для удаления серы и окисления сульфидов. Затем производят высокотемпературную (14 0000 – 15 0000C) плавку в шахтных печах для получения сплава железа и меди – штейна. Далее в процессе бессемеровской плавки в конвертере под воздействием кислорода получают оксид, а затем и саму черновую медь, содержащую в себе 90,95% металла. При этом сера переходит в кислотный остаток, а железо – в силикатный шлак.
Получить из черновой субстанции чистую медь можно с помощью:
- огневого рафинирования,
- электролиза,
- экзотермической реакции восстановления под воздействием водорода.
Гидрометаллургический метод
Для извлечения меди и ряда других металлов из полиметаллических руд, содержащих в своём составе менее 0,5% искомого минерала, применяют гидрометаллургический метод.
Добытые минералы растворяют с помощью неконцентрированной серной кислоты или аммиака. Из образовавшихся жидкостей в процессе реакции вытеснения получают медь. Для проведения реакции используется металлическое железо.
Электролизный метод
Метод предназначен для получения чистой меди в процессе электролитической реакции.
Его технология заключается в изготовлении чистых медных тонких листовых катодов и толстых пластинчатых анодов из черновой меди. Помещённые затем в ванну, заполненную медным купоросом, они вступают в реакцию под воздействием электрического тока. Происходит растворение меди на анодах и её осаждение на катодах. Освободившиеся примеси удаляют химическими методами.
Медные трубы
Области применения
Отраслей, где находит своё применение этот древнейший из металлов, множество:
- Металлургия. Именно эта отрасль выпускает множество готовых изделий в виде
- проката: листов, плит, лент, труб, прутков, шин, проволоки;
- сплавов: бронзы, латуни, мельхиора, константана, манганина нейзельбера.
Те и другие изделия, и промежуточные материалы находят широкое применение в технических отраслях, при производстве вооружений, в декоративно-прикладном искусстве. Отличительными особенностями сплавов являются – сохранение механических свойств, высокий уровень скольжения в парном сочетании и антикоррозийная устойчивость.
- Машиностроение. Здесь используется значительная часть медесодержащей продукции, полученной в результате металлургических процессов. Это – высокопрочные сплавы с алюминием, оловом, кремнием, цинком. А также разнообразные детали машин и механизмов. Одним из направлений является изготовление твёрдых припоев, опять же находящих применение в машиностроительной отрасли.
- Химия. Катализатором процесса полимеризации ацетилена выступает опять же медь.
- Электротехника. Благодаря высокой электрической проводимости, этот металл стал незаменим в качестве проводника при изготовлении шин, кабелей, проводов, дорожек печатных плат. Они, в свою очередь, входят в состав множества электротехнических изделий, где также присутствуют медные элементы конструкций и сплавы данного металла. Кроме того, медь находит использование в химических источниках тока и при изготовлении высокотемпературных сверхпроводящих материалов.
- Энергетика. Одним из важных направлений использования меди является изготовление на её основе труб, являющихся составной частью систем газоснабжения, водоснабжения, отопления, охлаждения, кондиционирования и обеспечения технологическими жидкостями.
- Ювелирное дело. Специфика изготовления драгоценных изделий, служащих в качестве украшений, требует сочетания целого ряда противоречивых факторов. Чтобы придать прочность золоту, в него добавляют медь. Податливость материала не уменьшается, а срок службы и устойчивость к механическим воздействиям – существенно возрастают.
Месторождения в России и мире
На территории России существует немало достаточно крупных месторождений медных руд:
- Аллареченское, Мончегорское, Печенга – Мурманская область.
- Гайское – Оренбургская область.
- Михеевское, Томинское – Челябинская область
- Юбилейный, Сибайское, Подольское, Западно-Озёрное, Учалинское, Ново-Учалинское, Октябрьское – Республика Башкортостан.
- Быстринское и Удоканское – Забайкалье.
- Октябрьское, Талнахское – Красноярский край.
На карте мира выделяются следующие месторождения этого полезного ископаемого:
- Чукикамата, Эскондида, Кольяуаси, Антамина, Эль-Тесоро – Чили.
- Бингем-Каньон, Кивино, Пэблл – США.
- Вале-Салобу – Бразилия.
- Нурказган – Казахстан.
- Ую-Толгой – Монголия.
- Гразберг – Индонезия.
Мировые запасы
Запасы меди по странам мира на 2018 год оценивались такими цифрами:
- Чили – 170 млн. тонн.
- Австралия – 88 млн. тонн.
- Перу – 83 млн. тонн.
- Россия – 61 млн. тонн.
- Индонезия – 51 млн. тонн.
- Мексика – 50 млн. тонн.
- США – 48 млн. тонн.
- Китай – 26 млн. тонн.
- Конго – 20 млн. тонн.
- Замбия – 19 млн. тонн.
- Остальные страны мира – 210 млн. тонн.
Страны, добывающие медь
Лидирующие позиции в мировой добыче меди (данные 2018 года в количественном выражении добытого металла за год) занимают:
- Чили – 5,8 млн. тонн.
- Перу – 2,4 млн. тонн.
- Китай – 1,6 млн. тонн.
- США – 1,2 млн. тонн.
- Конго – 1,2 млн. тонн.
Судя по оценкам специалистов, общий объём, пока что неизведанных, запасов меди в мире составляет 3,5 млрд. тонн. Этих запасов должно хватить на ближайшие полтора столетия.























![{displaystyle {mathsf {2Cu+4HCllongrightarrow 2H[CuCl_{2}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc80bfb324a1e02cf0b53b9c94e705f56502ee4d)



![{displaystyle {mathsf {2Cu+4HBrlongrightarrow 2H[CuBr_{2}]+H_{2}uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7373466ccce8c6974185a4abacefcc674e93c182)
![{displaystyle {mathsf {2Cu+4CH_{3}COOH+O_{2}longrightarrow [Cu_{2}(H_{2}O)_{2}(CH_{3}COO)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47bacd6a149917fc6fe5885a580c74c071f19740)
![{displaystyle {mathsf {Cu{xrightarrow {NH_{3}cdot H_{2}O,O_{2}}} [Cu(NH_{3})_{2}]OHrightleftarrows [Cu(NH_{3})_{4}](OH)_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ca473ceb7ed8112750921d3d76541491d1a677f)












![{displaystyle {mathsf {6Cu+12HCl+KClO_{3}longrightarrow 6H[CuCl_{2}]+KCl+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0994311aa4eef96edcd63c1259c77c51809bc10f)


![{mathsf {CuCl+Cl^{-}rightarrow [CuCl_{2}]^{-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1ceabd1dd09bb6c906acfc0c1402152bc9397dc5)







![{displaystyle {mathsf {Cu_{2}O+H_{2}O+2OH^{-}rightarrow 2[Cu(OH)_{2}]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a430cfe578b461e180747ede4c914f33a5cabdd)
![{displaystyle {mathsf {Cu_{2}O+4HClrightarrow 2H[CuCl_{2}]+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/715be4ff1fca9d74ba5e493d98ace7d3f48e29f7)







![{displaystyle {mathsf {Cu_{2}O+4NH_{3}*H_{2}Orightarrow 2[Cu(NH_{3})_{2}]OH+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/548b74f8b392e28195be9fc87bfa64841d8cc01f)









![{displaystyle {mathsf {CuOH+2HClrightarrow H[CuCl_{2}]+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/474dc6a48557501f79a4cecaff166f7c974fabd7)

![{displaystyle {mathsf {CuOH+KOHrightarrow K[Cu(OH)_{2}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ed9d4f544a32bcf9e645df7591a57fc73920bf4)

_{2}+3H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36286b47fa9ba62b37c8364e6023ec740c51bd57)
_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c1ed7d230399e8c8b8e12ecd9c204088de28256)
![{displaystyle {mathsf {CuO+2OH^{-}+H_{2}Orightarrow [Cu(OH)_{4}]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5bb22fdc359202f84eba1ebb7b0951d89d62205e)











![{displaystyle {mathsf {Cu(OH)_{2}+OH^{-}rightarrow [Cu(OH)_{4}]^{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e7f18f070006cc92b43e0c75bd9adc48d4073fe)




_{2}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c30733175565c1ab55b2ef726ab9ec93e307d19)
_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45b3a8d1afd2d4b774591cb499e305f3a0ff7b30)