Содержание
- Определение металла по его эквивалентной массе
- Калькулятор металлопроката
- Почему лучше использовать калькулятор расчета металла
- Преимущества калькулятора по металлу
- Какие изделия может рассчитать калькулятор металлопроката
- Калькулятор металла
- Вычисляем массу металла по размерам — способы и формулы
- Как это сделать
- По справочникам
- По калькулятору
- Расчет веса по математическим формулам
- Листовой прокат
- Пруток, проволока и арматура
- Шестигранный пруток
- Прямоугольный профиль
- Масса круглой трубы
- Вес фигурных изделий
Для определения металла по его эквивалентной массе используют прибор, изображенный на рис. 1.
Перед началом опыта прибор, закрепленный в штативе (5), испытывают на герметичность. Для этого поднимают воронку (3) на некоторую высоту, при этом уровень воды в бюретке (2) должен фиксироваться на определенном уровне. Если прибор герметичен, можно приступить к выполнению опыта.
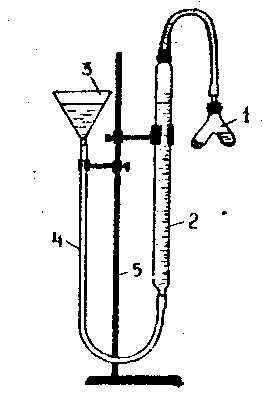
Рис. 1. Прибор для определения эквивалентной массы металла
В один отросток пробирки Оствальда (1) помещают навеску металла (известной массы и валентности). В другой отросток аккуратно наливают 3-4 мл кислоты. Осторожно соединяют пробирку Оствальда с бюреткой, плотно закрывают пробкой и проверяют герметичность прибора, как указано выше. Записывают начальный уровень воды в бюретке а1. Отсчет делают по нижнему мениску с точностью до 0,1 мл. Наклонив пробирку Оствальда, приливают кислоту к навеске металла. Наблюдают выделение водорода и вытеснение воды из бюретки.
После окончания реакции дают пробирке остыть, чтобы газ в приборе принял комнатную температуру. Приводят воду в бюретке и воронке, соединенной резиновой трубкой (4), до одинакового уровня опусканием воронки, то есть, сбрасывают гидростатическое давление. Записывают уровень воды в бюретке а2.
Вычисления:
Определяют объем выделившегося водорода: 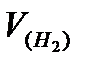 : = а2 — а1 (мл).
: = а2 — а1 (мл).
Определяют парциальное давление водорода: 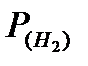 = Ратм – Р(
= Ратм – Р( 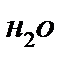 ) (мм рт ст.), где Р(
) (мм рт ст.), где Р( 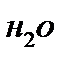 )— давление пара воды при данной температуре (табличные данные).
)— давление пара воды при данной температуре (табличные данные).
Определяют температуру: Т = 273 + t 0 C. Приводят объем водорода к нормальным условиям, пользуясь объединенным газовым законом:
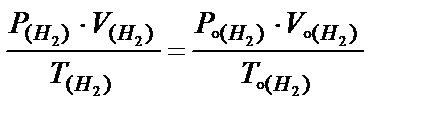 Þ
Þ 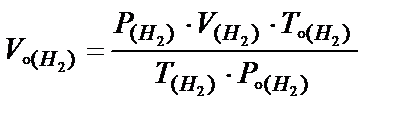 ;
; 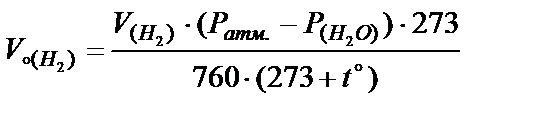 .
.
Вычисляют эквивалентную массу металла по закону эквивалентов:
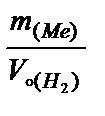 =
= 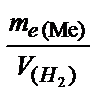 Þ
Þ 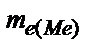 =
= 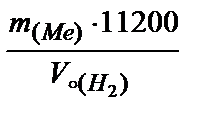 .
.
По валентности металла (В) рассчитывают атомную массу металла: А(Ме) = mэ(Ме)×В .
Используя периодическую систему элементов Д.И. Менделеева, рассчитывают теоретическое значение эквивалентной массы данного металла и вычисляют относительную погрешность эксперимента: 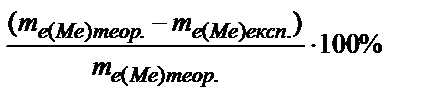 .
.
В выводах укажите:
— Навеску какого металла Вы исследовали?
— Какие факторы влияют на величину ошибки эксперимента?
Источник
К металлопрокату относится вся продукция, которая прошла горячий или холодный прокат на специальных станках. На сегодняшний день существует много видов с различными характеристиками. Запомнить плотность каждого металла и сплава невозможно. Поэтому и рассчитать тоннажность крайне сложно. Для этого используйте калькулятор металла на нашем сайте. Он быстро произведет расчеты исходя из особенностей изделия.
Почему лучше использовать калькулятор расчета металла
Металлопрокат используется повсеместно: в строительстве, ЖКХ и т.д. Часто требуется его транспортировка. Однако машины имеют определенную грузоподъемность, превышение которой недопустимо. Тут встает вопрос, как узнать тоннажность металла, если его нельзя разместить на весах из-за большого объема? Данный расчет выполняет специальный калькулятор, разработанный так, что способен учесть все особенности металлопроката, включая нестандартную форму.
Не рассчитав вес металлопроката вы рискуете переплатить за доставку груза. Если вызовете фуру, которая будет слишком большой для транспортировки, то вы однозначно переплатите. Стоимость доставки будет высокой. При решении сэкономить, рискуете оформить машину с меньшей грузоподъемностью. В результате вам придется либо заказывать еще один грузовик, либо оформлять более большой грузовой транспорт. Результат будет аналогичным — переплата и потеря времени.
Раньше люди самостоятельно занимались расчетом массы определенного количества металлопроката. Однако они были крайне сложными и часто приводили к ошибкам. С популяризацией интернета, рассчитать вес металлопроката не составит труда.
Раньше было необходимо листать огромное количество таблиц, чтобы найти необходимый размер среди сортамента. Калькулятор же содержит все размеры для различных типов изделий, предусмотренных ГОСТ. Для нестандартных изделий и металлов, калькулятор автоматически вычеслит объем изделия и определит его вес в соответствии с плотностью выбранного металла (стали, меди, алюминия и других).
Какие изделия может рассчитать калькулятор металлопроката
На калькуляторе можно рассчитать вес следующих изделий:
- Арматура
- Плоский прокат: листы, ленты.
- Круглые и профильные трубы.
- Шестигранники, квадраты, круги.
- Уголки, швеллеры, двутавры.
Источник
Ваш браузер не поддерживает Java Sript необходимый для работы калькулятора.

 |
Универсальный металлический калькулятор веса стали от нашего металлического портала позволяет быстро и точно рассчитать вес металлопроката конкретных марок. В нашем металлокалькуляторе можно рассчитать вес стали, чугуна, алюминия, латуни, бронзы, меди, магния, титана, никеля, цинка, а также самых различных сплавов на основе этих и других металлов. В перечне ассортимента проката, который считает наш металлокалькулятор присутствует труба, уголок, лист, лента, круг, проволока, швеллер, балка, шестигранник, профильная труба, а также с условной точностью можно подсчитать арматуру. Также наш портал предлагает всем сайтам металлической тематики малый калькулятор-информер для установки на Вашем сайте, такой калькулятор практически ничем не отличается от большого, но имеет значительно меньшие размеры и в силу этого его можно легко установить на любое место в левую или правую панель вашего сайта, либо как самостоятельную страницу сайта. Если Калькулятор не работает, достаточно нажать F5 или Ctrl+F5, или почистить кэш временных файлов Вашего браузера Internet либо необходимо включить поддержку Java Script в браузере. О калькуляторе металла подробно (развернуть/свернуть описание) |
Подсчет можно производить для установления веса проката — в этом случае вводятся размеры и длина металла, а также для установления длины проката — в этом случае вводится вес и размеры.
Металлический калькулятор работает в онлайн-режиме и совершенно бесплатен для использования. Для расчета веса стали для конкретного проката, или веса цветного металла, необходимо:
— выбрать необходимый металл и марку вверху калькулятора
— нажать кнопку с изображением проката, вес или длину которого нужно подсчитать
— ввести в поля соответствующие размерности сторон проката в миллиметрах, при этом переходить от поля к полю можно нажимая кнопки на клавиатуре вверх и вниз.
Специалисты портала постоянно обновляют ассортимент марок, которые рассчитываются на нашем калькуляторе, и в случае, если на вашем сайте установлен информер-калькулятор от нашего портала, Вы можете обратиться с предложением, добавить ту или иную нужную вам марку (единственное исключение, если эта марка редкая и невостребованная), мы обязательно добавим марку металла в калькулятор. .
При расчете веса проката на металлокалькуляторе, используется удельный вес этой марки или чистого металла если конкретная марка не выбрана. Расчет производится следующим образом: на основании удельного веса стали или металла, а также размеров проката (ширина, толщина, диаметр, толщина стенки и т.д.) высчитывается вес 1 мм длины проката и умножается на длину проката — если высчитывается вес на основании длины. Если же расчитывается длина на основании веса, то сначала также высчитывается площадь сечения проката, затем умножается на удельный вес, затем вес проката делится на полученное значение и таким образом получается искомая длина по весу.
Следует отметить, что расчет удельного веса на основании известной плотности марки стали или цветного металла является важным элементом расчета веса проката, и существенно зависит от температуры проката, так как например сталь 10 при температуре 20 °С имеет плотность 7856 кг/м 3 , а при 900 °С всего 7594 кг/м 3 . В нашем онлайн калькуляторе металла для большинства марок используется удельный вес и плотность марок металлов при 20 °С.
Реальный прокат всегда производится с небольшими отклонениями от точных геометрических размеров и при больших партиях это может привести к заметным отклонениям веса, такие моменты нужно учитывать после расчета, так наш металлокалькулятор онлайн расчитывает исходя из точных геометрических размеров, но реальный вес проката будет немного отличаться.
Что лучше — металлический калькулятор онлайн или калькуляторы-программы устанавливаемые на компьютер, существует несколько точек зрения, отметим плюсы программ работающих на портале через интернет — на сайте постоянно калькулятор пополняется свежими марками сталей и цветных металлов, появляются новые функции для расчета, повышается точность и удобство работы.
Расчет массы изделий трубного проката: производится следующим образом, известно, что трубы производятся несколькими способами — методом электросварки из рулонов или листов, штрипсов, также алюминиевые трубы и другие выпускают методом деформирования из заготовки. Конечно, при сварке добавляется в массу сечение сварного шва прямого или спирального типа, но поскольку он невелик по сравнению с площадью сечения самой трубы, то сечение валика шва можно не учитывать при расчете на металлическом калькуляторе веса труб. Таким образом, зная внешний диаметр трубы и толщину стенки можно высчитать площадь поверхности сечения трубы, затем умножив ее на длину трубы, получим общий объем и остается умножить его на удельный вес марки стали или цветного металла, чтобы получить искомый вес партиии трубного металлопроката. Часто при продаже или покупке б/у труб неизвестна марка из которой была изготовлена труба — в этом случае можно использовать марки Ст3сп, сталь 10, 20 и подобные конструкционные, поскольку большинство труб делается из них. В случае если есть подозрения, что трубы из легированного сплава лучше произвести химический анализ металла трубы.
Вес листового или рулонного проката: в основе этого расчета также лежит удельный вес стали или цветных металлов и габаритные размеры металла, при этом наш металлический калькулятор получает толщину и ширину листа или рулона и на основе этих даных выводит площадь сечения листа, далее высчитывается вес одного метра длины листа и умножается на количество и длину этого листа. в случае если наоборот нужно по весу посчитать длину рулона, то калькулятор металла делит массу на вес метра листа и таким образом мы получаем искомую длину листа или рулона.
Подсчет параметров балок: снабженцам металлообрабатывающих и торгующих организаций часто приходится расчитывать вес балок. Поскольку в настоящее время часто используются сварные балки вместо горячекатанных, то в этом случае вес балки подсчитанный на металлокалькуляторе онлайн нашего портала будет несколько меньше фактического, поскольку к профилю балки добавиться незначительный валик сварного шва, однако это прибавление крайне незначительно и его можно не учитывать. При расчете балок используется больше параметров чем в других видах металлопроката, так как существует большое разнообразие балочной продукции. В основном это двутавровые широкополосные и обычные балки.
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Источник
При составлении сметы строительства или демонтажа металлоконструкций, покупке металлопроката или подготовке металлолома к сдаче, для найма подъемных механизмов бывает необходимо вычислить массу и количество металла, вес лома.
Как это сделать
Для получения необходимой информации можно обратиться к справочникам, и они рассчитают теоретический вес. Второй вариант – воспользоваться помощью калькулятора расчета веса металла по размерам. Если нет под рукой Интернета, есть простой выход – использовать школьные формулы вычисления массы по объему и плотности.
По справочникам
Сборник справочных материалов содержит таблицы металлов, по которым легко определить вес металлопроката любого вида, из черного и цветного металлов или сплавов. Кроме этого, в сборнике приведены формулы, чтобы посчитать вес металла по размерам для заготовок различных конфигураций, данные по удельному весу металлов.
К справочнику приходится обращаться при самостоятельном произведении математических расчетов, например, к таблице плотности металлов. Чтобы вычислить массу детали из цветного металла, понадобится переводной коэффициент.
С готовой таблицей легко самостоятельно рассчитать вес листа металла. По данной толщине и марке стали находится теоретический вес 1 м 2 , искомая величина умножается на площадь листа. Особенно это удобно для стали с рифлением, выступами, цинковым напылением, учитывается также способ прокатки (холодный или горячий).
Упрощается просчет массы швеллера и двутавра – изделий со сложным сечением. Для них есть таблица с указанием номера профиля и соответствующего веса 1 пог. м в кг. Не нужно заморачиваться, чтобы вычислить вес стальной арматуры, к тому же в таблице указано количество погонных метров в 1 т.
Аналогичные таблицы существуют для металлических профилей Г-образного сечения: указан вес 1 м уголка для конкретной толщины и ширины полки. Правда, такие расчеты отличаются от фактического веса, так как таблицы составлены на основе ГОСТа. В реальности же прокат не всегда соответствует государственным стандартам.
Плотность стали зависит от температурных показателей. Все табличные данные соответствуют температуре 20°C. Данное замечание не относится к цветному прокату.
По калькулятору
Посчитать вес металла можно онлайн либо скачать калькулятор на компьютер (смартфон). Это удобный вид расчета, потому что не нужно перелистывать справочники в поисках нужных таблиц – достаточно задать конкретные параметры. С помощью калькулятора определяют вес железа любой марки и конфигурации с точностью до сотых долей:
- арматуры, прутков;
- листового проката;
- шестигранников, кругов, квадратов;
- труб;
- плит;
- уголков, швеллеров, двутавров.
Существуют также калькуляторы для цветного проката и для определения объемного веса металла, который важно знать для грузоперевозок.
Алгоритм работы с калькулятором простой:
- Выбирается тип проката, вид изделия и марка металла.
- Заносятся результаты замеров.
- Нажимается кнопка «Посчитать».

Особенно удобна калькуляция для изделий с нестандартной и сложной формой. Кроме того, можно определять метраж изделия по его весу, т.е. переводить килограммы в метры.
Расчет веса по математическим формулам
Вес любого изделия находится так: M = ρV (ρ – плотность, V – объем изделия) или по формуле массы через площадь сечения: M = ρSL (S — площадь сечения, L — длина). Для углеродистой стали принято использовать усредненное значение ρ, равное 7850 кг/м 3 или 0,00785 г/мм 3 , либо 7,85 г/см 3 (в зависимости от выбранных единиц измерений). Самое простое вычисление – это масса стального куба со стороной 1 м. Она равна 7850 кг, или 7,85 т.
Различают практические и теоретические формулы массы. Первые адаптированы к определенным условиям, чтобы облегчить и ускорить расчеты.
Листовой прокат
Для расчета веса листового металла нужно перемножить 3 измерения – длину, ширину и толщину изделия, полученный результат умножить на плотность металла. Например: длина проката 1 м, ширина – 2 м, толщина – 2мм, тогда M = 1×2×0,002×7850 = 31,4 (кг).
При определении массы нескольких одинаковых листов железа, достаточно рассчитать вес 1 листа и умножить на количество.
Пруток, проволока и арматура
Для определения массы прутка или любого изделия круглого сечения, используется такая теоретическая формула: M= πR 2 Lρ, где L – длина, R – радиус заготовки, π = 3,14, ρ – плотность металла. Другая, практическая, формула: M = (0,02466R 2 )L. Ее можно использовать и для рифленой арматуры.
Из объема найти массу прямоугольного прутка совсем просто. Нужно перемножить длину, ширину и толщину (это объём V), затем найти в справочнике соответствующую плотность и умножить ее на V: M = ABLρ, где A, B – ширина и толщина.
Чтобы найти вес металлического круга, нужно подставить числовые значения в формулу: M = πR 2 dρ (R– радиус, d – толщина).
Шестигранный пруток
Лучше всего обратиться за помощью к готовым таблицам, но в их отсутствии расчеты можно произвести самостоятельно:
M = (3√3/2)а 2 Lρ,
где а – длина стороны шестигранника (мм), L – длина прутка (мм), ρ = 0,00785 г/мм 3 .
Прямоугольный профиль
Узнать массу прямоугольной профильной трубы можно так:
M = 2(a+b)sLρ,
где a и b – ширина и высота сечения (мм), s – толщина стенки (мм), L – длина трубы (мм), ρ = 0,00785 г/мм 3 . Если стенки разной толщины, проводится несколько измерений и находится среднее значение.
Масса круглой трубы
Рассчитывают вес трубы по следующим формулам:
M = π(R 2 – r 2 )Lρ, M = 2πRsLρ, M = (D-s)s×0,2466
где М – масса, R 2 – внешний радиус, r 2 – внутренний радиус, L – длина трубы, ρ. – плотность стали, s – толщина стенки, 0,2466 – константа, соответствующая плотности углеродистой стали ρ = 7,85 г/см 3 .
Трубу с закрытым концом можно рассматривать как бочку и применить для нахождения ее веса представленные выше формулы для трубы и круга.
Вес фигурных изделий
Посчитать массу, зная объем и плотность, можно для изделий любой конфигурации. Нужно только правильно вычислить объем и подставить значение в известную формулу M = Vρ.
Объем пирамиды рассчитывается по формуле: V = 1/3 SH, где S – площадь основания, H – высота пирамиды.
Для усеченной пирамиды V = 1/3 h(F + f + √Ff), где F и f – площади большего и меньшего основания.
Объем цилиндра: V = πR 2 H.
Объем конуса: V = 1/3 πR 2 H, объем усеченного конуса: V = 1/3 πH(R 2 + Rr + r 2 ), где H – высота, R и r – радиусы большего и меньшего основания.
Объем шара: V = πD 3 /6 (D – диаметр).
Для уголка: V = s(h1 + h2)L, где L – длина уголка, s – толщина металла, h1 и h2 – ширина полок.
Объем изделия витиеватой формы и небольших габаритов находят по количеству вытесненной жидкости, поместив его в емкость с водой.
Если конструкция изготовлена из разных металлов и сплавов, тогда можно найти ее массу через вес отдельных деталей.
Теоретический вес рассчитывается по формулам, практический (фактический) определяется взвешиванием. Естественно, что всегда между этими величинами будет несоответствие. Расчет массы заготовки, произведенный самостоятельно по математическим формулам, также может отличаться от табличных или же выданных калькулятором.
Для получения более точных результатов целесообразно пользоваться данными справочников или электронных вычислительных устройств.
Источник
Adblock
detector
1
При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2
В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д.И. Менделеева по обозначение элемента).
3
Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4
Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5
Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
Содержание:
- Металлы и сплавы
- Общая характеристика металлов
- Химические свойства металлов
- Взаимодействие с неметаллами
- Взаимодействие с водой
- Взаимодействие с растворами солей
- Взаимодействие с кислотами
- Получение металлов
- Способы получения
- Сплавы металлов
- Решение задач на вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего определенную массовую долю примесей
- Свойства металлов и сплавов
- Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников
- Кристаллическое строение металлов
- Добывание металлов из руд
- Получение металлов высокой чистоты
- Перегонка в вакууме
- Термическое разложение летучих соединений металла. Карбонильный процесс
- Сплавы
- Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов
- Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии
- Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии
- Диаграмма состояния для сплавов, образующих химические соединения
- Коррозия металлов
Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов. Сплавы состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплав легирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Металлы и сплавы
Сплавы металлов – твердые соединения двух или более металлов (и неметаллов), полученные целенаправленно в процессе металлургического производства
Общая характеристика металлов
Металлы и их сплавы были известны человечеству с давних пор (рис. 27).
Все химические элементы, как уже известно, подразделяются на металлы и неметаллы. Большинство химических элементов (более 90) относятся к металлам.
Металлами называют вещества» обладающие высокой электро- и теплопроводностью» ковкостью» пластичностью и металлическим блеском.
В Периодической системе химических элементов металлы расположены левее и ниже условной разделительной линии, направленной от бора к астату.
Из таблицы видно, что к металлам принадлежат все элементы побочных подгрупп, включая лантаноиды и актиноиды, элементы главных подгрупп I (за исключением водорода), II и Ш (кроме бора) и некоторые элементы главных подгрупп групп IV—VI (германий, олово, свинец, сурьма, висмут и полоний).

У атомов металлов на внешнем энергетическом уровне обычно находится от одного до трех электронов. Например, один у натрия, два у магния и три у алюминия.
Вступая в химические реакции, атомы металлов отдают свои валентные электроны. Легкость отдачи электронов возрастает с уменьшением числа электронов на внешнем энергетическом уровне и с удалением внешнего энергетического уровня от атомного ядра.
Следовательно, с ростом атомного номера элемента способность отдавать электроны и металличность в периодах уменьшаются, а в подгруппах увеличиваются.
Наиболее типичные металлы расположены в начале периодов (элементы  групп).
групп).
В химических соединениях металлы проявляют только положительные степени окисления и обладают восстановительными свойствами.
В отличие от атомов неметаллов, атомы металлов обладают большим радиусом и легко отдают валентные электроны. При этом атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими заряженными частицами образуется особый тип химической связи — металлическая (рис. 28). Эта связь обусловливает образование металлической кристаллической решетки простых веществ металлов. В узлах этих кристаллических решеток находятся положительно заряженные ионы металлов, а между ними

передвигаются свободные электроны. Так как электроны находятся в непрерывном движении, то при их столкновении с ионами металлов последние превращаются в нейтральные атомы, а затем вновь в ионы.
Кристаллические решетки, в узлах которых находятся положительно заряженные ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называют металлическими.
Связь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующими кристаллическую решетку, называют металлической связью.
Особое строение кристаллических решеток металлов определяют их общие свойства.
Физические свойства. Для всех металлов характерен металлический блеск. Это свойство обусловлено тем, что металлы хорошо отражают от своей поверхности световые лучи.
Электрическая проводимость и теплопроводность. Металлы являются хорошими проводниками электричества и теплоты. Это вызвано наличием электронов, свободно перемещающихся по всему объему кристаллической решетки металла. Помимо того, что электроны могут быть участниками направленного движения (электрического тока), они также могут переносить и тепловую энергию. Электрическая проводимость и теплопроводность металлов увеличиваются от  (ртути) к
(ртути) к  (серебру).
(серебру).

Из наиболее доступных металлов хорошей электропроводностью обладают медь и алюминий, благодаря чему их используют в качестве проводников электрического тока.
Ковкость и пластичность. Благодаря особенности металлической связи многие металлы пластичны и обладают хорошей ковкостью. При механическом воздействии на металл происходит смещение слоев атомов, однако в связи с перемещением электронов по всему кристаллу, связь не разрывается. Пластичность уменьшается в ряду:

Золото — самый пластичный металл, его можно прокатывать в листы толщиной не более 0,003 мм, которые используются для позолоты различных предметов.

На основании физических характеристик металлов условно классифицируют:
а) по плотности: легкие  тяжелые
тяжелые 
Самый легкий металл — литий (в 2 раза легче воды), а самый тяжелый осмий 
5) по температуре плавления: легкоплавкие 

и тугоплавкие  Самый легкоплавкий металл — ртуть
Самый легкоплавкий металл — ртуть  самый тугоплавкий — вольфрам
самый тугоплавкий — вольфрам 
в) по твердости: мягкие (щелочные металлы, олово, свинец) и твердые (хром и молибден). Щелочные металлы можно резать ножом.
Таким образом, общими физическими свойствами металлов являются: металлический блеск, твердость, ковкость, пластичность, хорошая проводимость теплоты и электричества (рис. 29).
Химические свойства металлов
Общим химическим свойством металлов является сравнительная легкость отдачи валентных электронов с образованием положительно заряженных ионов, т. е. в свободном состоянии металлы являются восстановителями:

Восстановительные свойства металлов проявляются по-разному. Эти свойства зависят от энергии, которая расходуется на разрушение кристаллической решетки, отрыв электронов от атомов, а также от энергии, которая выделяется при гидратации ионов. В связи с этим металлы можно расположить в ряд по убыванию восстановительной способности:

Этот ряд характеризует химическую активность металлов только в окислительно-восстановительных реакциях, протекающих в водной среде.
Взаимодействие с неметаллами
Практически все металлы непосредственно взаимодействуют с кислородом и галогенами. Эти реакции протекают при различных температурах с разными скоростями. Так, щелочные металлы легко окисляются кислородом воздуха, а их взаимодействие с гало генами может протекать со взрывом. Медь и железо вступают в эти реакции при нагревании, а золото и платиновые металлы вообще не окисляются:

Активные металлы способны присоединять водород, образуя гидриды. Эти реакции обычно протекают при нагревании до температуры 

Многие металлы могут взаимодействовать с серой с образованием сульфидов:

Некоторые металлы при нагревании взаимодействуют с азотом и фосфором, образуя нитриды и фосфиды:

Взаимодействие с водой
Щелочные, щелочноземельные металлы взаимодействуют с водой с образованием гидроксидов и выделением водорода:

Многие металлы при повышенной температуре взаимодействуют с водой с образованием оксидов металлов и водорода:

Металлы, стоящие в электрохимическом ряду напряжений металлов после водорода, не вытесняют его из воды.
Взаимодействие с растворами солей
Металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее данного металла:

Для подобных реакций нельзя применять такие металлы, как натрий, калий, кальции, барий.
Взаимодействие с кислотами
Металлы, стоящие в электрохимическом ряду напряжений металлов левее водорода, вытесняют его из разбавленных растворов кислот (за исключением азотной кислоты):

Таким образом, металлы могут вступать в реакции соединения и замещения. Закономерности изменений химических свойств металлов представлены в таблице 16.

Металлами называют вещества, обладающие, высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В Периодической системе химических элементов металлы расположены левее и ниже условной разделительной линии, направленной от бора к астату. Наиболее типичные металлы расположены в начале периодов (элементы  групп). В химических соединениях металлы проявляют только положительные степени окисления и обладают восстановительными свойствами. Металлы вступают е реакции соединения и замещения.
групп). В химических соединениях металлы проявляют только положительные степени окисления и обладают восстановительными свойствами. Металлы вступают е реакции соединения и замещения.
Получение металлов
Нахождение металлов в природе. Металлы в природе редко встречаются в свободном состоянии, главным образом они находятся в виде химических соединении (рис. 30). В виде самородков, т. е. в свободном состоянии, встречаются такие металлы, как золото и платина. Малоактивные металлы — серебро, медь, ртуть, олово встречаются как в виде самородков, так и в виде соединений. Более активные металлы можно найти только в виде соединений (схема 5).
Различна распространенность металлов в земной коре. Наиболее распространен алюминий, затем железо и далее кальций, натрий, калий, магний и титан. Содержание остальных металлов незначительно.
В недрах казахстанской земли найдены почти все металлы, имеющиеся в Периодической системе химических элементов Д. И. Менделеева. По запасам урана, вольфрама, пинка и бария наша страна занимает одно из первых мест в мире. Крупнейшие месторождения металлов (свинца, хрома, алюминия, золота, серебра,

меди и др.) сосредоточены в основном на востоке, западе и в Центральной части Казахстана. Изучением месторождений полезных ископаемых страны занималась группа ученых под руководством академика К. И. Сатпаева.
Металлы содержатся в живых организмах и участвуют в важнейших жизненных процессах. В организме взрослого человека массовая доля неорганических веществ равна 6%, а эти вещества содержат металлы  и др. Ионы железа входят в состав гемоглобина крови. Ионы кобальта участвуют в процессах кровотворения. Недостаток того или иного металла в организме человека приводит к нарушениям в работе различных органов и серьезным заболеваниям. Недостаток кальция вызывает замедление роста скелета, магния — мышечные судороги, железа — анемию, нарушение иммунной системы и др. Особенно высока потребность человека в ионах натрия и калия, которые регулируют водный обмен б организме.
и др. Ионы железа входят в состав гемоглобина крови. Ионы кобальта участвуют в процессах кровотворения. Недостаток того или иного металла в организме человека приводит к нарушениям в работе различных органов и серьезным заболеваниям. Недостаток кальция вызывает замедление роста скелета, магния — мышечные судороги, железа — анемию, нарушение иммунной системы и др. Особенно высока потребность человека в ионах натрия и калия, которые регулируют водный обмен б организме.

Способы получения
Минералы и горные породы, содержащие металлы или их соединения, пригодные для промышленного получения металлов, называются рудами. Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). Если руды содержат соединения двух или нескольких металлов, то они называются полиметаллическими. Например: медно-цинковые, свинцово-серебряные руды и др.
Получение металлов из руд — задача металлургии.
Металлургия — это наука о промышленных способах получения металлов из природного сырья. Металлургией также называют металлургическую промышленность.
Различают черную и цветную металлургию. К черной металлургии относится производство железа и его сплавов, а к цветной — производство всех остальных металлов и их сплавов.
Современная металлургия получает более 75 металлов и многочисленные сплавы на их основе. В зависимости от способов получения металлов различают пирометаллургию, гидрометаллургию, электрометаллургию.

Пирометаллургия занимает ведущее место в металлургии и объединяет группу методом получения металлов с помощью высоко-температурных реакций восстановления. В качестве восстановителей применяют водород, активные металлы, углерод и оксид углерода (II).
Металлы восстанавливают из их соединений водородом (водородотермия). Водородотермия используется для получения не очень активных металлов (медь, вольфрам, молибден):

Восстановление металлов из их соединений другими металлами, химически более активными, называется металлотермией (рис. 31, а). Эти процессы протекают также при высоких температурах. В качестве восстановителя применяют: алюминий, магний, калий, натрий и др. Если восстановителем является алюминий, то процесс называется соответственно алюмотермией, если магний — магний-термией. Методом алюмотермии получают хром, кальций, марганец, а методом кальциетермии — цезий:

Сильными восстановительными свойствами, особенно при высокой температуре, обладают углерод (в виде кокса, сажи) и оксид углерода (II) (карботермия):

Гидрометаллургия охватывает способы получения металлов из водных растворов их солей. При этом металл из руды сначала переводят в раствор, а затем из этого раствора его извлекают (рис. 32).
Так, например, получают медь:

Электрометаллургия — получение металлов с помощью электролиза (электрического тока). Так получают многие металлы, в первую очередь — щелочные, щелочноземельные и алюминий. Электролиз проводят с расплавами галогенидов (рис. 33):


Как видим, в основе всех способов получения металлов из их соединений лежат окислитель но-восстановительные процессы.
Минералы и горные породы, содержащие металлы или их соединения, пригодные для промышленного получения металлов, называются рудами. Важнейшими рудами металлов являются их оксиды и соли (сульфиды, карбонаты и др.). В зависимости от способов получения металлов различают: пирометаллургию, гидрометаллургию, электрометаллургию. В основе всех способов получения металлов из их соединений лежат окислительно-восстановительные процессы.
Сплавы металлов
К характерным свойствам металлов относится взаимодействие их между собой и некоторыми неметаллами с образованием сплавов. Сплавы — это системы, состоящие из двух или более металлов, а также металлов и неметаллов.
Сплавы существенно отличаются от исходных металлов по физическим свойствам; комбинируя их состав, можно получить сплавы с нужными свойствами: легкоплавкие, жаростойкие, кислотостойкие и т. д. Например, высокой твердостью отличается сплав золота и серебра, в то время как сами металлы в индивидуальном состоянии сравнительно мягкие. В технике широко используется легкоплавкий  сплав, в котором массовые доли кадмия
сплав, в котором массовые доли кадмия  и висмута
и висмута  равны соответственно 40% и 60% . Индивидуальные металлы имеют более высокие температуры плавления:
равны соответственно 40% и 60% . Индивидуальные металлы имеют более высокие температуры плавления: 
 Латунь (сплав меди
Латунь (сплав меди  и цинка
и цинка  ) значительно тверже, чем каждый из металлов по отдельности.
) значительно тверже, чем каждый из металлов по отдельности.
Изготовление сплавов основано на способности металлов в расплавленном состоянии взаимно растворяться и смешиваться с последующим затвердеванием при охлаждении.
В некоторых случаях расплавленные металлы реагируют друг с другом, образуя химические соединения, называемые и итерметаллидами.
Приведем данные о составе и применении некоторых важнейших сплавов (табл. 17).


Решение задач на вычисление массы вещества по уравнению реакции, если известна масса другого вещества, содержащего определенную массовую долю примесей
Абсолютно чистых веществ в природе не встречается, каждое вещество, наряду с основным компонентом включает то или иное количество примесей. Примесь (примеси) по сравнению со основным компонентом имеет иной состав, поэтому реагирует по другому или вообще не вступает в химическую реакцию. Образец вещества, содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают  массу примесей-
массу примесей-  а массу основного (чистого) вещества –
а массу основного (чистого) вещества –  Следовательно,
Следовательно, 
 Содержание примесей в техническом образце указывается с помощью массовой доли, которую выражают в долях единицы или в процентах:
Содержание примесей в техническом образце указывается с помощью массовой доли, которую выражают в долях единицы или в процентах:

Сумма массовых долей примесей и основного вещества равна: 
Если известна масса технического образца и массовая доля примесей, то массу основного компонента находят по формуле:

Отсюда следует выражение для определения массы технического образца 
Задача 1. При разложении 50,0 г технического известняка получили 10 л (н.у.) углекислого газа. Найдите массовую долю (%) примесей в известняке.
Решение. Основным компонентом известняка является карбонат кальция, при техническом разложении которого и получается углекислый газ:

По объему  находим
находим  в известняке:
в известняке:

Ответ: 10,8%.
Задача 2. Какой объем сернистого газа (н.у.) можно получить при обжиге 240 г технического пирита, в котором массовая доля примесей равна 10%?
Решение. Находим  в техническом образце:
в техническом образце: 
Записываем уравнение реакции: 
Далее решаем задачу обычным способом, например:

Ответ: 80,64 л.
Задача 3. Какая масса фосфорита, в котором массовая доля примесей равна 15%, потребуется для получения 31 г фосфора?
Решение. Составляем стехиометрическую схему процесса получения фосфора из фосфата кальция, который является основной составной частью фосфорита: 
 Далее по
Далее по  находим
находим  а по стехиометрической схеме процесса —
а по стехиометрической схеме процесса —


Мы нашли массу чистого компонента, а массу технического образца находим по формуле:

Получаем:  Можно использовать
Можно использовать
и метод логических рассуждений. Поскольку по условию задачи массовая доля  в образце равна 100% – 15% = 85%, составляем пропорцию:
в образце равна 100% – 15% = 85%, составляем пропорцию:
155 г составляет 85% ;
 составляет 100% .
составляет 100% .
Отсюда 
Ответ: 182 г.
- 1. Известняк массой 11 г обработали избытком соляной кислоты. В результате реакции выделился газ объемом 2,24 л (н.у.). Определите массовую долю карбоната кальция в известняке.
Ответ: 91%.
- 2. Какую массу кремния можно получить при взаимодействии 60 г кремнезема с 20 г кокса, содержащего 90% углерода, если выход продукта равен 90%?
Ответ: 18,9 г.
- 3. Образец массой 15,6 г, состоящий из оксида и карбоната кальция, прокалили. В результате реакции выделился газ объемом 2,24 л (н.у.). Определите массовую долю оксида кальция в образце.
Ответ: 35,9%.
- 4. На растворение смеси цинка и оксида цинка израсходовано 132,8 мл 20%-ного раствора соляной кислоты (р = 1,1г/ мл). Выделившийся после сжигания газ образует 3,6 г воды. Определите массовую долю металла в смеси.
Ответ: 44,5% .
- 5. Углекислый газ, образовавшийся при сжигании 15 г угля, содержащего 20% негорючих примесей, пропущен через 480 г 10%-ного раствора гидроксида натрия. Рассчитайте массы и массовые доли образовавшихся в растворе солей.
Ответ: 67,2 г и 12,82% 
- 6. При обработке образца фосфорита массой 50 г избытком концентрированной серной кислоты образовался твердый остаток массой 52,64 г. Рассчитайте, сколько массовых долей (в %) примесей содержится в данном образце фосфорита.
Ответ: 0,8.
- 7. Для растворения образца технического карбоната кальция массой 200 г потребовалась 70% -ная азотная кислота объемом 202,7 мл (плотность 1,421 г/мл). Определите, сколько массовых долей примесей содержалось в образце карбоната.
Ответ: 19,8%
- 8. Массовая доля азота в удобрении составляет 14%. Весь азот входит в удобрение в составе мочевины
 Вычислите массовую долю мочевины в этом удобрении.
Вычислите массовую долю мочевины в этом удобрении.
Ответ: 30% .
- 9. Вычислите массу углерода, необходимого для полного восстановления 50 кг оксида железа
 массовая доля примесей в котором 15%.
массовая доля примесей в котором 15%.
Ответ: 7,08 кг.
- 10. В образце технического пирита массой 950 кг массовая доля примесей составляет 5,2% . Найдите массу примесей и массу пирита в техническом образце.
Ответ: 900,6 кг  и 49,4 кг примесей.
и 49,4 кг примесей.
Свойства металлов и сплавов
В предыдущих главах мы рассмотрели свойства неметаллов и лишь нескольких элементов, относящихся к металлам. Прежде чем рассматривать остальные металлы по группам периодической системы, остановимся на их общих свойствах и методах получения из природных соединений.
Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников
Металлы обладают рядом общих свойств. К общим физическим свойствам металлов относятся их высокая электрическая проводимость и теплопроводность, пластичность, т. е. способность подвергаться деформации при обычных и при повышенных температурах, не разрушаясь. Пластичность металлов имеет очень большое практическое значение. Благодаря этому свойству металлы поддаются ковке, прокатке, вытягиванию в проволоку (волочению), штамповке. Металлам присущи также металлический блеск, обусловленный их способностью хорошо отражать свет, и непрозрачность.
В табл. 29 приведены значения удельного электрического сопротивления и теплопроводности некоторых металлов. Для сравнения в ней даны сведения для двух неметаллов.
Таблица 29. Удельное электрическое сопротивление  и коэффициент теплопроводности
и коэффициент теплопроводности  некоторых простых веществ при 20 oС.
некоторых простых веществ при 20 oС.

В химическом отношении все металлы характеризуются сравнительной легкостью отдачи валентных электронов и, как следствие этого, способностью образовывать положительно заряженные ноны и проявлять в своих соединениях только положительную окислен-ность. Многие металлы, например железо, хром, марганец, имеют в различных соединениях разную степень окисленности, но она всегда положительна. В связи с этим металлы в свободном состоянии являются восстановителями. Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется положением металла в ряду напряжений и концентрацией (активностью) его ионов в растворе.
Причина общности как физических, так и химических свойств металлов лежит в общности строения их атомов и природы кристаллических решеток металлов.
Общей особенностью атомов металлов являются их большие в сравнении с атомами неметаллов размеры (см. § 33). Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо — атомы металлов характеризуются низкими потенциалами ионизации (см. § 34, табл. 4 и 5) и близким к нулю пли отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей, и, как правило, не способны присоединять электроны — проявлять окислительные свойства.
Рассмотрим особенности строения металлов в кристаллическом состоянии. Как отмечалось, металлы обладают высокой электрической проводимостью, причем переносчиками тока в металлах служат электроны. Это говорит о том, что в металлах имеются «свободные» электроны, способ-ные перемещаться по кристаллу под действием даже слабых электрических полей. В то же время неметаллы в кристаллическом состоянии обычно представляют собою изоляторы и, следовательно, не содержат свободных злектронов. Причины этих различии можно объяснить на основе метода молекулярных орбиталей (метод МО).


В § 45 было показано, что при взаимодействии двух одинаковых атомов вместо двух энергетически равноценных исходных атомных орбиталей образуются две молекулярные орбитали, отвечающие различным уровням энергии (рис. 45). Если взаимодействуют три атома, причем их валентные орбитали заметно перекрываются, то возникают не две, а три молекулярные орбитали, в равной степени принадлежащие всем трем атомам (делокализованные орбитали) и характеризующиеся тремя различными значениями энергии. При последовательном увеличении числа взаимодействующих атомов добавление каждого из них приводит к образованию еще одного энергетического уровня и к дальнейшей делокализации молекулярных орбиталей (т. е. к распространению их на большее число атомов); общее число энергетических уровней будет при этом равно числу взаимодействующих атомов. Схема подобного процесса представлена на рис. 135.
Как показывает эта схема, с ростом числа атомов возрастает число разрешенных энергетических состояний, а расстояния между соседними энергетическими уровнями уменьшаются. При небольшом числе взаимодействующих атомов для перевода электрона с какого-либо энергетического уровня на ближайший более высокий уровень необходима затрата сравнительно большой энергии. Но при большом числе атомов N (в макроскопическом кристалле N имеет порядок числа Авогадро) соседние уровни настолько мало различаются, что образуется практически непрерывная энергетическая зона, и переход электрона на ближайший более высокий уровень может осуществиться при затрате ничтожно малой энергии. Если такой ближайший уровень не занят электронами, то находящийся на предшествующем уровне электрон ведет себя как «свободный»; вследствие делокализованности орбиталей он может перемещаться по кристаллу при сколь угодно малых энергетических воздействиях.
Заполнение электронами МО, составляющих энергетическую зону, происходит в порядке последовательного возрастания энергии. При этом, в соответствии с принципом Паули, на каждой МО может размещаться по два электрона.

В кристалле какого-нибудь щелочного металла, например калия, атомные орбитали внутренних электронных слоев практически не перекрываются. Можно считать, что в этом случае непрерывная энергетическая зона создается только за счет орбиталей внешнего электронного слоя и заполняется электронами этого слоя. В кристалле, содержащем N атомов, из исходных атомных s-орбиталей внешнего слоя образуется энергетическая зона, состоящая из N уровней. В этой зоне размещаются N внешних s-электронов атомов щелочного металла, которые занимают N/2 энергетических уровней (по два электрона на каждом уровне). Совокупность этих занятых валентными электронами уровнен называется валентной зоной. В рассматриваемом случае валентная зона занимает лишь половину имеющихся энергетических уровней. Остальные уровни остаются незаполненными, образуя зону проводимости (рис. 136). Здесь в непосредственной близости от верхних занятых уровней имеются свободные уровни, на которые могут переходить электроны под действием электрического поля. Это и создает возможность переноса тока электронами — обеспечивает электрическую проводимость металла.
В кристалле металла главной подгруппы второй группы (например, кальция) из исходных атомных s-орбиталей наружного слоя также образуется зона, состоящая из N уровней. Но, поскольку здесь каждый атом обладает двумя внешними s-электро-нами, то в этой зоне должно разместиться 2N электронов, так что все ее уровни окажутся полностью занятыми. Однако при взаимодействии атомов металла перекрываются не только внешние s-op-битали, но и внешние р-орбитали. В результате также образуется непрерывная энергетическая зона, не заполненная электронами. При этом зоны, образованные s- и р-орбиталями, перекрываются (рис. 137), так что и в этом случае зона проводимости, содержащая свободные энергетические уровни, непосредственно примыкает к валентной зоне. Таким образом, рассматриваемый кристалл также должен обладать высокой электрической проводимостью.
На рис. 136 и 137 изображена резкая граница между валентной зоной и зоной проводимости. В действительности эта граница размыта; вследствие теплового движения электроны могут переходить с верхних уровней валентной зоны на нижние уровни зоны проводимости. Способность этих электронов свободно передвигаться по кристаллу и переносить энергию из одной его части (нагретой) в другую (более холодную) служит причиной высокой теплопроводности металлов. Таким образом, и электрическая проводимость и теплопроводность металлов обусловлены возможностью свободного передвижения электронов зоны проводимости. Именно поэтому для большинства металлов наблюдается параллелизм между этими величинами. Например, лучшие проводники электричества — серебро и медь — обладают и наиболее высокой теплопроводностью (см. табл. 29).
При нагревании колебания атомов металла около их равновесных положений в кристаллической решетке становятся более интенсивными, 470 затрудняет движение электронов. Поэтому с повышением температуры электрическое сопротивление металлов возрастает.
Рассмотренная картина электронного строения твердых металлов показывает, что валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определенным атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объеме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность «свободных» электронов в металле — электронным газом. Металлическая связь характерна для металлов, их сплавов и интерметаллических соединений (см. стр. 534).
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твердое тело отдельные слои его кристаллической решетки смещаются относительно друг друга. В кристаллах с атомной структурой это приводит к разрыву ковалентных связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоев неизбежно создается такое положение, при котором рядом оказываются одноименно заряженные ионы; при этом возникают силы электростатического отталкивания и кристалл также разрушается. В случае же металла при смещении отдельных слоев его кристаллической решетки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы металла, но разрыва химических связей не происходит — металл деформируется, не разрушаясь.

В отличие от металлов кристаллы простых пеществ, образованных неметаллами, обычно не обладают заметкой электронной проводимостью (см. табл. 29); они представляют собою изоляторы (диэлектрики). Хотя в этом случае тоже возможно образование непрерывных энергетических зон, но здесь зона проводимости отделена от валентной зоны запрещенной зоной, т.е. значительным энегретическим промежутком  (рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
(рис. 138, изолятор). Энергия теплового движения или слабого электрического поля оказывается недостаточной для преодоления этого промежутка, и электроны не переходят из валентной зоны в зону проводимости. Таким образом, в изоляторах электроны не могут свободно перемещаться по кристаллу и служить переносчиками электрического тока.
Особыми свойствами, отличающими их как от металлов, так и от изоляторов, обладают полупроводники. При низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов.
Зависимость электрических свойств полупроводников от температуры и освещенности объясняется электронным строением их кристаллов. Здесь, как и у изоляторов, валентная зона отделена от зоны проводимости запрещенной зоной (рис. 138, полупроводник). Однако ширина запрещенной зоны  в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
в случае полупроводников невелика. Поэтому при действии квантов лучистой энергии или при нагревании электроны, занимающие верхние уровни валентной зоны, могут переходить в зону проводимости и участвовать в переносе электрического тока. С повышением температуры или при увеличении освещенности число электронов, переходящих в зону проводимости, возрастает; в соответствии с этим увеличивается и электрическая проводимость полупроводника.
При переходе электронов в зону проводимости в валентной зоне возникают не полностью занятые электронам» энергетические уровни — электронные вакансии, или «дырки». В электрическом поле такие дырки ведут себя как положительные электрические заряды. Поэтому перенос тока в полупроводниках может осуществляться как электронами зоны проводимости (п-проводимость, от латинского «negative» — отрицательный), так и дырками валентной зоны (р-проводимость, от латинского «positive» — положительный).

Кристаллическое строение металлов
Кристаллическое строение металлов изучается различными методами. Их можно разделить на две группы. К первой принадлежат методы изучения внутреннего строения кристаллов, ко второй — методы изучения их внешних форм.
Внутреннее строение кристаллов изучается глазным образом с помощью рентгеиоструктурного анализа (см. § 50). По его данным для всех металлов установлены типы и параметры кристаллических решеток.
Кристаллические решетки металлов могут быть различных типов. Однако для большинства металлов характерны три типа решеток: объемноцентрированная кубическая (Li, Na, К, V, Cr, Fe, Pb, W и др.), гранецентрированная кубическая (Аl, Са, Fe, Ni, Сu, Ag, Аu п др.), гексагональная (Be, Mg, Cd, Ti, Co, Zn и др.). На рис. 139 показаны элементарные ячейки (см. § 50) решеток этих типов.
Размеры, форму и взаимное расположение кристаллов в металлах изучают металлографическими методами. Наиболее полную оценку структуры металла в этом отношении дает микроскопический анализ его шлифа. Из испытуемого металла вырезают образец и его плоскость шлифуют, полируют и протравливают специальным раствором (травителем). В результате травления выявляется структура образца, которую рассматривают или фотографируют с помощью металлографического микроскопа.
Кристаллы металлов обычно имеют небольшие размеры. Поэтому любое металлическое изделие состоит из большого числа кристаллов. Такая структура называется поликристаллической. При кристаллизации металла из расплавленного состояния растущие кристаллы мешают друг другу принять правильную форму. Поэтому кристаллы поликристаллического тела имеют неправильную форму и в отличие от правильно ограненных кристаллов называются кристаллитами или зернами. Зерна различаются между собой пространственной ориентацией их кристаллических решеток (рис. 140).
При травлении шлифа границы зерен разъедаются сильнее; они становятся углубленными. Свет, падая на них, рассеивается, и в поле зрения микроскопа границы зерен представляются темными, а сами зерна — светлыми (рис. 141).
Специальными способами получают куски металлов, представляющие собой один кристалл — монокристаллы. Монокристаллы металлов, а также неметаллов изготовляют для научных исследований и для специальных отраслей техники (полупроводники, лазеры и др.).
Внутренняя структура зерна металла не является строго правильной. Металлам, как и всем реальным кристаллам (см. § 51), присущи дефекты структуры. При этом многие свойства металлов сильно зависят от характера и от числа имеющихся в металле дефектов. Так, в процессах диффузии важную роль играют вакансии. Эти процессы протекают, например, при насыщении в горячем состоянии поверхностного слоя металлического изделия другими элементами для защиты от коррозии или для придания поверхности изделия твердости. Проникновение атомов постороннего элемента в глубь металла происходит в основном по местам вакансий. С повышением температуры число вакансий возрастает, что служит одной из причин ускорения процесса диффузии.
Некоторые механические свойства металлов зависят от количества дислокаций и от их способности к перемещению по металлу. Так, высокая пластичность металлов объясняется перемещением дислокаций.
Схема пластического сдвига в кристалле металла изображена на рис. 142. Внешняя сила Р первоначально вызывает небольшое смещение атомов вертикальных рядов 1, 2, 3 (рис. 142, а). С увеличением силы Р это смещение возрастает и ряд атомов 1 (выше плоскости скольжения АА) проскакивает нейтральное положение между 1′ и 2′. При этом ряд 2 превращается в лишнюю плоскость и образует дислокацию (рис. 142, б), знакомую нам по рис. 62 (стр. 156). В результате образования дислокации решетка искажается по обе стороны плоскости скольжения. Поэтому далее уже при небольшой силе Р вертикальные ряды атомов над плоскостью скольжения будут смещаться — дислокация подобно эстафете будет последовательно передаваться рядам 3, 4 и далее.



В какой-то момент будет иметь место положение, представленное на рис. 142, в. В итоге же дислокация выйдет на поверхность и исчезнет, как показано на рнс. 142, г.
Таким образом, пластический сдвиг в реальном металле происходит не путем одновременного сдвига всей атомной плоскости, что потребовало бы затраты гораздо большей энергии, а путем перемещения дислокаций вдоль плоскости скольжения.
Металлические кристаллы, лишенные дислокаций, обладают весьма высокой прочностью. Такими кристаллами являются выращиваемые в особых условиях нитевидные кристаллы или «усы». Их прочность во много раз превышает прочность обычных образцов соответствующего металла и близка к теоретической величине, вычисленной для кристаллической решетки металла, не имеющей дефектов структуры.
С другой стороны, появление в металле очень большого числа различно ориентированных дислокаций также приводит к повышению прочности, так как при этом кристаллическая структура металла сильно искажается и перемещение дислокаций затрудняется. В этом состоит объяснение явления наклепа — упрочнения металла под действием пластической деформации. При нагревании сильно деформированного металла искажения его структуры, вызванные сдвигами, постепенно снимаются — металл возвращается в структурно более устойчивое состояние; его пластичность возрастает, а твердость и прочность снижаются.
Добывание металлов из руд
Огромное большинство металлов находится в природе в виде соединений с другими элементами. Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, а серебро и медь — отчасти; иногда попадаются также самородные ртуть и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой водой, или путем извлечения их из породы различными реагентами с последующим выделением из раствора. Все же остальные металлы добываются химической переработкой их природных соединений.
Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главнейшие руды содержат оксиды, сульфиды и карбонаты металлов. Получение металлов из руд составляет задачу металлургии — одной из наиболее древних отраслей химической промышленности. Металлургические процессы, протекающие при высоких температурах, называются пирометаллургическими. Пирометаллургическим путем получают, например, чугун и сталь.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем или СО. Если, например, смешать красную медную руду Cu2О с углем и накалить, то уголь, восстанавливая медь, превращается в оксид углерода (II), а медь выделяется в расплавленном состоянии:

Выплавка чугуна производится восстановлением железных руд оксидом углерода.
При переработке сульфидных руд сперва переводят сульфиды в оксиды путем обжига в специальных печах, а затем уже восстанавливают полученные оксиды углем. Например:

Кроме пирометаллургических методов, при добывании металлов применяются гидрометаллургические методы. Они представляют собою извлечение металлов из руд в виде их соединений водными растворами различных реагентов с последующим выделением металла из раствора. Гидрометаллургическим путем получают, например, золото (см. § 202).
Обычно руды представляют собой совокупность минералов. Минералы, содержащие извлекаемый металл, называются рудными минералам и, все остальные — пустой породой. Последняя чаще всего состоит из песка, глины, известняка, которые трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают специальные вещества — флюсы. Флюсы образуют с веществами пустой породы легкоплавкие соединения — шлаки, которые обычно собираются на поверхности расплавленного металла и удаляются. Если пустая порода состоит из известняка, то в качестве флюса применяется песок. Для руд, содержащих большие количества песка, флюсом служит известняк. В обоих случаях в качестве шлака образуется силикат кальция, поскольку песок состоит в основном из диоксида кремния.
Во многих рудах количество пустой породы столь велико, что непосредственная выплавка металла из таких руд экономически невыгодна. Такие руды предварительно обогащают — отделяют от них часть пустой породы. В остающемся концентрате содержание рудного минерала повышается. Существуют различные способы обогащения руд. Чаще других применяются флотационный, гравитационный и магнитный способы.
Флотационный метод основан на различной смачиваемости поверхности минералов водою. Тонкоизмельченную руду обрабатывают водой, к которой добавлено небольшое количество флотационного реагента, усиливающего различие в смачиваемости частиц рудного минерала и пустой породы. Через образующуюся смесь энергично продувают воздух; при этом его пузырьки прилипают к зернам тех минералов, которые хуже смачиваются. Эти минералы выкосятся вместе с пузырьками воздуха на поверхность и таким образом отделяются от пустой породы.
Гравитационное обогащение основано на различии плотности и вследствие этого скорости падения зерен минералов в жидкости.
Магнитный способ основан на разделении минералов по их магнитным свойствам.
Не все металлы можно получить восстановлением их оксидов углем или  . Подсчитаем, например, стандартную энергию Гиббса реакции восстановления хрома:
. Подсчитаем, например, стандартную энергию Гиббса реакции восстановления хрома:

Воспользовавшись табл. 7 (стр. 194), находим 
 ,
,  ,
,
 , откуда
, откуда 
 . Полученная величина положительна. Это показывает, что при
. Полученная величина положительна. Это показывает, что при  и стандартных концентрациях реагирующих веществ реакция не протекает в интересующем нас направлении. Положительное и большое по абсолютной величине значение
и стандартных концентрациях реагирующих веществ реакция не протекает в интересующем нас направлении. Положительное и большое по абсолютной величине значение  указывает на то, что реакция не протекает в направлении восстановления металла не только при стандартных условиях, но и при температурах и концентрациях, заметно отличающихся от стандартных.
указывает на то, что реакция не протекает в направлении восстановления металла не только при стандартных условиях, но и при температурах и концентрациях, заметно отличающихся от стандартных.
Для металлов, не восстанавливаемых ни углем, ни оксидом углерода (II), применяются более сильные восстановители: водород, магний, алюминий, кремний. Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, в качестве восстановителя применяется алюминий, то процесс носит название алюминотермии. Такие металлы, как хром, марганец, получают главным образом алюминотермией, а также восстановлением кремнием. Если мы подсчитаем  реакции
реакции

то получим отрицательную величину (—523 кДж). Это говорит о том, что восстановление хрома алюминием может протекать самопроизвольно.
Наконец, металлы, оксиды которых наиболее прочны (алюминий, магний и другие), получают электролизом (см. § 103),
Получение металлов высокой чистоты
На протяжении последних десятилетии в связи с развитием новых отраслей техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежном работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие «опасные» примеси, как бор, кадмий и другие, содержались в количествах, не превышающих миллионных долен процента. Чистый цирконий — один из лучших конструкционных материалов для атомных реакторов — становится совершенно непригодным для этой цели, если в нем содержится даже незначительная примесь гафния. В используемом в качестве полупроводника германии допускается содержание не более одного атома фосфора, мышьяка или сурьмы па десять миллионов атомов металла. В жаропрочных сплавах, широко применяемых, например, в ракетостроении, совершенно недопустима даже ничтожная примесь свинца или серы.
В связи с потребностями промышленности разработаны новые методы очистки веществ. Рассмотрим наиболее важные из них.
Перегонка в вакууме
Этот метод основан на различии летучестей очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуум-насосом, после чего нижняя часть сосуда нагревается. В ходе перегонки на холодных частях сосуда осаждаются либо примеси* (если они более летучи, чем основной металл), либо очищенный металл (если примеси менее летучи). Процесс ведется при непрерывной откачке воздуха, так как присутствие даже небольших количеств кислорода приводило бы к окислению поверхности расплавленного металла и тем самым к торможению процесса испарения.
* Точнее говоря, в этом случае осаждается основной металл, сильно обогащенный примесями.
Зонная плавка заключается в медленном протягивании бруска очищаемого металла через кольцевую печь. Тот участок (зона) бруска, который находится в данный момент в печи, плавится. По мере продвижения бруска жидкая зона перемещается от начала бруска к его концу.
Зонной плавке подвергают металл, прошедший предварительную очистку. Содержание примесей в нем уже невелико, так что основной металл и примеси образуют гомогенный твердый раствор. При движении бруска через кольцевую печь происходит плавление металла у передней границы зоны и кристаллизация его у задней границы. При этом состав образующихся кристаллов, находящихся в равновесии с расплавом, отличается от состава расплава (см. стр. 530). Примеси одних металлов концентрируются в расплавленной зоне и перемещаются вместе с ней к концу бруска; примеси других металлов концентрируются в образующихся кристаллах, остаются за движущейся зоной и при неоднократном повторении процесса перемещаются к началу бруска. В результате средняя часть бруска получается наиболее чистой; ее вырезают и используют.
Зонную плавку применяют для очистки не только металлов, но и других веществ.
Термическое разложение летучих соединений металла. Карбонильный процесс
Этот метод применяется для получения высокочистых никеля и железа. Подлежащий очистке никель нагревают в атмосфере оксида углерода (II), находящегося под давлением около 20 МПа. При этом никель взаимодействует с  , образуя летучий тетракарбонил никеля
, образуя летучий тетракарбонил никеля  (теми. кип. 42 °С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся
(теми. кип. 42 °С); содержащиеся в исходном металле примеси в такого рода реакцию не вступают. Образовавшийся  отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением высокочнстого металла.
отгоняют, а затем нагревают до более высокой температуры. В результате карбонил разрушается с выделением высокочнстого металла.
При очистке железа аналогичным образом осуществляется процесс синтеза и последующего разложения пентакарбонила железа  (темп. кип. 105 °С).
(темп. кип. 105 °С).
Иодидный способ дает возможность получать титан, цирконий и некоторые другие металлы значительной чистоты. Рассмотрим этот процесс на примере титана. Исходный металл в виде порошка нагревается до 100—200 °С с небольшим количеством иода в герметическом аппарате. В аппарате натянуты титановые нити, нагреваемые электрическим током до 1300—1500 °С. Титан (но не примеси) образует с иодом летучий иодид  , который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом нозые порции иодида; процесс идет непрерывно до переноса всего металла па титановые нити.
, который разлагается на раскаленных нитях. Выделяющийся чистый титан осаждается на них, а иод образует с исходным металлом нозые порции иодида; процесс идет непрерывно до переноса всего металла па титановые нити.
Процесс можно представить схемой:

Сплавы
Для изготовления оборудования в различных отраслях современной промышленности используются самые разнообразные материалы, как природные, так и созданные руками человека. Однако основа современной техники — машины и механизмы — изготовляются в основном из металлических материалов — металлов, сплавов металлов друг с другом и с некоторыми неметаллами, прежде всего с углеродом. Это связано с тем, что из всех видов материалов металлические материалы обладают наиболее ценными механическими свойствами. Кроме того, металлические материалы очень многочисленны и разнообразны по своим свойствам.

В жидком состоянии большинство металлов растворяются друг в друге и образуют однородный жидкий сплав. При кристаллизации из расплавленного состояния различные металлы ведут себя по-разному. Основными случаями являются при этом следующие три.
1. В твердом состоянии сплавляемые металлы не растворяются и химически не взаимодействуют друг с другом. При этих условиях сплав представляет собою механическую смесь и состоит из кристаллитов одного и другого компонентов *, отчетливо выявляемых па микрошлкфе (рис. 143).
* По-видимому, нет металлов, абсолютно нерастворимых друг в друге в твердом состоянии. Но в тех случаях, когда взаимная растворимость металлов не превышает сотых долей процента, принято считать, что они нерастворимы друг в друге.
2. Сплавляемые металлы взаимодействуют друг с другом, образуя химическое соединение.
3. При кристаллизации из расплава растворимость металлов друг в друге сохраняется. Образуются однородные кристаллы. В этом случае твердая фаза носит название твердого раствора (рис. 144). При этом для одних металлов их взаимная растворимость в твердом состоянии неограниченна, другие же растворимы друг в друге лишь до определенных концентраций.
195. Диаграммы состояния металлических систем. При изучении свойств сплавов очень большое значение имеют диаграммы состояния, характеризующие состояние сплавов различного состава при разных температурах. Такие диаграммы показывают термодинамически устойчивые состояния, т. е. состояния, отвечающие минимуму энергии Гиббса системы. Их называют также фазовыми диаграммами, так как они показывают, какие фазы могут сосуществовать при данных условиях.
Диаграммы состояния получают экспериментально. Обычно для этого строят кривые охлаждения и по остановкам и перегибам на них, вызванным тепловыми эффектами превращений, определяют температуры этих превращений. Для получения кривых охлаждения приготовляют из двух металлов изучаемой системы ряд смесей различного состава. Каждую из приготовленных смесей расплавляют. Получающиеся жидкие сплавы (расплавы) медленно охлаждают, отмечая через определенные промежутки времени температуру остывающего сплава. По данным наблюдений строят кривые охлаждения, откладывая на оси абсцисс время, а на оси ординат — температуру (рис. 145).
На рис. 145 слева показано, какой вид имеет кривая охлаждения чистого расплавленного металла. Сначала понижение температуры плавно идет по кривой  . В точке
. В точке  происходит перелом кривой, начинается образование твердой фазы (кристаллизация), сопровождающееся выделением теплоты, вследствие чего температура некоторое время остается постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается плавное понижение температуры по кривой
происходит перелом кривой, начинается образование твердой фазы (кристаллизация), сопровождающееся выделением теплоты, вследствие чего температура некоторое время остается постоянной (кривая идет параллельно оси абсцисс). Когда вся масса расплавленного металла затвердеет, опять начинается плавное понижение температуры по кривой  .
.
Иногда остановки в падении температуры наблюдаются и на кривой охлаждения твердого металла, указывая па связанные с выделением теплоты процессы, происходящие уже в твердом веществе, например переход из одной кристаллической формы в другую.

Несколько иной вид имеет кривая охлаждения сплава двух металлов. Такая кривая изображена на рис. 145 справа. Точка  , как и на первой кривой, отвечает началу затвердевания — началу выделения из сплава кристаллов одного из входящих в него металлов. При этом состав остающегося жидким сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Однако выделяющаяся при кристаллизации теплота все же замедляет ход охлаждения, вследствие чего в точке
, как и на первой кривой, отвечает началу затвердевания — началу выделения из сплава кристаллов одного из входящих в него металлов. При этом состав остающегося жидким сплава изменяется, и температура его затвердевания непрерывно понижается во время кристаллизации. Однако выделяющаяся при кристаллизации теплота все же замедляет ход охлаждения, вследствие чего в точке  происходит перелом кривой. Выпадение кристаллов и плавное понижение температуры происходят до тех пор, пока не достигается температура, при которой сплав закристаллизовывается без изменения состава. Здесь падение температуры приостанавливается (точка
происходит перелом кривой. Выпадение кристаллов и плавное понижение температуры происходят до тех пор, пока не достигается температура, при которой сплав закристаллизовывается без изменения состава. Здесь падение температуры приостанавливается (точка  ). Когда кристаллизация закончится, температура падает по кривой
). Когда кристаллизация закончится, температура падает по кривой  .
.

Рис. 147. Диаграмма состоянии системы  .
.
Имея достаточный набор сплавов, различающихся содержанием компонентов и определив в каждом сплаве температуры превращений, можно построить диаграмму состояния. На диаграммах состояния по вертикальной оси откладывают температуру, а по горизонтальной — состав сплава (содержание одного из компонентов). Для сплавов, состоящих из двух компонентов, обозначаемых буквами  и
и  , состав характеризуется на отрезке прямой, принятом за 100 %. Крайние точки соответствуют индивидуальным компонентам. Любая же точка отрезка, кроме крайних, характеризует состав двойного сплава. На рис. 146 числа указывают содержание компонента ). Например, точка
, состав характеризуется на отрезке прямой, принятом за 100 %. Крайние точки соответствуют индивидуальным компонентам. Любая же точка отрезка, кроме крайних, характеризует состав двойного сплава. На рис. 146 числа указывают содержание компонента ). Например, точка  отвечает сплаву, состоящему из 20 %
отвечает сплаву, состоящему из 20 %  и 80 %
и 80 %  .
.
Рассмотрим четыре простых случая — четыре типа диаграмм, соответствующие упомянутым выше типам сплавов: механической смеси, твердому раствору с неограниченной и с ограниченной растворимостью и химическому соединению.
Диаграмма состояния для сплавов, образующих механические смеси индивидуальных компонентов
В качестве примера диаграммы этого типа на рис. 147 приведена диаграмма состояния системы  . Точки
. Точки  и
и  на диаграмме—это температуры плавления компонентов системы: свинца (327°С) и сурьмы (631°С). В сплавах рассматриваемого типа добавка одного компонента к другому, согласно закону Рауля, понижает температуру начала его кристаллизации (затвердевания). Кривая
на диаграмме—это температуры плавления компонентов системы: свинца (327°С) и сурьмы (631°С). В сплавах рассматриваемого типа добавка одного компонента к другому, согласно закону Рауля, понижает температуру начала его кристаллизации (затвердевания). Кривая  показывает температуру кристаллизации свинца из расплавов, богатых свинцом, а кривая
показывает температуру кристаллизации свинца из расплавов, богатых свинцом, а кривая  — температуру кристаллизации сурьмы из расплавов, богатых сурьмой. Видно, что по мере увеличения содержания второго компонента температуры кристаллизации как свинца, так и сурьмы понижаются. Точка
— температуру кристаллизации сурьмы из расплавов, богатых сурьмой. Видно, что по мере увеличения содержания второго компонента температуры кристаллизации как свинца, так и сурьмы понижаются. Точка  принадлежит обеим кривым: из расплава, состав которого отвечает этой точке, кристаллизуются одновременно оба металла. Эта совместная кристаллизация происходит при самой низкой температуре. Отвечающий точке
принадлежит обеим кривым: из расплава, состав которого отвечает этой точке, кристаллизуются одновременно оба металла. Эта совместная кристаллизация происходит при самой низкой температуре. Отвечающий точке  состав называется эвтектическим составом, а соответствующий сплав — эвтектическим сплавом или просто эвтектикой (от греческого «эвтектикос» — хорошо плавящийся). Для системы
состав называется эвтектическим составом, а соответствующий сплав — эвтектическим сплавом или просто эвтектикой (от греческого «эвтектикос» — хорошо плавящийся). Для системы  эвтектика состоит из 13 %
эвтектика состоит из 13 %  и 87 %
и 87 %  ; она плавится и кристаллизуется при 246°С.
; она плавится и кристаллизуется при 246°С.
Рассмотрим подробнее процесс кристаллизации расплава. Пусть это будет расплав, содержащий 40 %  и 60 %
и 60 %  (точка
(точка  на рис. 147). При охлаждении этого расплава до 395 °С (точка
на рис. 147). При охлаждении этого расплава до 395 °С (точка  ) из него начнут выпадать кристаллы. Это будут кристаллы избыточного по сравнению с эвтектикой компонента, в данном случае — сурьмы. Теперь сплав стал двухфазным. На диаграмме состояния ему отвечают две точки: точка
) из него начнут выпадать кристаллы. Это будут кристаллы избыточного по сравнению с эвтектикой компонента, в данном случае — сурьмы. Теперь сплав стал двухфазным. На диаграмме состояния ему отвечают две точки: точка  (расплав) и точка
(расплав) и точка  (кристаллы сурьмы). Кристаллизация некоторого количества сурьмы изменит состав расплава; он станет беднее сурьмой и, следовательно, богаче свинцом. Точка на диаграмме, отвечающая расплаву, сместится немного влево. Поскольку охлаждение продолжается, эта точка вновь дойдет до кривой — из расплава снова выпадет какое-то количество кристаллов сурьмы. Таким образом, по мере охлаждения и кристаллизации точка, отвечающая расплаву, двигается вниз и влево по кривой кристаллизации сурьмы, а точка, отвечающая кристаллам сурьмы, — вниз по правой вертикальной оси. Когда расплав достигнет эвтектического состава, из него станут выпадать очень мелкие кристаллы обоих компонентов (эвтектика), пока не закристаллизуется все взятое количество вещества. Получившийся сплав будет представлять собою смесь эвтектики с кристаллами сурьмы.
(кристаллы сурьмы). Кристаллизация некоторого количества сурьмы изменит состав расплава; он станет беднее сурьмой и, следовательно, богаче свинцом. Точка на диаграмме, отвечающая расплаву, сместится немного влево. Поскольку охлаждение продолжается, эта точка вновь дойдет до кривой — из расплава снова выпадет какое-то количество кристаллов сурьмы. Таким образом, по мере охлаждения и кристаллизации точка, отвечающая расплаву, двигается вниз и влево по кривой кристаллизации сурьмы, а точка, отвечающая кристаллам сурьмы, — вниз по правой вертикальной оси. Когда расплав достигнет эвтектического состава, из него станут выпадать очень мелкие кристаллы обоих компонентов (эвтектика), пока не закристаллизуется все взятое количество вещества. Получившийся сплав будет представлять собою смесь эвтектики с кристаллами сурьмы.
Если исходить из расплава, содержащего небольшое количество сурьмы (меньше эвтектического), то весь процесс будет происходить аналогично рассмотренному, с тон разницей, что вначале будут выпадать кристаллы не сурьмы, а свинца. Полученный сплав будет иметь структуру, представляющую собой смесь эвтектики с кристаллами свинца. Наконец, если исходить из расплава эвтектического состава, то весь сплав закристаллизуется при 246 °С и будет представлять собой эвтектику. На рис. 148 показана структура сплавов системы  .
.

Если верхние кривые диаграммы на рис. 147 ( и
и  ) показывают температуру начала кристаллизации, то нижняя — горизонталь, проходящая через точку
) показывают температуру начала кристаллизации, то нижняя — горизонталь, проходящая через точку  , — показывает температуру окончания кристаллизации сплава. Как видно, для систем, имеющих диаграммы рассматриваемого типа, температура окончания кристаллизации не зависит от состава сплава.
, — показывает температуру окончания кристаллизации сплава. Как видно, для систем, имеющих диаграммы рассматриваемого типа, температура окончания кристаллизации не зависит от состава сплава.
При плавлении твердых сплавов горизонталь, проходящая через точку  , показывает температуру начала плавления. В рассматриваемом случае зта температура не зависит от состава сплава, потому что плавление начинается с эвтектики, входящей в состав всех сплавов системы (кроме индивидуальных компонентов). При этом температура сплава будет оставаться постоянной, пока вся имеющаяся в нем эвтектика не расплавится. Дальнейшее нагревание приведет к повышению температуры — начнут плавиться кристаллы чистого компонента, которые находились в исходном сплаве в смеси с эвтектикой. Состав расплава будет обогащаться этим компонентом, и точка, отвечающая расплаву, будет двигаться по соответствующей ветви верхней кривой. Когда плавление закончится, т.е. когда твердая фаза исчезнет, тогда состав расплава станет таким же, каким был состав исходного сплава. Таким образом, если исходить из твердого сплава, то горизонталь, проходящая через точку Е, показывает температуру начала, а кривые
, показывает температуру начала плавления. В рассматриваемом случае зта температура не зависит от состава сплава, потому что плавление начинается с эвтектики, входящей в состав всех сплавов системы (кроме индивидуальных компонентов). При этом температура сплава будет оставаться постоянной, пока вся имеющаяся в нем эвтектика не расплавится. Дальнейшее нагревание приведет к повышению температуры — начнут плавиться кристаллы чистого компонента, которые находились в исходном сплаве в смеси с эвтектикой. Состав расплава будет обогащаться этим компонентом, и точка, отвечающая расплаву, будет двигаться по соответствующей ветви верхней кривой. Когда плавление закончится, т.е. когда твердая фаза исчезнет, тогда состав расплава станет таким же, каким был состав исходного сплава. Таким образом, если исходить из твердого сплава, то горизонталь, проходящая через точку Е, показывает температуру начала, а кривые  и
и  — окончания плавления.
— окончания плавления.
Из сказанного ясно, что области I на диаграмме рис. 147 отвечает расплав, областям II и III соответствует сосуществование расплава с кристаллами избыточного компонента, областям IV и V отвечает смесь эвтектики с зернами свинца (область IV) или сурьмы (область V).
Как уже говорилось, по горизонтальной оси диаграмм состояния откладывается состав взятого сплава. Однако для областей, отвечающих равновесию двух фаз, по этой оси можно также устанавливать составы этих фаз. Пусть, например, сплав 5 %  и 95 %
и 95 %  нагрет до 270 °С. Такому сплаву отвечает точка а на диаграмме состояния (рис. 149). Проведем через эту точку горизонталь до пересечения с ближайшими линиями диаграммы. Мы получим точки
нагрет до 270 °С. Такому сплаву отвечает точка а на диаграмме состояния (рис. 149). Проведем через эту точку горизонталь до пересечения с ближайшими линиями диаграммы. Мы получим точки  и
и  . Они показывают, что взятому сплаву при 270 °С отвечает равновесие кристаллов свинца (точка
. Они показывают, что взятому сплаву при 270 °С отвечает равновесие кристаллов свинца (точка  ) с расплавом, состав которого определяется абсциссой точки
) с расплавом, состав которого определяется абсциссой точки  (приблизительно 10 %
(приблизительно 10 %  и 90 %
и 90 %  ).
).
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии
На рис. 150 приведена диаграмма состояния системы  , представляющая собой простейший пример диаграмм этого типа. Как и в предыдущих случаях, точки
, представляющая собой простейший пример диаграмм этого типа. Как и в предыдущих случаях, точки  и
и  показывают температуры плавления компонентов. Вид кривых плавления (нижняя кривая) и затвердевания (верхняя кривая) обусловлен в этом случае тем, что кристаллы, выделяющиеся при охлаждении расплава, всегда содержат оба компонента (кроме, конечно, кристаллизации чистых серебра или золота).
показывают температуры плавления компонентов. Вид кривых плавления (нижняя кривая) и затвердевания (верхняя кривая) обусловлен в этом случае тем, что кристаллы, выделяющиеся при охлаждении расплава, всегда содержат оба компонента (кроме, конечно, кристаллизации чистых серебра или золота).
Рассмотрим, как происходит кристаллизация расплавов в этом случае. Пусть исходный жидкий сплав соответствует точке  на диаграмме (рис. 150). При охлаждении его до температуры
на диаграмме (рис. 150). При охлаждении его до температуры  (точка
(точка  ) начинается кристаллизация. Кристаллы представляют собой твердый раствор, более богатый тугоплавким компонентом— золотом (точка
) начинается кристаллизация. Кристаллы представляют собой твердый раствор, более богатый тугоплавким компонентом— золотом (точка  ). Поэтому в ходе кристаллизации жидкая фаза обедняется тугоплавким компонентом, и точка диаграммы, отвечающая расплаву, смещается несколько влево. По мере охлаждения эта точка движется вниз, вновь доходит до кривой и процесс кристаллизации продолжается. Таким образом, охлаждение расплава сопровождается выпадением кристаллов твердого раствора, обогащенных тугоплавким компонентом — золотом, и обогащением расплава легкоплавким компонентом — серебром. Соответствующие точки на диаграмме при этом перемещаются: состав жидкой фазы изменяется по верхней линии, а состав твердого раствора — по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении такой температуры
). Поэтому в ходе кристаллизации жидкая фаза обедняется тугоплавким компонентом, и точка диаграммы, отвечающая расплаву, смещается несколько влево. По мере охлаждения эта точка движется вниз, вновь доходит до кривой и процесс кристаллизации продолжается. Таким образом, охлаждение расплава сопровождается выпадением кристаллов твердого раствора, обогащенных тугоплавким компонентом — золотом, и обогащением расплава легкоплавким компонентом — серебром. Соответствующие точки на диаграмме при этом перемещаются: состав жидкой фазы изменяется по верхней линии, а состав твердого раствора — по нижней. При медленном проведении процесса кристаллизация заканчивается по достижении такой температуры  , при которой образующиеся кристаллы имеют состав исходного сплава (точка
, при которой образующиеся кристаллы имеют состав исходного сплава (точка  ).
).
Таким образом, области I на диаграмме состояния рассматриваемой системы (рис. 150) отвечает расплав, области II — сосуществование расплава и кристаллов твердого раствора, области III — твердый раствор. При равновесии точки обеих кривых на диаграмме связаны между собой: каждой температуре отвечает расплав определенного состава и кристаллы тоже определенного состава, но другого, чем состав расплава (например, точке  отвечает точка
отвечает точка  ).
).
В ходе процесса кристаллизации температура системы понижается и равновесие между расплавом и кристаллами, образовавшимися ранее, т.е. при более высокой температуре, нарушается. Поэтому кристаллизация сопровождается диффузией, в результате чего при медленном проведении процесса зерна всего сплава получаются однородными и имеют одинаковый состав. При быстром охлаждении процессы диффузии не успевают происходить и сплав получается неоднородным.


Как и в предыдущем случае, но горизонтальной оси диаграммы можно устанавливать составы равновесных фаз, в данном случае — расплава и находящегося в равновесии с ним твердого раствора. Например, система, которой отвечает точка s, состоит из расплава, состав которого отвечает точке е, и кристаллов состава, соответствующего точке р.
Диаграмма состояния для сплавов с ограниченной взаимной растворимостью в твердом состоянии
В сплавах этого типа, образуемых компонентами  и
и  , могут существовать жидкая фаза и два твердых раствора: раствор компонента
, могут существовать жидкая фаза и два твердых раствора: раствор компонента  в
в  и раствор компонента
и раствор компонента  в
в  . В простейшем случае эти два твердых раствора образуют эвтектику; к такому типу принадлежит система
. В простейшем случае эти два твердых раствора образуют эвтектику; к такому типу принадлежит система  , диаграмма состояния которой приведена на рис. 151. Отметим прежде всего, что области I здесь отвечает расплав, области II — твердый раствор олова в свинце, области III — твердый раствор свинца в олове.
, диаграмма состояния которой приведена на рис. 151. Отметим прежде всего, что области I здесь отвечает расплав, области II — твердый раствор олова в свинце, области III — твердый раствор свинца в олове.
Для того чтобы понять, существованию каких фаз отвечают другие области па диаграмме и кривые па пси, рассмотрим, как протекает в системе данного типа кристаллизация расплавов.
Сначала будем исходить из жидкого сплава, богатого свинцом (точка  на рис. 151). При охлаждении этого расплава до температуры
на рис. 151). При охлаждении этого расплава до температуры  (точка
(точка  ) начнется выделение кристаллов твердого раствора олова в свинце. Состав этих кристаллов отвечает точке
) начнется выделение кристаллов твердого раствора олова в свинце. Состав этих кристаллов отвечает точке  ; они богаче свинцом, чем исходный расплав, так что при кристаллизации расплав обедняется свинцом. Как и в предыдущих случаях, точки на диаграмме, отвечающие расплаву и образующимся кристаллам, перемещаются: состав жидкой фазы изменяется по линии
; они богаче свинцом, чем исходный расплав, так что при кристаллизации расплав обедняется свинцом. Как и в предыдущих случаях, точки на диаграмме, отвечающие расплаву и образующимся кристаллам, перемещаются: состав жидкой фазы изменяется по линии  , а состав кристаллов — по линии
, а состав кристаллов — по линии  . По достижении температуры
. По достижении температуры  (точка
(точка  ) образующиеся кристаллы имеют состав исходного сплава. Если процесс проводится достаточно медленно, то при температуре
) образующиеся кристаллы имеют состав исходного сплава. Если процесс проводится достаточно медленно, то при температуре  кристаллизация заканчивается, подобно тому, как это происходит в системах с неограниченной взаимной растворимостью (см. выше).
кристаллизация заканчивается, подобно тому, как это происходит в системах с неограниченной взаимной растворимостью (см. выше).
Кривая  показывает растворимость олова в твердом свинце при различных температурах. Видно, что растворимость максимальна при 183,3 °С. Поэтому при охлаждении кристаллов до температуры
показывает растворимость олова в твердом свинце при различных температурах. Видно, что растворимость максимальна при 183,3 °С. Поэтому при охлаждении кристаллов до температуры  (точка
(точка  ) твердый раствор делается насыщенным. В нем начнет протекать превращение в твердом состоянии: кристаллы твердого раствора на основе свинца, состав которых отвечает точке
) твердый раствор делается насыщенным. В нем начнет протекать превращение в твердом состоянии: кристаллы твердого раствора на основе свинца, состав которых отвечает точке  , будет превращаться в кристаллы твердого раствора на основе олова, состав которых соответствует точке
, будет превращаться в кристаллы твердого раствора на основе олова, состав которых соответствует точке  . При постоянной температуре кристаллы этих двух твердых растворов будут находиться в равновесии. Однако при дальнейшем охлаждении равновесие нарушится и превращение одних кристаллов в другие будет продолжаться. При этом кристаллы твердого раствора на основе свинца будут обедняться оловом — их состав будет изменяться по кривой
. При постоянной температуре кристаллы этих двух твердых растворов будут находиться в равновесии. Однако при дальнейшем охлаждении равновесие нарушится и превращение одних кристаллов в другие будет продолжаться. При этом кристаллы твердого раствора на основе свинца будут обедняться оловом — их состав будет изменяться по кривой  ; одновременно по кривой
; одновременно по кривой  будет изменяться состав кристаллов твердого раствора на основе олова.
будет изменяться состав кристаллов твердого раствора на основе олова.
Теперь рассмотрим охлаждение жидкого сплава, не столь богатого свинцом (точка  ). По охлаждении до температуры
). По охлаждении до температуры  (точка
(точка  ) из расплава начнут выделяться кристаллы твердого раствора на основе свинца; их состав отвечает точке
) из расплава начнут выделяться кристаллы твердого раствора на основе свинца; их состав отвечает точке  . По мере выделения этих кристаллов, расплав обогащается оловом: его состав изменяется по линии
. По мере выделения этих кристаллов, расплав обогащается оловом: его состав изменяется по линии  , а состав выделяющихся кристаллов — по линии
, а состав выделяющихся кристаллов — по линии  . Когда точка, отвечающая расплаву, достигает точки
. Когда точка, отвечающая расплаву, достигает точки  ,— из расплава выделяются кристаллы обоих твердых растворов; при этом состав кристаллов твердого раствора на основе свинца отвечает точке
,— из расплава выделяются кристаллы обоих твердых растворов; при этом состав кристаллов твердого раствора на основе свинца отвечает точке  , а состав кристаллов твердого раствора на основе олова — точке
, а состав кристаллов твердого раствора на основе олова — точке  . Ясно, что точка
. Ясно, что точка  представляет собой эвтектическую точку, а выделяющаяся смесь кристаллов — эвтектическую смесь.
представляет собой эвтектическую точку, а выделяющаяся смесь кристаллов — эвтектическую смесь.
В области температур ниже 183,3 °С растворимость свинца в олове и олова в свинце с понижением температуры уменьшается. Поэтому при дальнейшем охлаждении сплава образовавшиеся кристаллы изменяют свой состав. Состав кристаллов твердого раствора олова в свинце изменяется по кривой  , а кристаллов твердого раствора свинца в олове — по кривой
, а кристаллов твердого раствора свинца в олове — по кривой  .
.
Аналогично протекает кристаллизация расплавов, богатых оловом. В этом случае кристаллизация начинается с выделения кристаллов твердого раствора на основе олова.
На основании сказанного можно заключить, что областям IV и V на диаграмме отвечает сосуществование жидкого расплава и кристаллов твердого раствора на основе свинца (область IV) или на основе олова (область V), а областям VI и VII — смеси кристаллов эвтектики с кристаллами твердого раствора на основе свинца (область VI) или твердого раствора на основе олова (область VII).

Рис. 152. Диаграмма состояния системы  .
.
Диаграмма состояния для сплавов, образующих химические соединения
Металлы образуют друг с другом многочисленные соединения, называемые интерметаллическими. Энтальпии образования подобных соединении обычно невелики; лишь в некоторых случаях (например, при взаимодействии алюминия с расплавленной медью) их образование сопровождается значительным экзотермическим эффектом. Многие металлы образуют по несколько соединении друг с другом, например,  .
.
На рис. 152 приведена диаграмма состояния системы  . Эта система служит простейшим примером систем, в которых образуются химические соединения: свинец образует с магнием только одно соединение
. Эта система служит простейшим примером систем, в которых образуются химические соединения: свинец образует с магнием только одно соединение  , а в твердом состоянии эти металлы взаимно нерастворимы.
, а в твердом состоянии эти металлы взаимно нерастворимы.
От рассмотренных ранее диаграмм эта диаграмма отличается наличием максимума на кривой начала кристаллизации. Этот максимум (точка  ) отвечает температуре плавления соединения
) отвечает температуре плавления соединения  . Абсцисса точки максимума указывает состав соединения. На диаграмме имеются две эвтектики
. Абсцисса точки максимума указывает состав соединения. На диаграмме имеются две эвтектики  и
и  . Эвтектика
. Эвтектика  представляет собой смесь кристаллов
представляет собой смесь кристаллов  и
и  , а эвтектика
, а эвтектика  — кристаллов
— кристаллов  и
и  .
.
Таким образом, диаграмма системы с химическим соединением как бы составлена из двух диаграмм первого типа. Если компоненты системы образуют между собой два или более химических соединения, то диаграмма как бы составлена из трех, четырех и более отдельных диаграмм первого типа.
Кристаллизация сплавов в этом и в подобных случаях происходит аналогично кристаллизации сплавов, образующих диаграммы первого типа. Отличие состоит в том, что, кроме выделения кристаллов индивидуальных компонентов, происходит еще образование кристаллов соединения. По линии  из расплавов при охлаждении выделяется магний, по линии
из расплавов при охлаждении выделяется магний, по линии  — свинец и по линии
— свинец и по линии  . Так, если охлаждать жидкий сплав, содержащий 40 %
. Так, если охлаждать жидкий сплав, содержащий 40 %  (60 %
(60 %  ), то из него сначала будут выделяться кристаллы магния. Когда температура понизится до 460 °С, вся оставшаяся еще жидкой часть сплава начнет затвердевать при этой температуре, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения
), то из него сначала будут выделяться кристаллы магния. Когда температура понизится до 460 °С, вся оставшаяся еще жидкой часть сплава начнет затвердевать при этой температуре, образуя эвтектическую смесь мельчайших кристалликов магния и химического соединения  .
.
При охлаждении жидкого сплава, содержащего 75 %  , сначала будут выделяться кристаллы
, сначала будут выделяться кристаллы  . Это будет происходить до тех пор, пока температура не снизится до 460 °С — точки образования эвтектики. Аналогичные процессы с выделением эвтектики
. Это будет происходить до тех пор, пока температура не снизится до 460 °С — точки образования эвтектики. Аналогичные процессы с выделением эвтектики  (при 250 °С) будут протекать при содержании в сплаве более 80 %
(при 250 °С) будут протекать при содержании в сплаве более 80 %  .
.
Нетрудно понять, что области I на рис. 152 отвечает жидкий сплав, областям II—V—равновесия жидкого сплава и соответствующих кристаллов (в области II — кристаллы  , в областях III и IV — кристаллы
, в областях III и IV — кристаллы  , в области V—кристаллы
, в области V—кристаллы  ), а областям VI—IX — твердые сплавы
), а областям VI—IX — твердые сплавы 

 .
.
Мы рассмотрели наиболее простые, но в то же время важнейшие типы диаграмм состояния. Для многих систем диаграммы состояния носят значительно более сложный характер. Так, ряд металлов и сплавов испытывают превращения в твердом состоянии, переходя из одной модификации в другую. На диаграмме состояния появляются при этом кривые, разграничивающие области устойчивости этих модификаций.
Существуют методы построения диаграмм состояния тройных систем — систем, состоящих из трех компонентов.
Для технически важных систем диаграммы состояния изучены и приводятся в специальной литературе. Они имеют широкое применение в различных областях науки и техники, служат научной основой при подборе сплавов, обладающих заданными свойствами, при изыскании методов термической обработки сплавов, при разработке и создании новых сплавов. Примером системы, имеющей очень большое практическое значение, может служить система  . Диаграмма состояния этой системы рассмотрена в § 238.
. Диаграмма состояния этой системы рассмотрена в § 238.
Кроме диаграмм состояния, большое значение имеют диаграммы состав — свойство. На этих диаграммах по оси абсцисс откладывают, как и на диаграммах состояния, состав системы, а по оси ординат — величины, характеризующие различные свойства системы, например, плотность, электрическую проводимость, коррозионную стойкость и др.
В верхней части рис. 153 схематически изображены диаграммы состояния четырех основных типов сплавов, а в нижней его части — отвечающие им типичные диаграммы — «состав — свойство». Видно, что при образовании механической смеси (рис. 153, а) свойства сплавов изменяются линейно и их значения находятся в интервале между значениями этих свойств для индивидуальных компонентов. При образовании твердых растворов (рис. 153, б и в) наблюдается нелинейная зависимость. При этом некоторые свойства могут значительно отличаться от свойств металлов, составляющих сплав. Наконец, при образовании химического соединения на диаграммах «состав — свойство» появляется максимум или минимум, отвечающий соединению (рис. 153,г).

Метод построения диаграмм «состав — свойство» был положен И. С. Курнаковым * в основу разработанного им метода исследования систем — физико-химического анализа. В настоящее время физико-химический анализ служит одним из основных способов изучения сплавов и вообще систем, состоящих из нескольких компонентов: солей, оксидов и других.
* Николай Семенович Курнаков (1860—1941)—русский ученый, академик, лауреат Государственной премии, автор работ по теории растворов и сплавов, химии комплексных соединений, основоположник физико-химического анализа. Н. С. Курнаков уделял много внимания изучению природных соляных растворов; его работы в этой области способствовали эффективному использованию отечественных соляных ресурсов и привели к открытию месторождений калийных солей вблизи Соликамска.
Коррозия металлов
Металлические материалы — металлы и сплавы на основе металлов,— приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему. Поэтому на защиту от коррозии тратятся большие средства.
К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др.
Для изготовления аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования.
К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
В воде обычно содержится растворенный кислород, способный к восстановлению:

Кроме того, в воде присутствуют ноны водорода, также способные к восстановлению:

Растворенный кислород и ионы водорода — важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, и какие — ионами водорода. Потенциал, отвечающий электродному процессу

равен (см. табл. 18 на стр. 277):

В нейтральных средах ( ) он будет иметь значение:
) он будет иметь значение:

Следовательно, растворенный в воде или в нейтральном водном растворе кислород может окислить те металлы, потенциал которых меньше, чем 0,8 В; они расположены в ряду напряжений от его начала до серебра.
Потенциал, отвечающий электродному процессу

в нейтральной среде, равен приблизительно —0,41 В (см. стр. 282). Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислить только те металлы, потенциал которых меньше, чем —0,41 В, — это металлы от начала ряда напряжений до кадмия. При этом кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную оксидною пленку, препятствующую взаимодействию этих металлов с водой. Поэтому число металлов, которые могут быть окислены ионами водорода в нейтральных средах, еще меньше.
Таким образом, вода, содержащая растворенный кислород, значительно опаснее в коррозионном отношении, чем вода, не содержащая его и способная окислять металлы только ионами водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла и окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде — в атмосфере или в растворе.
При коррозии металла, содержащего включения другого металла, могут наблюдаться, в зависимости от размеров включений, два различных случая.
Включения инородного металла очень малы. Такие включения практически не изменяют величину потенциала основного металла в данном растворе. В этом случае ускорение коррозии может наблюдаться, если перенапряжение окислительной полуреакшш на металле включения меньше, чем на основном металле.
В качестве примера можно указать на коррозию цинка, содержащего небольшие примеси железа или меди, в соляной или в разбавленной серной кислотах. При содержании в цинке сотых долей процента какого-либо из этих металлов скорость взаимодействия его с указанными кислотами в сотни раз выше, чем в случае цинка, подвергшегося специальной очистке. Это объясняется тем, что перенапряжение выделения водорода на меди и на железе ниже, чем на цинке, а лимитирующей стадией (см. § 61) реакции

является именно процесс восстановления ионов водорода.
Включения инородного металла не столь малы. Потенциал таких включении отличен от потенциала основного металла. В этом случае, помимо величины перенапряжения окислительной полуреакции на металле включения, на скорость коррозии может повлиять поляризующее действие (см. § 104) металла включения на основной металл. Если металл включения имеет больший потенциал, чем основной металл, то последний поляризуется анодно и скорость его коррозии возрастает. Например, алюминий, содержащий включения железа или меди, корродирует значительно быстрее, чем алюминий высокой чистоты.
Скорость коррозии металла повышается также при включении в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствуют образованию на ней защитных слоев.
Как уже говорилось (см. § 100), некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла, или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла; в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, цинке.
К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия.
Атмосферная коррозия — коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь — кислород. Скорость атмосферной коррозии зависит от условий. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты  . Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
. Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
Коррозия в грунте* приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
* Этот вид коррозии часто неточно называют почвенной коррозией.
Коррозия при неравномерной аэрации** — наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Такое неравномерное распределение коррозии объясняется следующим образом. При восстановлении кислорода

расходуются ионы водорода и раствор, следовательно, несколько подщелачивается. Металлы, и в частности железо, при подщелачивании раствора легче переходят в пассивное состояние. Поэтому аэрируемые участки металла переходят в пассивное состояние и скорость коррозии на них снижается. На неаэрируемых участках не происходит пассивирования — здесь протекает процесс окисления металла, приводящий к переходу его ионов в раствор:

** Аэрация — омывание воздухом, кислородом.
Таким образом, при неравномерной аэрации металла осуществляется пространственное разделение окислительно-восстановительной реакции: восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности. Локализация процесса окисления приводит к местной коррозии — интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений («язв»), которые со временем могут превращаться в сквозные отверстия. Иногда развитие язв трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
Контактная коррозия может протекать, когда два металла с различными потенциалами соприкасаются друг с другом либо в водной среде, либо при наличии влаги, конденсирующейся из воздуха. Так же, как и в рассмотренном выше случае значительных включений, металлы оказывают друг на друга поляризующее действие; металл с меньшим потенциалом поляризуется акод-но, и скорость его коррозии вблизи места контакта резко возрастает.
Контактная коррозия наблюдается, например, в теплофикационных установках, когда медные нагревательные змеевики соединены с железными кипятильниками или трубами. Интенсивная коррозия железа протекает около мест соединения. Однако соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но также от природы растворенных в воде веществ, от температуры и от других условий и не всегда соответствует взаимному положению металлов в ряду напряжений. Так, в случае контакта железо — цинк последний интенсивно корродирует при комнатной температуре, но в горячей воде полярность металлов изменяется и растворяться начинает железо.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы. К важнейшим из них относятся следующие:
1) применение химически стойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до 18 % хрома и до 10 % никеля.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал— серебро, золото. Существуют различные способы нанесения металлических покрытий; наибольшие преимущества имеют методы гальванотехники (см. § 103).
К неметаллическим относятся покрытия лаками, красками, эмалями, фенолоформальдегидными и другими смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей, машин, приборов чаще всего применяются лакокрасочные покрытия.
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатнрование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Метод обработки внешней среды пригоден для случаев, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от природы металла и раствора применяются различные ингибиторы: нитрит натрия, хромат и дихромат калия, фосфаты натрия, некоторые высокомолекулярные органические соединения и другие. Защитное действие этих веществ обусловлено тем, что их молекулы или ноны адсорбируются на поверхности металла н каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние.
К электрохимическим методам защиты металлов относятся катодная защита и метод протекторов. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает вещество анода.
Метод протекторов осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла — протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окислителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
И протекторы, и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Ясно, что убытки, вызванные коррозией корпуса морского судна и связанные с его простоем и ремонтом, очень велики и во много раз превышают стоимость протекторов.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Роман Тургенева «Накануне»: идейно-художественное своеобразие
Из каких слоев общества появятся «новые люди»? Что будет отличать их от поколения Рудиных и Лаврецких? Какую программу обновления России они примут и как приступят к освобождению народа от крепостного права? Эти вопросы волновали Тургенева давно. Еще в 1855 году, в момент работы над «Рудиным», задача, которую он поставил в «Накануне», уже начинала возникать перед ним: «Фигура главной героини, Елены, тогда еще нового типа в русской жизни, довольно ясно обрисовывалась в моем воображении,— вспоминал Тургенев,— но недоставало героя, такого лица, которому Елена, при ее еще смутном, хотя сильном стремлении к свободе, могла предаться» (XII, 306), Тогда же сосед Тургенева, отправляясь в Крым в качестве офицера дворянского ополчения, оставил писателю рукопись автобиографической повести, одним из главных героев которой был молодой болгарский революционер, студент Московского университета. Теперь мы знаем, что прототипом тургеневского Инсарова явился Николай Димитров Катранов, родившийся в 1829 году в болгарском городе Свиштов в небогатой купеческой семье. В 1848 году в составе большой группы болгарских юношей он приехал в Россию и поступил на историко-филологический факультет Московского университета.
Начавшаяся в 1853 году русско-турецкая война всколыхнула революционные настроения балканских славян, боровшихся за избавление от многовекового турецкого ига. В начале 1853 года Николай Катранов с русской женой Ларисой уехал на родину. Но внезапная вспышка туберкулеза спутала все планы. Пришлось вернуться в Россию, а затем ехать на лечение в Венецию, где Катранов простудился и скоропостижно скончался 5 мая 1853 года. Это был талантливый человек: он писал стихи, занимался переводами, горячо пропагандировал среди русских друзей идею освобождения родины.
Вплоть до 1859 года тетрадь с рукописью Каратеева — так звали тургеневского соседа — лежала без движения, хотя, познакомившись с ней, писатель воскликнул: «Вот герой, которого я искал! Между тогдашними русскими такого еще не было». Почему же Тургенев обратился к этой тетради в 1859 году, когда и в России подобного типа герои уже появились? Почему в качестве образца для русских «сознательно-героических натур» Тургенев предлагает болгарина Дмитрия Инсарова? Что не устроило, наконец, Тургенева в добролюбовской интерпретации романа «Накануне», опубликованного в январском номере журнала «Русский вестник» в 1860 году?
Н. А. Добролюбов, посвятивший разбору этого романа специальную статью «Когда же придет настоящий день?», дал классическое определение художественному дарованию Тургенева, увидев в нем писателя, чуткого к общественным проблемам. Очередной его роман «Накануне» еще раз блестяще оправдал эту репутацию. Добролюбов отметил четкую расстановку в нем главных действующих лиц. Центральная героиня Елена Стахова стоит перед выбором, на место ее избранника претендуют молодой ученый, историк Берсенев, будущий художник, человек искусства Шубин, успешно начинающий служебную деятельность чиновник Курнатовский и, наконец, человек гражданского подвига, болгарский революционер Инсаров. Социально-бытовой сюжет романа имеет символический подтекст: Елена Стахова олицетворяет молодую Россию «накануне» предстоящих перемен, Кто всего нужнее ей сейчас: люди науки или искусства, государственные чиновники или героические натуры, люди гражданского подвига? Выбор Еленой Инсарова дает недвусмысленный ответ на этот вопрос.
Добролюбов заметил, что в Елене Стаховой «сказалась та смутная тоска по чем-то, та почти бессознательная, но неотразимая потребность новой жизни, новых людей, которая охватывает теперь все русское общество, и даже не одно только так называемое образованное» (VI, 120).
В описании детских лет Елены Тургенев обращает внимание на глубокую близость ее к народу. С тайным уважением и страхом слушает она рассказы нищей девочки Кати о жизни «на всей божьей воле» и воображает себя странницей, покинувшей отчий дом и скитающейся по дорогам. Из народного источника пришла к Елене русская мечта о правде, которую надо искать далеко-далеко, со странническим посохом в руках. Из того же источника— готовность пожертвовать собой ради других, ради высокой цели спасения людей, попавших в беду, страдающих и несчастных. Не случайно в разговорах с Инсаровым Елена вспоминает буфетчика Василия, «который вытащил из горевшей избы безногого старика и сам чуть не погиб».
Даже внешний облик Елены напоминает птицу, готовую взлететь, и ходит героиня «быстро, почти стремительно, немного наклонясь вперед». Смутная тоска и неудовлетворенность Елены тоже связаны с темой полета: «Отчего я с завистью гляжу на пролетающих птиц? Кажется, полетела бы с ними, полетела — куда, не знаю, только далеко, далеко отсюда» (VIII, 79). Устремленность к полету проявляется и в безотчетных поступках героини: «Долго глядела она на темное, низко нависшее небо; потом она встала, движением головы откинула от лица волосы и, сама не зная зачем, протянула к нему, к этому небу, свои обнаженные, похолодевшие руки…» (VIII, 35—36). Проходит тревога — «опускаются невзлетевшие крылья». И в роковую минуту, у постели больного Инсарова, Елена видит высоко над водой белую чайку: «Вот если она полетит сюда,— подумала Елена,— это будет хороший знак…» Чайка закружилась на месте, сложила крылья — и, как подстреленная, с жалобным криком пала куда-то далеко за темный корабль» (VIII, 157).
Таким же окрыленным героем, достойным Елены, оказывается Дмитрий Инсаров. Что отличает его от русских Берсеневых и Шубиных? Прежде всего — цельность характера, полное отсутствие противоречий между словом и делом. Он занят не собой, все помыслы его сосредоточены на одной цели — освобождении родины, Болгарии. Тургенев верно уловил в характере Инсарова типические черты лучших людей эпохи болгарского Возрождения: широту и разносторонность умственных интересов, сфокусированных в одну точку, подчиненных одному делу — освобождению народа от векового рабства. Силы Инсарова питает и укрепляет живая связь с родной землей, чего так не хватает русским героям романа — Берсеневу, который пишет труд «О некоторых особенностях древнегерманского права в деле судебных наказаний», талантливому Шубину, который лепит вакханок и мечтает об Италии. И Берсенев, и Шубин — тоже деятельные люди, но их деятельность слишком далека от насущных потребностей народной жизни. Это люди без крепкого корня, отсутствие которого придает их характерам или внутреннюю вялость, как у Берсенева, или мотыльковое непостоянство, как у Шубина.
В то же время в характере Инсарова сказывается родовая ограниченность, типичная для Дон-Кихота. В поведении героя подчеркиваются упрямство и прямолинейность, некоторый педантизм. Художественную завершенность эта двойственная характеристика получает в ключевом эпизоде с двумя статуэтками героя, которые вылепил Шубин. В первой Инсаров представлен героем, а во второй — бараном, поднявшимся на задние ноги и склоняющим рога для удара. Не обходит Тургенев в своем романе и размышлений о трагичности судьбы людей донкихотского склада.
Рядом с сюжетом социальным, отчасти вырастая из него, отчасти возвышаясь над ним, развертывается в романе сюжет философский. «Накануне» открывается спором между Шубиным и Берсеневым о счастье и долге. «…Каждый из нас желает для себя счастья… Но такое ли это слово «счастье», которое соединило, воспламенило бы нас обоих, заставило бы нас подать друг другу руки? Не эгоистическое ли, я хочу сказать, не разъединяющее ли это слово?» (VIII, 14). Соединяют людей слова: «родина», «наука», «справедливость». И «любовь», но только если она — не «любовь-наслаждение», а «любовь-жертва».
Инсарову и Елене кажется, что их любовь соединяет личное с общественным, что она одухотворяется высшей целью. Но вот оказывается, что жизнь вступает в некоторое противоречие с желаниями и надеждами героев. На протяжении всего романа Инсаров и Елена не могут избавиться от ощущения непростительности своего счастья, от чувства виновности перед кем-то, от страха расплаты за свою любовь. Почему?
Жизнь ставит перед влюбленной Еленой роковой вопрос: совместимо ли великое дело, которому она отдалась, с горем бедной, одинокой матери, которое попутно этим делом вызывается? Елена смущается и не находит на этот вопрос возражения. Ведь любовь Елены к Инсарову приносит страдание не только матери: она оборачивается невольной нетерпимостью и по отношению к отцу, к русским друзьям — Берсеневу и Шубину, она ведет Елену к разрыву с Россией. «Ведь все-таки это мой дом,—думала она,— моя семья, моя родина…»
Елена безотчетно ощущает, что и в ее чувствах к Инсарову счастье близости с любимым человеком временами преобладает над любовью к тому делу, которому весь, без остатка, хочет отдаться герой. Отсюда — чувство вины перед Инсаровым: «Кто знает, может быть, я его убила».
В свою очередь, Инсаров задает Елене аналогичный вопрос: «Скажи мне, не приходило ли тебе в голову, что эта болезнь послана нам в наказание?» (VIII, 128). Любовь и общее дело оказываются не вполне совместимыми. В бреду, в период первой болезни, а потом в предсмертные мгновения коснеющим языком Инсаров произносит два роковых для него слова: «резеда» и «Рендич». Резеда — это тонкий запах духов, оставленный Еленой в комнате больного Инсарова; Рендич — соотечественник героя, один из организаторов готовящегося восстания балканских славян против турецких поработителей. Бред выдает глубокое внутреннее раздвоение цельного Инсарова, источником этого раздвоения является любовь.
В отличие от Чернышевского и Добролюбова с их оптимистической теорией «разумного эгоизма», утверждавшей единство личного и общего, счастья и долга, любви и революции в природе человека, Тургенев обращает внимание на скрытый драматизм человеческих чувств, на вечную борьбу центростремительных (эгоистических) и центробежных (альтруистических) начал в душе каждого человека. Человек, по Тургеневу, драматичен не только в своем внутреннем существе, но и в отношениях с окружающей его природой. Природа не считается с неповторимой ценностью человеческой личности: с равнодушным спокойствием она поглощает и простого смертного, и героя; все равны перед ее неразличающим взором. Этот мотив универсального трагизма жизни вторгается в роман неожиданной смертью Инсарова, исчезновением Елены на этой земле —«навсегда, безвозвратно». «Смерть, как рыбак,—с горечью говорит Тургенев,—который поймал рыбу в свою сеть и оставляет ее на время в воде: рыба еще плавает, но сеть на ней, и рыбак выхватит ее —когда захочет» (VIII, 166). С точки зрения «равнодушной природы» каждый из нас «виноват уже тем, что живет».
Однако мысль о трагизме человеческого существования не умаляет, а, напротив, укрупняет в романе Тургенева красоту и величие дерзновенных, освободительных порывов человеческого духа, оттеняет поэзию любви Елены к Инсарову, придает широкий общечеловеческий смысл социальному содержанию романа. Неудовлетворенность Елены современным состоянием жизни в России, ее тоска по иному, более совершенному социальному порядку в философском плане романа приобретает «продолжающийся» смысл, актуальный во все эпохи и все времена. «Накануне» — это роман о порыве России к новым общественным отношениям, пронизанный нетерпеливым ожиданием «сознательно-героических натур», которые двинут вперед дело освобождения крестьян.
И в то же время это роман о бесконечных исканиях человечества, о постоянном стремлении его к социальному совершенству, о вечном вызове, который бросает человеческая личность «равнодушной природе»:
«О, как тиха и ласкова была ночь, какою голубиною кротостию дышал лазурный воздух, как всякое страдание, всякое горе должно было замолкнуть и заснуть под этим ясным небом, под этими святыми, невинными лучами! «О боже! — думала Елена,— зачем смерть, зачем разлука, болезнь и слезы? или зачем эта красота, это сладостное чувство надежды, зачем успокоительное сознание прочного убежища, неизменной защиты, бессмертного покровительства? Что же значит это улыбающееся, благословляющее небо, эта счастливая, отдыхающая земля? Ужели это все только в нас, а вне нас вечный холод и безмолвие? Ужели мы одни… одни… а там, повсюду, во всех этих недосягаемых безднах и глубинах, — все, все нам чуждо? К чему же тогда эта жажда и радость молитвы?.. Неужели же нельзя умолить, отвратить, спасти… О боже! неужели нельзя верить чуду?» (VIII, 156).
Современников Тургенева из лагеря революционной демократии, для которых главнее был социальный смысл романа, не мог не смущать его финал: неопределенный ответ Увара Ивановича на вопрос Шубина, будут ли у нас,. в России, люди, подобные Инсарову. Какие могли быть загадки на этот счет в конце 1859 года, когда дело реформы стремительно подвигалось вперед, когда «новые люди» заняли ключевые посты в журнале «Современник»? Чтобы правильно ответить на этот вопрос, нужно выяснить, какую программу действий предлагал Тургенев «русским Инсаровым».
Автор «Записок охотника» вынашивал мысль о братском союзе всех антикрепостнических сил и надеялся на гармонический исход социальных конфликтов. Инсаров говорит: «Заметьте: последний мужик, последний нищий в Болгарии и я — мы желаем одного и того же. У всех у нас одна цель. Поймите, какую это дает уверенность и крепость!» (VIII, 68). Тургеневу хотелось, чтобы все прогрессивно настроенные люди России, без различия социальных положений и оттенков в политических убеждениях, протянули друг другу руки.
В жизни случилось другое. Добролюбов в статье «Когда же придет настоящий день?» решительно противопоставил задачи «русских Инсаровых» той программе общенационального единения, которую провозгласил в романе Тургенева болгарский революционер. «Русским Инсаровым» предстояла борьба с «внутренними турками», в число которых у Добролюбова попадали не только консерваторы, противники реформ, но и либеральные партии русского общества. Статья била в святая святых убеждений и верований Тургенева. Поэтому он буквально умолял Некрасова не печатать ее, а когда она была опубликована – покинул журнал «Современник» навсегда.
В романе «Накануне» (1860) смутные светлые предчувствия и надежды, которые пронизывали меланхоличное повествование «Дворянского гнезда», превращаются в определенные решения. Основной для Тургенева вопрос о соотношении мысли и деятельности, человека дела и теоретика в этом романе решается в пользу практически осуществляющего идею героя.
Само название романа «Накануне» — название «временное», в отличие от «локального» названия «Дворянское гнездо», — отражает то обстоятельство, что замкнутости, неподвижности патриархальной русской жизни приходит конец. Русский дворянский дом с вековым укладом его быта, с приживалками, соседями, карточными проигрышами оказывается на распутье мировых дорог. Русская девушка находит применение своим силам и самоотверженным стремлениям, участвуя в борьбе за независимость болгарского народа. Сразу после выхода в свет романа читатели и критики обратили внимание на то, что личностью, которую русское молодое поколение готово признать за образец, здесь представлен болгарин.
Название романа «Накануне» не только отражает прямое, сюжетное его содержание (Инсаров гибнет накануне войны за независимость его родины, в которой он страстно хочет принять участие), но и содержит оценку состояния русского общества накануне реформы и мысль о значении народно-освободительной борьбы в одной стране (Болгарии) как кануна общеевропейских политических перемен (в романе косвенно затрагивается и вопрос о значении сопротивления итальянского народа австрийскому владычеству).
Добролюбов считал образ Елены средоточием романа — воплощением молодой России. В этой героине, по мнению критика, воплощена «неотразимая потребность новой жизни, новых людей, которая охватывает теперь все русское общество, и даже не одно только так называемое «образованное» <.. .> «Желание деятельного добра» есть в нас, и силы есть; но боязнь, неуверенность в своих силах и, наконец, незнание: что делать? — постоянно нас останавливают <…> и мы всё ищем, жаждем, ждем… ждем, чтобы нам хоть кто-нибудь объяснил, что делать».
Таким образом, Елена, представлявшая, по его мнению, молодое поколение страны, ее свежие силы, характеризуется стихийностью протеста, она ищет «учителя» — черта, присущая деятельным героиням Тургенева.
Идея романа и структурное ее выражение, столь сложные и многозначные в «Дворянском гнезде», в «Накануне» предельно ясны, однозначны. Героиня, ищущая учителя-наставника, достойного любви, в «Накануне» выбирает из четырех претендентов на ее руку, из четырех идеальных вариантов, ибо каждый из героев — высшее выражение своего этико-идейного типа. Шубин и Берсенев представляют художественно-мыслительный тип (тип людей отвлеченно-теоретического или образно-художественного творчества), Инсаров и Курнатовский относятся к «деятельному» типу, т. е. к людям, призвание которых состоит в практическом «жизнетворчестве».
Говоря о значении в романе выбора своего пути и своего «героя», который делает Елена, Добролюбов рассматривает этот поиск-выбор как некий процесс, эволюцию, аналогичную развитию русского общества за последнее десятилетие. Шубин, а затем и Берсенев соответствуют по своим принципам и характерам более архаичным, отдаленным стадиям этого процесса. Вместе с тем оба они не настолько архаичны, чтобы быть «несовместимыми» с Курнатовским (деятелем эпохи реформ) и Инсаровым (особое значение которому придает складывающаяся революционная ситуация), Берсенев и Шубин — люди 50-х гг. Ни один из них не является чистым представителем гамлетовского типа. Таким образом, Тургенев в «Накануне» как бы распростился со своим излюбленным типом. И Берсенев, и Шубин генетически связаны с «лишними людьми», но в них нет многих главных черт героев этого рода. Оба они прежде всего не погружены в чистую мысль, анализ действительности не является их основным занятием. От рефлексии, самоанализа и бесконечного ухода в теорию их «спасает» профессионализация, призвание, живой интерес к определенной сфере деятельности и постоянный труд.
«Одарив» своего героя-художника Шубина фамилией великого русского скульптора, Тургенев придал его портрету привлекательные черты, напоминающие внешность Карла Брюллова, — он сильный, ловкий блондин.
Из первого же разговора героев — друзей и антиподов (наружность Берсенева рисуется как прямая противоположность внешности Шубина: он худой, черный, неловкий), разговора, который является как бы прологом романа, выясняется, что один из них «умница, философ, третий кандидат московского университета», начинающий ученый, другой — художник, «артист», скульптор. Но характерные черты «артиста» — черты человека 50-х гг. и идеала людей 50-х гг. — сильно рознятся от романтического представления о художнике. Тургенев нарочито дает это понять: в самом начале романа Берсенев указывает Шубину, каковы должны быть его — «артиста» — вкусы и склонности, и Шубин, шутливо «отбиваясь» от этой обязательной и неприемлемой для него позиции художника-романтика, защищает свою любовь к чувственной жизни и ее реальной красоте.
В самом подходе Шубина к своей профессии проявляется его связь с эпохой. Сознавая ограниченность возможностей скульптуры как художественного рода, он стремится передать в скульптурном портрете не только и не столько внешние формы, сколько духовную суть, психологию оригинала, не «линии лица», а взгляд глаз. Вместе с тем ему присуща особенная, заостренная способность оценивать людей и умение возводить их в типы. Меткость характеристик, которые он дает другим героям романа, превращает его выражения в крылатые слова; Эти характеристики в большинстве случаев и являются ключом к типам, изображенным в романе.
Если в уста Шубина автор романа вложил все социально-исторические приговоры, вплоть до приговора о правомерности «выбора Елены», Берсеневу он передал ряд этических деклараций. Берсенев — носитель высокого этического принципа самоотвержения и служения идее («идее науки»), как Шубин — воплощение идеального «высокого» эгоизма, эгоизма здоровой и цельной натуры.
Берсеневу придана нравственная черта, которой Тургенев отводил особенно высокое место на шкале душевных достоинств: доброта. Приписывая эту черту Дон-Кихоту, Тургенев на ней основывался в своем утверждении исключительного этического значения образа Дон-Кихота для человечества. «Все пройдет, все исчезнет, высочайший сан, власть, всеобъемлющий гений, всё рассыплется прахом <…> Но добрые дела не разлетятся дымом: они долговечнее самой сияющей красоты» (VIII, 191). У Берсенева эта доброта происходит от глубоко, органически усвоенной им гуманистической культуры и присущей ему «справедливости», объективности историка, способного встать выше личных, эгоистических интересов и пристрастий и оценить значение явлений действительности безотносительно к своей личности.
Отсюда и проистекает истолкованная Добролюбовым как признак нравственной слабости «скромность», понимание им второстепенного значения своих интересов в духовной жизни современного общества и своего «второго номера» в строго определенной иерархии типов современных деятелей.
Тип ученого как идеал оказывается исторически дезавуированным. Это «низведение» закреплено и сюжетной ситуацией (отношение Елены к Берсеневу), и прямыми оценками, данными герою в тексте романа, и самооценкой, вложенной в его уста. Такое отношение к профессиональной деятельности ученого могло родиться лишь в момент, когда жажда непосредственного жизнестроительства, исторического общественного творчества охватила лучших людей молодого поколения. Этот практицизм, это деятельное отношение к жизни не у всех молодых людей 60-х гг. носили характер революционного или даже просто бескорыстного служения. В «Накануне» Берсенев выступает как антипод не столько Инсарова (мы уже отмечали, что он более чем кто-либо другой способен оценить значение личности Инсарова), сколько обер-секретаря Сената — карьериста Курнатовского.
В характеристике Курнатовского, «приписанной» автором Елене, раскрывается мысль о принадлежности Курнатовского, как и Инсарова, к «действенному типу» и о взаимовраждебных позициях, занимаемых ими внутри этого — очень широкого — психологического типа. Вместе с тем в этой характеристике сказывается и то, как исторические задачи, необходимость решения которых ясна всему обществу (по словам Ленина, во время революционной ситуации обнаруживается невозможность «для господствующих классов сохранить в неизменном виде свое господство» и вместе с тем наблюдается «значительное повышение <…> активности масс», не желающих жить по-старому), заставляют людей самой разной политической ориентации надевать маску прогрессивного человека и культивировать в себе черты, которые приписываются обществом таким людям.
«Вера» Курнатовского — это вера в государство в приложении к реальной русской жизни эпохи, вера в сословно-бюрократическое, монархическое государство. Понимая, что реформы неизбежны, деятели типа Курнатовского связывали все возможные в жизни страны изменения с функционированием сильного государства, а себя считали носителями идеи государства и исполнителями его исторической миссии, отсюда — самоуверенность, вера в себя, по словам Елены.
В центре романа — болгарский патриот-демократ и революционер по духу — Инсаров. Он стремится опрокинуть деспотическое правление в родной стране, рабство, утвержденное веками, и систему попрания национального чувства, охраняемую кровавым, террористическим режимом. Душевный подъем, который он испытывает и сообщает Елене, связан с верой в дело, которому он служит, с чувством своего единства со всем страдающим народом Болгарии. Любовь в романе «Накануне» именно такова, какой ее рисует Тургенев в выше цитированных словах о любви как революции («Вешние воды»). Воодушевленные герои радостно летят на свет борьбы, готовые к жертве, гибели и победе.
В «Накануне» впервые любовь предстала как единство в убеждениях и участие в общем деле. Здесь была опоэтизирована ситуация, характерная для большого периода последующей жизни русского общества и имевшая огромное значение как выражение нового этического идеала. Прежде чем соединить свою жизнь с ее жизнью, Инсаров подвергает Елену своеобразному «экзамену», предвосхищающему символический «допрос», которому подвергает таинственный голос судьбы смелую девушку-революционерку в стихотворении в прозе Тургенева «Порог». При этом герой «Накануне» вводит любимую девушку в свои планы, свои интересы и заключает с ней своеобразный договор, предполагающий с ее стороны сознательную оценку их возможной будущности, — черта отношений, характерная для демократов-шестидесятников.
Любовь Елены и ее благородная решимость разрушают аскетическую замкнутость Инсарова, делают его счастливым. Добролюбов особенно ценил страницы романа, где изображалась светлая и счастливая любовь молодых людей. В уста Шубина Тургенев вложил лирическую апологию идеала героической молодости: «Да, молодое, славное, смелое дело. Смерть, жизнь, борьба, падение, торжество, любовь, свобода, родина… Хорошо, хорошо. Дай бог всякому! Это не то, что сидеть по горло в болоте да стараться показывать вид, что тебе всё равно, когда тебе действительно в сущности всё равно. А там — натянуты струны, звени на весь мир или порвись!» (VIII, 141).
Как вычислить объем металла
Школьникам известна задача, которую поставил когда-то сиракузский царь Гиерон перед великим ученым Архимедом. Вроде и не такая уж сложная она была: определить, из чистого ли золота сделана царская корона или ювелир подменил часть золота более дешевым металлом. Но для ответа на вопрос царя потребовалось вычислить объем этой самой короны. И вот тут-то Архимед призадумался: а как это сделать? Корона же сложной формы.

Инструкция
Самый простые условия вычисления объема металла – если металлический предмет имеет правильную геометрическую форму. Тогда вам надо всего лишь точно измерить его габариты: длину, ширину и высоту если это четырехугольный брусок, диаметр – если это шар, диаметр и высоту – если цилиндр и т.д. А потом произвести вычисления, с помощью соответствующих формул. Вот так вы и найдете его объем.
А если форма предмета весьма далека от правильной геометрической? И тут нет ничего сложного. Как известно, масса, плотность и объем любого вещества связаны формулой М=ρV. Таким образом, если вам известна масса металлического предмета и его плотность, определить объем металла проще простого: V=M/ρ.
Если же масса предмета неизвестна вам, определите ее путем взвешивания (чем более точные весы, тем лучше). Величина же плотности металла находится по любому техническому или физическому справочнику. А дальше произведите вычисление по вышеуказанной формуле и получите ответ. Задача решается в одно действие. Разумеется, это справедливо только в том случае, если вы имеете дело с практически чистым металлом – то есть, если содержание примесей в нем настолько мало, что ими можно пренебречь.
Ну, а если вы фактически оказались в положении Архимеда, то есть имеете кусок неизвестного металла очень сложной формы. Задача и в этом случае решается очень легко. Достаточно вспомнить, как вышел из этого положения гениальный ученый. Он дважды взвесил корону – сначала в воздухе, потом в воде. И по разнице в ее весе определил выталкивающую силу, которая численно равна весу воды в объеме короны. Зная же плотность воды, он тут же определил, какой ее объем вытеснила корона. Вам ничто не мешает последовать примеру Архимеда.
Можно точно так же дважды взвесить металлический предмет – в воздухе и в воде. А, если он сравнительно небольшой по размеру, можно упростить вашу задачу. Для этого надо поместить предмет в широкий мерный цилиндр, заполненный водой, и посмотреть, на сколько делений поднимется ее уровень. Зная, что плотность воды практически равна единице, вы тут же определите объем этого предмета.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
