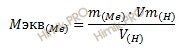Как вычислить эквивалентные массы оксида и металла
Эквивалент – такое количество химического элемента, которое либо связывает, либо замещает один моль атомов водорода. Соответственно, масса одного эквивалента называется эквивалентной массой (Мэ), и выражается в г/моль. Перед учащимися на химии часто ставят задачу определить эквивалентную массу того или иного вещества (соединения). Например, металла и образованного им оксида.

Инструкция
В первую очередь следует запомнить несколько простых правил. Если речь идет о металле, его эквивалентная масса рассчитывается по формуле: Мэ=М/В, где М – атомная масса металла, а В – его валентность. Рассмотрите это правило на конкретных примерах.
Кальций (Са). Его атомная масса 40,08. Округленно примите ее за 40. Валентность равна 2. Следовательно, Мэ(Са) = 40/2 = 20 г/моль. Алюминий (Al). Его атомная масса 26,98. (Округленно 27). Валентность равна 3. Таким образом, Мэ(Al) = 27/3 = 9 г/моль.
Перечисленные способы применимы, если речь идет о чистых металлах. А если они входят в состав какого-либо соединения, например, тех же оксидов? Тут надо запомнить другое правило: эквивалентная масса оксида вычисляется по формуле: Мэ + Мо, где Мо – эквивалентная масса кислорода. Она, соответственно, рассчитывается по уже рассмотренной формуле М/В, то есть 16/2 = 8.
Предположим, у вас есть основной оксид алюминия, Al2O3. Как посчитать его эквивалентную массу? Очень просто: 27/3 + 16/2 = 17 г/моль.
Есть ли другой способ определения эквивалентных масс металла и его оксида? Да, и весьма эффективный. Он основан на так называемом законе эквивалентов, согласно которому все вещества реагируют друг с другом в эквивалентных количествах. Например: металл массой 33,4 грамма вступил в реакцию окисления с кислородом воздуха. В результате получился оксид общей массой 43 грамма. Требуется определить эквивалентные массы самого металла и его оксида.
Сначала вычислите, сколько кислорода соединилось с металлом в ходе этой реакции: 43 – 33,4 = 9,6 грамм. Согласно закону эквивалентов, эта масса во столько же раз больше эквивалентной массы кислорода (которая, напомним, равна 8), во сколько раз эквивалентная масса металла меньше его первоначального количества. То есть 33,4/Мэ(ме) = 9,6/8. Следовательно, Мэ(ме) = 33,4*8/9,6 = 27,833 г/моль, или округленно 27,8 г/моль. Такова эквивалентная масса металла.
Эквивалентную же массу оксида найдите следующим действием: 27,8 + 8 = 35,8 г/моль.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение молярной массы эквивалента металла
Цель работы: усвоить
понятия химического эквивалента,
молярной массы эквивалента, закона
эквивалентов; ознакомиться с
экспериментальным определением молярной
массы эквивалента металла методом
вытеснения водорода из кислоты.
Теоретическая часть
Известно,
что количество вещества определяется
числом структурных единиц (атомов,
молекул, ионов) этого вещества и выражается
в молях.
Моль ()– это единица количества вещества,
содержащая столько же структурных
единиц данного вещества, сколько атомов
содержится в 0,012 кг углерода, состоящего
только из изотопа12С.
Молярная
масса (М) вещества
представляет собой отношение массы
вещества (m) к его количеству (),
а значение молярной массы численно
совпадает с относительной молекулярной
массой вещества или относительной
атомной массой элемента, но измеряется
в г/моль.
Эквивалентом
вещества (э),
вступающего в какую-либо реакцию,
называют такое его количество, которое
приходится на единицу валентности
соответствующего элемента при образовании
им соединения.
Химический
эквивалент и молярная масса эквивалента
представляют собой важнейшие характеристики
элементов, простых и сложных веществ,
учитывая то, что согласно закону
эквивалентов
все вещества взаимодействуют между
собой в эквивалентных количествах.
Единицей
химического эквивалента (э),
так же как и количества вещества является
моль,
а молярная
масса эквивалента (Мэ),
соответственно измеряется в г/моль.
Так,
водород в своих соединениях, как правило,
одновалентен, и его эквивалент равен 1
моль Н или 1/2 моль Н2,
а молярная масса его эквивалента Мэ(Н)
= 1 г/моль.
Кислород
в своих соединениях двухвалентен, тогда
его эквивалент равен 1/2 моль О или 1/4
моль О2,
а молярная масса его эквивалента Мэ(О)
= 8 г/моль.
Железо
в своих соединениях может быть и двух-,
и трехвалентным, тогда его эквивалент
в первом случае будет равен 1/2 моль Fe, а
молярная масса эквивалента Мэ(Fe) = 28
г/моль. Эквивалент железа во втором
случае будет равен 1/3 моль Fe, а молярная
масса эквивалента Мэ(Fe) = 18,6 г/моль.
Следовательно, молярную массу эквивалента
простого вещества можно рассчитать по
формуле:
, (1)
где М(эл-та)
– молярная масса элемента;
В(эл-та)
– валентность элемента.
Молярные
массы эквивалентов сложных веществ
(оксидов, кислот, оснований, солей)
рассчитываются несколько иначе.
Молярная
масса эквивалента оксида
рассчитывается отношением молярной
массы оксида к произведению числа атомов
элемента на его валентность.
,
где М(оксида)
– молярная масса оксида;
n(эл-та) –
число атомов элемента;
В(эл-та) –
валентность элемента.
Для
оксида железа (Ш), например, молярная
масса его будет равна:
Молярная масса
эквивалента кислотырассчитывается
отношением молярной массы кислоты к
числу атомов водорода в кислоте, способных
замещаться в химических реакциях.
,
где М
(кислоты) – молярная масса кислоты;
n
(H) – число замещающихся в химической
реакции атомов водорода.
Для серной
кислоты (H2SO4),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента основания
рассчитывается отношением молярной
массы основания к числу гидроксогрупп.
,
где
М (основания) – молярная масса основания;
n
(OH) – число гидроксогрупп.
Для
гидроксида кальция (Ca(OH)2),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента соли
рассчитывается отношением молярной
массы соли к произведению числа атомов
металла на их валентность.
,
где М
(соли) – молярная масса соли;
n (Ме) –
число атомов металла;
В (Ме) – валентность
металла.
Для
сульфата натрия (Na2SO4),
например, молярная масса эквивалента
будет равна:
Из
закона
эквивалентов
следует, что массы вступающих и
образующихся в результате реакции
веществ прямопропорциональны молярным
массам их эквивалентов:
, (2)
где
m(1)
и Мэ(1)
– масса и молярная масса эквивалента
первого вещества;
m(2)
и Мэ(2)
– масса и молярная масса эквивалента
второго вещества.
Из
следствия из закона Авогадро вытекает
понятие молярный
объем – объем,
который занимает 1 моль любого газа при
нормальных условиях, т.е. при р = 105
Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0о
С). Значение
этого объема равно 22,4 л/моль (22400 мл/моль).
Отсюда можно вывести понятие и молярного
объема эквивалента
газа (или эквивалентного объема) –
объема, занимаемого при нормальных
условиях одним эквивалентом (одной
молярной массой эквивалента) газа.
Известно,
что эквивалент водорода равен 1/2 моль
Н2,
тогда молярный объем эквивалента
водорода Vэ(Н2)
= 11,2 л/моль; соответственно Vэ(О2)
= 5,6 л/моль, т.к. эквивалент кислорода
равен 1/4 моль О2.
Если
же в реакции участвуют газы и известны
их объемы, то соотношение (2) можно
представить следующим образом:
(3)
где m(1)
и Мэ(1) –
масса и молярная масса эквивалента
первого вещества;
V(2)
и Vэ(2) –
объем и молярный объем эквивалента
второго вещества.
Следует
иметь ввиду, что объемы, входящие в
соотношение (3), нужно приводить
к нормальным условиям
по формуле объединенного закона
Гей-Люссака – Бойля –Мариотта:
,
откуда(4)
где р,
V, Т –
давление, объем и температура газа при
условиях опыта;
ро,
Vо,
То
– давление, объем и температура газа
при нормальных условиях.
Известны
методы экспериментального определения
молярных масс эквивалентов: 1) метод
прямого определения – молярную массу
эквивалента определяют по данным прямого
синтеза кислородного или водородного
соединения данного элемента; 2)
аналитический метод – производится
точный анализ соединения данного
элемента с любым другим, молярная масса
эквивалента которого известна; 3) метод
вытеснения водорода – используется для
определения молярной массы эквивалента
тех металлов, которые способны вытеснить
водород из разбавленных кислот и щелочей;
4) электрохимический метод – определяется
масса металла, осаждающегося на электроде
при электролизе раствора соли этого
металла. Молярная масса эквивалента
рассчитывается по закону Фарадея: при
прохождении через раствор или расплав
электролита 965000 Кулонов электричества
на электродах выделяется по одному
эквиваленту вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
Сущность
экспериментального определения молярной
массы эквивалента металла заключается
в определении объема водорода (приведенного
к нормальным условиям), вытесняемого
из кислоты навеской металла, взятой на
аналитических весах.
Произведением
молярной массы эквивалента металла на
его валентность определяют молярную
массу атома металла.
По
молярной массе атома металла и его
валентности находят местоположение
металла в периодической системе элементов
Д.И.Менделеева, т.е. его название.
По
указанию преподавателя студент взвешивает
на аналитических весах навеску металла
известной валентности.
Прибор
для определения молярной массы эквивалента
изображен на рисунке.
П
еред началом работы прибор следует
проверить на герметичность. Для этого
отсоединяют пробирку А от прибора, через
воронку С заливают водой таким образом,
чтобы уровень воды в бюретке В установился
на нулевом делении или несколько ниже;
избыток воды удалить. Присоединяют
пробирку А на место. Затем поднимают
воронку C вверх и следят за уровнем воды
в бюретке В. Если уровень в последней
непрерывно повышается, то это означает,
что прибор негерметичен и следует
проверить все резиновые соединения.
Если же прибор герметичен, то повышение
уровня воды в бюретке В произойдет
незначительно только в первый момент,
а потом он будет оставаться неизменным.
Убедившись
в герметичности прибора, отсоединяют
пробирку А от прибора и, записав начальный
уровень воды в бюретке В, наливают в
пробирку А 1/4 ее объема соляной кислоты,
приготовленной для определения молярной
массы эквивалента металла соответствующей
валентности.
Держа
пробирку А в положении, близком к
горизонтальному, помещают на сухое
место у отверстия пробирки взвешенный
металл и в таком положении соединяют
пробирку А с бюреткой В, следя за тем,
чтобы металл не упал в кислоту.
Убедившись
вторично
в герметичности прибора путем поднятия
воронки С вверх, стряхивают металл в
кислоту и наблюдают за ходом реакции.
По
окончании реакции (прекращение выделения
пузырьков водорода), устанавливают
уровень воды в бюретке В и воронке С на
одной высоте, перемещая кольцо К с
воронкой С вниз по штативу, и записывают
уровень воды в бюретке В после окончания
опыта. Шкала бюретки В проградуирована
в миллилитрах (мл).
С
помощью барометра определяют величину
атмосферного давления ( ратм ),
термометра – температуру ( t ) воздуха
в помещении (соответственно и температуру
воды в приборе) в момент проведения
опыта.
С
помощью таблицы 1 определяют давление
водяного пара ( рН2Опар ),
соответствующего измеренной температуре
опыта, в мм рт.ст.
Таблица
1
Зависимость
давления водяного пара от температуры
|
t |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
рН2Опар |
12,8 |
13,6 |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,8 |
Порядок расчета
-
Определите
объем выделившегося водорода в результате
опыта. Для этого от значения уровня
воды в бюретке В после окончания опыта
( V2
) следует вычесть значение уровня воды
в бюретке В в начале опыта ( V1
).
V(Н2)
= V2
– V1.
Переведите
значение объема выделившегося в
результате опыта водорода в кубические
дециметры, учитывая, что 1 см3
= 10 –3
дм3.
-
Приведите
экспериментальный объем выделившегося
водорода к нормальным условиям,
воспользовавшись формулой 4. Следует
учесть, что давление внутри бюретки В
складывается из давления водорода и
давления водяного пара внутри объема
бюретки при данной температуре:
ратм
= рН2
+ рН2Опар
, тогда
где ратм
– измеренное атмосферное давление во
время проведения опыта;
рН2Опар –
давление водяного пара при температуре
опыта;
V
(Н2) –
экспериментальный объем водорода;
Т
– температура проведения опыта (К),
равная (273+t);
ро,
То
– давление и температура при нормальных
условиях.
-
Вычислите
молярную массу эквивалента металла, с
точностью до 0,1 г/моль, воспользовавшись
формулой 3:
4. Воспользовавшись
формулой 1, рассчитайте молярную массу
металла и укажите какой это металл.
Результаты
эксперимента представьте в виде таблицы
2.
Таблица
2
|
масса |
pатм, мм |
t, |
V1,, |
V2, |
V(H2), |
pH2Oпар, мм |
V0(H2), |
Мэ |
М |
5. Вычислите
величины абсолютной и относительной
ошибок (Х).
Абсолютная
ошибка:
Хабс.
= М (Ме)
табличное – М
(Ме)
экпериментальное
Относительная
ошибка:
Вопросы для
самоконтроля
1. Что
называется эквивалентом вещества?
-
Что
является единицей эквивалента вещества? -
Какую
размерность имеет молярная масса
эквивалента вещества? -
Какие
значения имеют молярные массы эквивалентов
водорода и кислорода? -
Как
можно рассчитать молярную массу
эквивалента элемента? -
Что
такое молярный объем и молярный объем
эквивалента? -
Какие
значения имеют молярные объемы
эквивалентов водорода и кислорода? -
Как
формулируется закон эквивалентов? -
Почему
при выполнении расчетов в экспериментальной
части работы нужно знать давление
водяного пара? -
Какие
Вы знаете методы экспериментального
определения молярной массы эквивалента
металлов?
Задачи
-
Медь
с кислородом образует два соединения,
в которых содержится 79,9 % меди и 20,1 %
кислорода, и 88,8 % меди и 11,2 % кислорода.
Определите молярные массы эквивалентов
меди в этих соединениях и составьте
формулы этих соединений. -
При
сгорании 3 г магния образовалось 5 г
оксида магния. Рассчитайте молярную
массу эквивалента магния. -
При
взаимодействии 2,4 г углерода с кислородом
образовалось 5,6 г оксида. Определите
молярную массу эквивалента углерода
в этом соединении и напишите уравнение
реакции. -
При
взаимодействии 4 г двухвалентного
металла с кислородом образовалось 5,6
г оксида. Определите, какой это металл
и напишите уравнение реакции. -
При
растворении в соляной кислоте 5,4 г
трехвалентного металла выделилось
6,72 л водорода, измеренного при н.у.
Определите, какой это металл и напишите
уравнение реакции. -
При
взаимодействии одновалентного металла
с 0,2 г водорода образовалось 4,8 г гидрида
металла. Определите, какой это металл
и напишите уравнение этой реакции. -
При
окислении 8 г металла, проявляющего
валентность, равную I, получено 9 г
оксида. Определите, какой это металл и
напишите уравнение данной реакции. -
Рассчитайте
объем водорода, выделившегося при
растворении в соляной кислоте 18 г
металла, молярная масса эквивалента
которого равна 9 г/моль. -
При
взаимодействии 0,9 г трехвалентного
металла с серой образовалось 2,5 г
сульфида металла. Определите, какой
это металл, учитывая, что молярная масса
эквивалента серы в этом соединении 16
г/моль. Напишите уравнение соответствующей
реакции. -
При
окислении 6,4 г серы образовалось 16 г
оксида. Определите молярную массу
эквивалента серы в этом соединении и
напишите уравнение соответствующей
реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание
- Как найти атомную массу металла через эквивалент
- Как найти атомную массу металла через эквивалент
- Определение эквивалентной и атомной массы металла 628
- Определение химического эквивалента, эквивалентной и атомной массы металла
Определение.
Химический эквивалент — условная частица, в целое число раз меньшая, или равная, соответствующей ей формульной единицы — атома, молекулы, иона и т.д.
Грубо говоря, без учета определения и ряда оговорок, это частица вещества, соответствующая одной единице валентности.
Как это отражается на массе эквивалентных частиц?
ZnCl2. Двухалентный цинк, Э = 1/2 молярной массы.
AlCl3. Трехвалентный алюминий, Э = 1/3 М.
Al2(SO4)3. Два трехвалентных алюминия, Э = 1/(2*3) = 1/6 М.
CrO3. Шестивалентный хром, Э = 1/6 молярной массы.
Число 1/2, 1/3, 1/6, т.е. число, показывающее, какая часть молекулы (молярной массы) соответствует одному эквиваленту, называются фактор эквивалентности, f.
Видно, что молярную массу эквивалента можно найти по формуле:
Мэ = Mr*f, где Mr — молярная масса вещества, но так же может быть атомная масса, масса иона и т.д.
Для водорода эквивалентная масса составит mэ = 2*(1/2) = 1 г-экв. f = 1/2, поскольку каждый атом водорода соответствует одной единице валентности (одному эквиваленту), а молекула водорода двухатомна.
Эквивалентный объем составит Vэ = Vм * f = 22,4*(1/2) = 11,2 л/моль-экв.
Для кислорода эквивалентная масса составит mэ = 32*(1/4) = 8 г-экв. f = 1/4, поскольку каждый атом кислорода соответствует двум единицам валентности (двум эквивалентам, кислород двухвалентен), а молекула кислорода двухатомна.
Эквивалентный объем составит Vэ = Vм * f = 22,4*(1/4) = 5,6 л/моль-экв.
Отсюда выведем другое определение:
Химический эквивалент — это массовое количество хим. элемента или сложного в-ва, соединяющееся с 1 массовой частью водорода или 8-ю массовыми частями кислорода или заменяющее их в хим. соединениях.
Вещества реагируют друг с другом в количествах, равных их эквивалентвм, nэ(А) = nэ(В).
Некоторую особенность имеет определение эквивалентных масс веществ, участвующих в ОВР.
В этом случае масса эквивалента есть отношение массы вещества к количеству отдаваемых или принимаемых электронов.
Мэ = M/n(e).
Примеры.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Железо отдает 1 электрон: Fe +2 — e = Fe +3
Mэ = M(FeSO4)/1 = M(FeSO4)
Марганец принимает 5 электронов:
Mn +7 + 5e = Mn +2
Мэ(KMnO4) = М(KMnO4)/5
Хром принимает 6 электронов, Мэ(K2Cr2O7) = Mr(K2Cr2O7)/6
Сера (суммарно в составе молекулы) отдает 8 электронов, Мэ = М(Na2S2O3)/8
Источник
1) Точную атомную массу металла (А) можно определить по формуле:
A = Mэ · В (формула 1)
где В – валентность металла
Mэ – его эквивалентная масса, в г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость, для чего пользуются правилом Дюлонга и Пти: произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково и равно:
Показать полностью.
СА = А · С ≈ 26,8 Дж/моль·К
где СА — атомная теплоемкость металлов — количество тепла, необходимого для нагревания 1 моля атомов металла на один градус (Кельвин)
С – удельная теплоемкость металла, Дж/г·К
А – приблизительная атомная масса взятого металла, г/моль
Я уверена, что в задаче есть ошибка в размерности: удельная теплоемкость не 477.32 кДж, а 477.32 Дж/кг·К = 0,47732 Дж/г·К (сравни: http://www.cryocatalog.ru/info/ud_teplmet.php)
тогда: А прибл.= СА/С = 26,8 Дж/моль·К / 0,47732 Дж/г·К = 56,1 г/моль
100 г бромида содержат 100 — 74,42 = 25,58 г металла.
Согласно закону эквивалентов отношение массы металла и массы
брома в соединении (25,58 : 74,42) должны быть равны отношению их
эквивалентных масс.
Экв. масса брома в задаче не дана, но ее можно найти: эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. Валентность брома в соединениях с металлами I (СО -1), поэтому
экв. масса брома равна ее атомной массе, т.е. 79,904 г/моль, тогда молярная масса эквивалента металла
Мэ = 25,58 : 74,42 · 79,904 = 27,465 г/моль
Зная приближенную атомную массу металла и его эквивалентную массу, можно по формуле (1) найти валентность этого металла, округлив до целого числа:
валентость=А прибл./Мэ=56,1 г/моль : 27,465 г/моль = 2,04 ≈ 2
Точная молярная масса металла:
Aточн. = 27,465 г/моль · 2 = 54,93 г/моль (т.е. это Mn)
Источник
Определение эквивалентной и атомной массы металла  628
628
Цель работы
Установление эквивалентной и атомной массы неизвестного металла.
Теоретическая часть
Раздел химии, посвященный изучению количественных соотношений между реагирующими веществами, называется стехиометрией. Стехиометрические расчеты базируются на нескольких фундаментальных законах.
Закон сохранения массы веществ (М.В. Ломоносов, 1748 – 1756 г.г., А. Лавуазье, 1777 г.): «Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции».
Закон постоянства состава (Ж.Л. Пруст, 1801г.): «Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав».
Из закона постоянства состава следует, что элементы взаимодействуют между собой в строго определенных количественных соотношениях. Поэтому можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
Эквивалентом называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-всстановительных реакциях.
В общем случае эквивалент любого вещества X может быть записан как (1/Z)X, где Z – число эквивалентности, равное тому количеству ионов водорода в кислотно-основных реакциях, или электронов в окислительно-восстановительных реакциях, которое эквивалентно частице X. Для кислот, оснований, солей число эквивалентности Z равно соответственно основности, кислотности или количеству элементарных зарядов катионов или анионов, а для элемента – степени окисления, проявляемой им в данном соединении.
Масса 1 моля вещества эквивалента (1/Z)X называется молярной массой эквивалента М[(1/Z)X] и представляет собой отношение массы m вещества X к количеству вещества эквивалента n[(1/Z)X]:
М[(1/Z)X] = 
Молярная масса вещества X и молярная масса эквивалента (1/Z)X связаны следующим соотношением:
М[(1/Z)X] =
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Так для реакции:
| aА + | bВ + | cС + | dD |
| m(A) | : m(B) | : m(C) | : m(D) |
М  |
:М  |
:М  |
:М  |
Иначе говоря, массы взаимодействующих без остатка веществ относятся друг к другу, как их эквивалентные массы:
Эквивалентные массы элементов и соединений используются при выражении концентрации растворов (молярная концентрация эквивалентов), при оценке жесткости воды, в расчетах по электролизу и т. д.
Через эквивалентную массу элемента может быть определена его атомная масса, так как они связаны между собой соотношением:


где В – валентность элемента.
При этом эквивалентная масса определяется экспериментально, а атомная масса рассчитывается приблизительно по закону Дюлонга-Пти, который гласит: атомная теплоемкость (т.е. произведение удельной теплоемкости С и атомной массы Аr) простых веществ в твёрдом состоянии примерно одинакова и составляет в среднем около 26 Дж/(моль⋅К), то есть C·Аr ≈ 26.
Разделив приблизительную атомную массу на эквивалентную массу, получают валентность элемента, которую округляют до ближайшего целого числа. После этого умножением эквивалентной массы на валентность получают более точное значение атомной массы.
Пример 1. Один атом хлора соединяется с одним атомом водорода, образуя хлороводород (НСl). Следовательно, эквивалент хлора в этом соединении равен 1.
Пример 2. Кислород с водородом образует два соединения: Н2О2 (пероксид водорода) и Н2О (вода). В первом соединении эквивалентом кислорода является его атом и эквивалентная масса равна шестнадцати, а во втором – эквивалентом кислорода является 1/2 атома и эквивалентная масса равна восьми.
Пример 3. Серная кислота содержит два атома водорода. В реакции замещения одного из них эквивалентом кислоты является её молекула с эквивалентной массой 98, а в реакции замещения двух атомов водорода – половинка молекулы (условная частица) с эквивалентной массой 49.
Пример 4. При взаимодействии 59,5 мг металла с серной кислотой выделилось 21,9 мл водорода (объем измерен при температуре 17°С и давлении750 мм рт. ст.). Удельная теплоемкость металла 0,39 Дж/(г·К). Вычислить атомную массу металла и определить, какой это металл.
1) Переводим экспериментальные данные в систему СИ:


2) По уравнению Менделеева-Клапейрона вычисляем массу водорода:

3) По закону эквивалентов определяем эквивалентную массу металла:

4) По закону Дюлонга-Пти находим приблизительную атомную массу металла:

5) Определяем приблизительное значение валентности
и округляем его до целого числа 2.
6) Рассчитываем точную атомную массу:
По периодической системе определяем металл – это цинк.
Приборы и реактивы
2. Весы аналитические,
5. Анализируемый металл,
6. Серная кислота,
7. Вода дистиллированная.
Порядок выполнения работы
Эквивалентная масса металла определяется по водороду, который выделяется при взаимодействии металла с серной кислотой. Теплоемкость металла сообщает преподаватель. Взвешивание металла производится с точностью 0,001 г на аналитических весах.
Опыт проводится на приборе, называемом эвдиометром, изображенном на рисунке 2.
Рисунок 2. Схема установки для определения эквивалентной массы металла: 1 – штатив, 2 – пробирка, 3 – зажим, 4 – уравнительная воронка, 5 – колба Вюрца, 6 – мерная бюретка.
Установка собрана на химическом штативе (1). Она состоит из стеклянного реакционного сосуда (4), в котором находится кислота, мерной бюретки (5) для сбора выделяющего водорода и уравнительной воронки (6). Реакционным сосудом (4) является колба Вюрца объемом 50 мл с присоединенной пробиркой (2). Они соединены поливинилхлоридной трубкой, которую можно пережимать съемным зажимом (3).
Источник
Определение химического эквивалента, эквивалентной и атомной массы металла
Федеральное агенство образования и науки Российской Федерации
Саратовский государственный технический университет
ЭКВИВАЛЕНТНОЙ И АТОМНОЙ
для студентов всех специальностей
Одобрено редакционно-издательским советом Саратовского государственного технического университета
1. Ознакомить студентов с основными химическими законами и единицами массы.
2. С помощью математической обработки полученных студентами экспериментальных данных сделать вывод о названии металла, данного для работы и его положении в периодической таблице .
Вспомним основные частицы вещества.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из атомов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Химический элемент можно определить как вид атомов, характеризующийся определенной совокупностью свойств.
Простейшим примером может служить молекула хлористого водорода (HCl). Водород и хлор, вступая в реакцию, теряют свои свойства, характерные для газообразных Н2 и Cl2, поэтому считается, что в состав хлористого водорода входят элементы: водород и хлор. В молекуле данного соединения на один атом элемента водорода приходится один атом элемента хлора.
Масса атомов и молекул выражается в относительных атомных единицах массы (а. е.м.), принятых в 1961 г. За одну относительную атомную единицу массы принимается 1/12 часть массы атома изотопа углерода 12С. Таким образом, масса атома или молекулы любого вещества представляется относительной величиной, показывающей, во сколько раз масса данного атома (молекулы) тяжелее выбранной атомной единицы массы. Относительную атомную массу обозначают Аr. Например,
Аналогично относительную молекулярную массу веществ обозначают Мr, например, Мr(Н2О) = 2Аr(Н) + Аr(О) = 2 + 16 =18.
Аr и Мr – величины, которые не имеют единиц измерения.
При решении задач и в расчетах по уравнениям реакций гораздо чаще пользуются понятием «моль».
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 граммах изотопа углерода 12C.
В одном моле любого вещества содержится совершенно одинаковое количество структурных единиц. Это число называют числом Авогадро и принимают его значение равным 6,02∙1023.
Применяя слово «моль», необходимо в каждом случае точно указывать, какие единицы входят в данное вещество. Существуют понятия «моль атомов», «моль молекул» и т. д. Масса одного моля взятого вещества называется его молярной массой. Она выражается в г/моль.
Числовое значение молярной массы вещества в г/моль равно относительной молекулярной массе Mr, если вещество состоит из молекул, или относительной атомной массе Ar, если вещество состоит из атомов. Например, молярная масса атомарного кислорода равна – 16 г/моль, молекулярного кислорода – 32 г/моль.
Часто в химических расчетах используется понятие эквивалента.
Эквивалентом вещества называется такое его количество, которое соединяется без остатка с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Например, в соединениях HCl, H2S и NH3 эквивалент элементов хлора, серы и азота соответственно равен 1 моль, 1/2 моль и 1/3 моль. Масса одного эквивалента называется его эквивалентной массой или молярной массой эквивалента. Выражается в г/моль.
Так, в приведенном примере эквивалентные массы хлора, серы и азота легко подсчитать, используя молярные массы атомов этих элементов, они соответственно равны:
mэ(Cl) = 35,5 г/моль; mэ(S) = 32:2 = 16 г/моль; mэ(N) = 14:3 = 4,7 г/моль.
Из разобранных примеров видно, что эквивалентная масса элемента находится из соотношения:
Эквивалентная масса 

Понятие об эквивалентах и эквивалентных массах распространяется также на сложные вещества. Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или вообще с одним эквивалентом любого другого вещества.
1. Эквивалентная масса оксида складывается из значений эквивалентных масс, составляющих оксид элементов.
Примеры: а) ZnO: эквивалентные массы металла и кислорода соответственно равны половине молярных масс атомов:



б) SO3. Валентность серы в оксиде равна 6, следовательно,


2. Эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты (число атомов водорода в молекуле кислоты).
Примеры: а) HNO3. Молярная масса – 63 г/моль. Кислота одноосновная, следовательно, эквивалентная масса равна: 63:1 = 63 г/моль.
б) H3PO4. Молярная масса равна 98 г/моль. Основность равна 3.

3. Эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание.
Пример: Mg(OH)2. Молярная масса его – 58 г/моль. Эквивалентная масса равна: 58 : 2 = 29 г/моль.
4. Эквивалентная масса соли равна отношению ее молярной массы к произведению валентности металла на число его атомов в молекуле.
Примеры: а) Na2CO3. Молярная масса соли 106 г/моль. Валентность металла 1, число его атомов 2. Эквивалентная масса Na2CO3:

б) Al2(SO4)3 Молярная масса – 342 г/моль:

5. Эквиваленты одних и тех же сложных веществ и их эквивалентные массы могут иметь различные значения, если их рассматривать не как отдельные вещества, а составные части химических реакций, в которых они участвуют.
Так, в примерах: эквивалент H2CO3 и его масса зависят от количества атомов водорода, участвующих в реакции, и соответственно равны:
H2CO3 + 2NaOH = Na2CO3 + 2H2O;


H2CO3 + NaOH = NaHСO3 + H2O;

В реакциях Cr(OH)3 с соляной кислотой на кислотный остаток было замещено различное число гидроксидных групп. Поэтому эквивалент и его масса будут различаться.
Cr(OH)3 + 2HCl = CrOHCl2 + 2H2O;


Cr(OH)3 + 3HCl = CrCl3 + 3H2O;


Известно несколько способов определения эквивалента.
I. Прямое или непосредственное определение эквивалента из соединения элементов с водородом или кислородом.
Пример 1. Рассчитать эквивалент железа в его оксиде FeO.
Эквивалент кислорода по определению равен 1/2 моля атомов, эквивалентная масса кислорода равна: 16 : 2 = 8 г/моль. В данном соединении на ½ моля атомов кислорода приходится столько же, т. е. 1/2 моля атомов железа. Следовательно, эквивалент железа в данном оксиде равен ½ моля, а его эквивалентная масса: 56 : 2 = 28 г/моль.
II. Определение эквивалента с помощью закона эквивалентов.
Закон эквивалентов (эквивалентных масс), предложенный в 1803-1814 гг. Дальтоном и Рихтером: Элементы и вещества соединяются друг с другом, а также замещают друг друга в химических реакциях в строго определенных весовых количествах, прямо пропорциональных их эквивалентам.
Математическая запись закона такова:

где m1 и m2 – массы взаимодействующих элементов или веществ, г;
mЭ1 и mЭ2 – соответственно эквивалентные массы этих веществ,
Пример 2. Определить эквивалентную и молярную массы трехвалентного металла, зная, что 0,52 г его при окислении образуют 0,98 г оксида.
Решение: В соответствии с законом эквивалентов

Массу кислорода определим по разности масс оксида и металла:
mO = 0,98 – 0,52 = 0,46 г.
Эквивалентная масса кислорода известна, она равна 8 г/моль.

Т. к. валентность металла равна 3, то его молярная масса
A = mэ(Me) · В = 9,0 · 3 = 27 г/моль.
Пример 3. Вычислите эквивалентную массу металла, если в его хлориде массовая доля хлора 79,78 %, эквивалентная масса хлора 53,45 г/моль.
Решение: Массовая доля w металла в хлориде равна:
w = 100 — 79,78 = 20,22 %.
Согласно закону эквивалентов отношение массы металла и массы хлора в соединении (20,22 : 79,78) должно быть равно отношению их эквивалентных масс:

Отсюда 
Пример 4. Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
Решение: Эквивалентная масса оксида металла равна:
mэ(MeO) = mэ(Me) + mэ(O) = mэ(Me) + 8.
Эквивалентная масса сульфата металла равна:

Согласно закону эквивалентов

mэ(Me) = 27,5 г/моль.
Т. к. валентность металла равна 2, то его молярная масса равна:
A = 27,5 · 2 = 55 г/моль.
III. Если в химической реакции одно из участвующих веществ находится в газообразном состоянии, то запись закона эквивалентов выражается формулой:

где m(Me) и mэ(Me) – соответственно масса металла и его эквивалентная
V и Vэ – объем вступившего в реакцию газа и объем эквивалентной
массы этого газа.
Для расчета объемов реагирующих газов необходимо знание закона Авогадро и его следствий.
Закон Авогадро (1911): В равных объемах различных газов при постоянных температуре и давлении содержится одинаковое число молекул.
Следствия из закона Авогадро:
1. Один моль любого газа при нормальных условиях (н. у. — температура 0 ºС и давление 760 мм рт. ст.) занимает один и тот же объем, равный 22,4 литра. Этот объем называют – молярным объемом газа: Vm = 22,4 л/моль.
2. Один моль любого газа содержит одно и то же число молекул, а именно 6,02 · 1023.
3. Относительная плотность одного газа по другому равна отношению их молярных (M) или относительных молекулярных масс:

На основании этих следствий можно проводить различные расчеты:

где ν – количество моль вещества.
Пример 5. Рассчитать массу 3 л хлора, взятого при н. у.
Решение: Т. к. молярная масса хлора (Cl2) равна 35,5 ∙ 2 = 71 г/моль, то из пропорции легко найти массу искомого объема:


Пример 6. Сколько молей и сколько молекул содержится в 2,2 г углекислого газа? Какой объем они занимают при н. у.?
Решение: Т. к. молярная масса углекислого газа (СО2) равна 44 г/моль, то




Найдем объем газа при н. у.:


Пример 7. Определите массу молекулы газа, если масса 2 л газа (н. у.) равна 0,357 г.
Решение: Исходя из молярного объема газа определим молярную массу газа:


Число молекул в 1 моль любого вещества равно постоянной Авогадро. Следовательно, масса молекул газа m равна:

Первое следствие из закона Авогадро позволяет рассчитать объемы эквивалентных масс различных газов.
Так, если эквивалентная масса водорода равна 1,008 г/моль, то её объем равен:


Подобным образом находится объем эквивалентной массы О2, который оказывается равным:

Пример 8. При растворении 0,506 г металла в серной кислоте выделилось 100,8 мл водорода, измеренного при н. у. Определить эквивалентную массу металла.
Задачу можно решить двумя способами:
а) прямой, подстановкой данных в (2):


где mэ(H) = 1,008 г/ моль.
Для решения задачи в этом случае надо найти m(H2). Согласно следствию из закона Авогадро


Теперь найденное значение m(H) подставим в (1):

Значения эквивалентных масс позволяют определить атомную массу металлов по формуле:
Где В – валентность металла;
А – его молярная масса атома, г/моль.
Если же валентность металла неизвестна, то атомную массу можно определить через удельную теплоемкость. В данных расчетах используется правило Дюлонга и Пти: Произведение удельной теплоемкости простого твердого вещества на его атомную массу для большинства элементов приблизительно одинаково.
Полученная величина имеет среднее значение, равное 26,8 Дж/моль·К (6,3 кал/моль·град). Эта величина носит название атомной теплоемкости металлов (СА) и представляет собой количество тепла, необходимого для нагревания 1 моля атомов металла на один Кельвин. Математически это правило имеет вид:
где С – удельная теплоемкость металла, Дж/г·К;
А – атомная масса взятого металла, г/моль.
Под удельной теплоемкостью понимается то количество тепла, которое необходимо затратить для нагревания 1 г вещества на 1 Кельвин.
Пример 9. При окислении 0,16 г металла образовалось 0,223 г оксида. Вычислить точную атомную массу металла, зная, что удельная теплоемкость 0,635 Дж/г·К.
Решение: По правилу Дюлонга и Пти найдем приближенное значение атомной массы данного металла:

По (1) найдем эквивалентную массу этого металла. Масса кислорода 0,223 – 0,16 = 0,063 г.

Зная приближенную атомную массу металла и его эквивалентную массу, можно найти валентность этого металла.
Полученное значение В округляем до целого числа:

Точная молярная масса металла находится из соотношения:

1. Требования безопасности труда
Перед началом экспериментальной части внимательно изучите методику выполнения работы. Эксперимент требует осторожности, неторопливости, особенно в начале практической части. Соляную кислоту, необходимую для реакции с металлом в объеме 5 мл, нужно отмерить с помощью градуированной пробирки либо пипетки, строго соблюдая при этом все указания преподавателя (см. также рис. 2 а, б в методических указаниях).
2. Порядок выполнения работы
Прибор для определения эквивалента и эквивалентной массы металла состоит из бюретки (емкостью 50 мл), воронки и пробирки, соединенных резиновыми трубками (рис. 1 а). Бюретка и воронка наполнены дистиллированной водой.
Для проведения опыта необходимо:
1. Проверить прибор на герметичность. Для этого нужно переместить воронку (не снимая пробирки) на несколько больших делений бюретки вниз и закрепить её (рис. 1 а, б). Если прибор герметичен, уровень воды в бюретке окажется постоянным. Непрерывное понижение уровня воды в бюретке означает, что прибором пользоваться нельзя. В этом случае следует устранить негерметичность прибора с помощью лаборанта.
2. Получить у преподавателя или лаборанта навеску металла.
3. Снять пробирку и, передвигая воронку, установить уровень воды в бюретке на делении 0 или несколько ниже (рис. 1 в).
4. Отмерить с помощью градуированной пробирки или пипеткой на 5 мл разбавленной HCl (рис. 2 а, б), влить кислоту в пробирку, стараясь не смочить ее стенок. Держа пробирку наклонно (как это изображено на рис. 3), поместить всю навеску металла на верхнюю сухую стенку пробирки так, чтобы металл раньше времени не упал в кислоту.
5. Плотно закрыть пробирку пробкой, следя за тем, чтобы металл раньше времени не упал в кислоту (рис. 4 а). Отметить и записать начальный уровень воды в бюретке (а1) и стряхнуть металл в кислоту.
6. Наблюдать выделение водорода, сопровождающееся вытеснением воды из бюретки в воронку.
7. Когда закончится реакция, дать пробирке остыть, опустить воронку (не снимая пробирки) до одинакового уровня воды в бюретке и воронке (рис. 4 б). Отметить и записать конечный уровень воды в бюретке (а2).
8. Записать показания термометра и барометра и приступить к расчетам.
3. Обработка результатов эксперимента
1. Определите объем водорода, вытесненного взятой навеской металла, при температуре t и давлении Р :

где 
a1 и a2 – соответственно начальный и конечный уровни воды в бюретке, мл.
2. Приведите найденный объем водорода к нормальным условиям 

где P – атмосферное давление по барометру, мм рт. ст.;
t – температура по термометру, ºС;
h – давление водяных паров при температуре опыта (по табл. 1), мм рт. ст.
3. Рассчитайте эквивалентную массу взятого металла по формуле:

Vэ(H) = 11,2 л/моль = 11200 мл/моль.
Источник
Эквивалентная масса металла
При растворении в кислоте металла массой 11,9 грамм выделился водород объемом 2,24 литра (нормальные условия). Чему равна эквивалентная масса металла ( Мэкв) и фактор эквивалентности металла (fэкв).
Решение
Согласно закону эквивалентов: массы (объемы)реагирующих веществ пропорциональны молярным массам (объемам) эквивалента этих веществ.
Учитывая, что эквивалентный объем водорода (H) равна 11,2 л, определим эквивалентную массу металла по закону эквивалентов:
Откуда выразим эквивалентную массу металла:
Получаем:
M экв (Me) = 11,9 ∙ 11,2 / 2,24 = 59,5 (г/моль).
Молярная масса эквивалента – равна произведению фактора эквивалентности на молярную массу вещества.
Если валентность металла z (Ме) = 1, то М = Мэ = 59,5 г/моль — одновалентного металла с такой молярной массой нет (смотри таблицу Менделеева).
Если z(Ме) = 2, то М = 2Мэ = 119 г/моль – двухвалентного металла с такой молярной массой нет.
Если z(Ме) = 3, то М = 3Мэ = 178,5 г/моль – гафний.
Фактор эквивалентности металла 1/3.
Ответ:
эквивалентная масса металла 59,5 г/моль;
фактор эквивалентности металла 1/3.
Определение молярной массы эквивалента металла
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Определение 1
Эквивалент – это частица вещества (реальная/условная), которая способна замещать/присоединять один ион водорода в кислотно-основных реакциях, а также присоединять/высвобождать один электрон в ходе окислительно-восстановительных реакций.
Молярная масса эквивалента металла
Молярная масса эквивалента ($mathrm {M_э}$ – это масса одного моля эквивалента.
Замечание 1
Моль – это количество вещества, которое содержит столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода.
Рассчитывается молярная масса эквивалента следующим образом:
$mathrm {M_э = f_э cdot M_{в-ва} = frac {M_{в-ва}}{В_{в-ва}}}$
Где:
- $mathrm {M_э}$ – молярная масса эквивалента (г/моль),
- $mathrm {f_э}$ – фактор эквивалентности (число, которое показывает, какая часть молекулы соответствует эквиваленту),
- $mathrm {M_{в-ва}}$ – молярная масса вещества,
- $mathrm {В_{в-ва}}$ – валентность вещества .
В качестве примера возьмем двухвалентное железо, тогда молярная масса эквивалента будет рассчитываться следующим образом:
$mathrm {M_{Э_{Fe}} = frac {56}{2} = 28 г/моль}$
Закон эквивалентов
Закон эквивалентов гласит, что вещества взаимодействуют в количествах, пропорциональных их эквивалентам.
Из этого следует:
$mathrm {frac{m_1}{m_2} = frac {M_Э1}{M_Э2}}$
Рассмотрим пример решения задачи:
В результате сгорания 5г Ме образовалось 9,44 г оксида этого металла. Необходимо рассчитать молярную массу эквивалента Ме.
- Составим уравнение: $mathrm {2Ме + О_2 to MeO}$.
- Найдем массу кислорода в оксида $mathrm {m_{O_2} = 9,44 – 5 = 4,44 г}$.
- Применим закон эквивалента $mathrm {frac{m_{Me}}{m_{O_2}} = frac{M_{Э_{Me}}}{M_{Э_{O_2}}}}$
Молярная масса эквивалента кислорода равна 8 г/моль ($mathrm {frac {16}{2} = 8}$)
Из этого следует, что молярная масса эквивалента Ме равна: $mathrm {frac {m_{Me}} cdot M_{Э_{О_2}}{m_{O_2}}= frac {40}{4,44} = 9г/моль}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 21.12.2022


 628
628