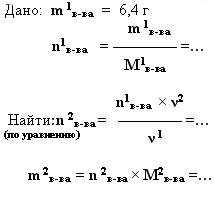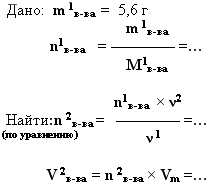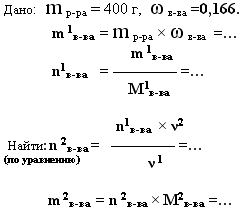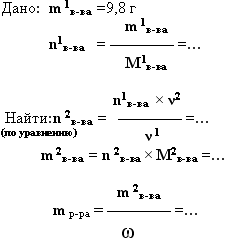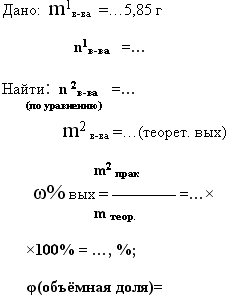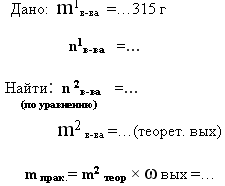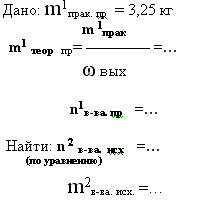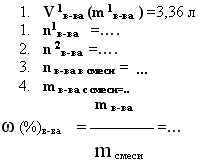Содержание
- Практикум. Решение задач по теме «Металлы»
- Как решать задачи на нахождения металла
- Решаем задачи по теме «Металлы» материал для подготовки к егэ (гиа) по химии (9 класс) по теме
- Скачать:
- Предварительный просмотр:
Разделы: Химия
Расчеты по формулам.
Какое из следующих соединений содержит больше железа: FeO, Fe2O3, Fe3O4.
- *Минерал содержит 96% CuS. Какую массу этого минерала необходимо переработать, чтобы получить 100 г меди.
- *Из 1 т глинозёма, содержащего 95% оксида алюминия, получили 0,436 т алюминия. Каков процент выхода?
- *Сколько потребуется магнитного железняка, содержащего 90% Fe3O4 для получения 100 т железа, если потери в производстве составляют 3%.
*Сколько граммов кальция содержится в 300,0 г известняка, содержащего 90% карбоната кальция?
Расчёты по уравнениям:
1. дано: n(моль) – найти: n(моль).

Сколько моль оксида меди получится при полном окислении 3 моль меди?
2. дано: m (г, кг, т) – найти: m (г, кг, т).

Вычислите массу оксида меди полученного при окислении 6,4 г меди.
3. дано: m (г, кг, т) – найти:V (мл, л, м 3 ).

При обжиге известняка было получено 5,6 г оксида кальция. Какой объём углекислого газа(н.у.) при этом образовался.
4. дано: V (мл, л, м 3 ).– найти: m (г, кг, т)
 |
Цинк растворили в соляной кислоте, и объём выделившегося газа составил 2,24 л (н.у.). Какая масса цинка была растворена? |
5. дано: m р-ра(смеси) и ω (%)в-ва(примеси) — найти: mв-ва или V в-ва

В 400 г 16,6 %-ного раствора азотной кислоты, растворили гидроксид меди(II). Какая масса соли получилась?

Какую массу 40% раствора гидроксида натрия необходимо взять, чтобы нейтрализовать 9,8 г серной кислоты.
7. дано: m 1 в-ва и m 2 в-ва — исходные вещества (какое-то их них находится в избытке)
найти: m 3 в-ва продукт реакции.

К раствору, содержащему 21,3 грамм нитрата алюминия, прилили раствор, содержащий 8 грамм гидроксида натрия, определите массу полученного осадка.
8. дано: m 1 в-ва исход. и m 2 в-ва — продукта реакции- практический выход —
найти: m 2 в-ва продукта реакции- теоретический выход. и ωвых

При действии концентрированной серной кислоты на кристаллический хлорид натрия массой 5,85 г было получено 2 л хлороводорода. Определите массовую долю выхода продукта реакции в (%) от теоретически возможного.
9. дано: m 1 в-ва исход. и ωвых –
найти: m 2 в-ва продукта реакции- практический выход

315 г азотной кислоты полностью прореагировало с гидроксидом кальция. Вычислите массу полученного нитрата кальция, если доля его выхода составляет 80% от теоретически возможного.
10. дано: m 1 в-ва продукта реакции- практический выход и его ωвых –
найти: m 2 в-ва исход.

Сколько граммов сульфида меди(II) потребуется сжечь, чтобы получить 17,92 л (н.у.) оксида серы (IV), если выход продукта реакции составляет 90%?
11. дано: m смеси, m в-ва (или V в-ва) прод. реакции, —
найти: mв-ва и его долю — ω (%)в-ва в смеси.
А).В реакцию вступает один компонент.

4,5 г сплава меди с магнием растворили в соляной кислоте. Объём выделившегося водорода составил 3,36 л (н.у.). Какова массовая доля магния в сплаве.
- При восстановлении водородом 40 г смеси меди с оксидом меди(II) образовалось 6 г воды. Определите массовую долю (в %) каждого компонента в смеси.
- Определите массовую долю каждого компонента в смеси, образующейся в результате взаимодействия 27 г порошкообразного алюминия и 64 г оксида железа(III).
- Какая масса 20% соляной кислоты потребуется для полного растворения 10 г смеси цинка с оксидом цинка, если при этом выделился водород объёмом 2,24 л (н.у.).
- Определите массовую долю (в %) железа в сплаве с углеродом, если при обработке образца сплава массой 6 г соляной кислотой выделилось 2,24 л газа (н.у.). Какой объём соляной кислоты (ρ= 1,09г/мл) с массовой долей HCl 18,25% вступил в реакцию.
- При взаимодействии со щелочью 4,5 г сплава алюминия с магнием выделилось 3,36 л водорода (н.у.). Какова массовая доля алюминия в сплаве?
- Через известковую воду пропустили 1 л смеси оксида углерода (II) и оксида углерода(IV). Выпавший осадок отфильтровали, промыли и просушили. Его масса составила 2,45 г. Определите объёмную долю каждого газа в исходной смеси.
- 4 г смеси кремния, алюминия и оксида магния обработали избытком соляной кислоты. Объём выделившегося газа составил 2,24 л, а масса нерастворившегося остатка составила 1,2 г. Определите количество вещества оксида магния в смеси.
- При растворении 4,5 г оксида меди(II), загрязнённого песком, был использован 16%-ный раствор азотной кислоты объёмом 36,1 мл (ρ= 1,093г/мл). Рассчитайте массы чистого оксида меди и песка, содержащихся в навеске.
В реакцию вступает два компонента. (Составляется 2 уравнения химических реакций и алгебраическое уравнение или система уравнений.)
- При взаимодействии смеси порошков железа и цинка массой 6,05 г с избытком раствора хлорида меди(II) образовалась металлическая медь массой 6,4 г. Определите количественный состав исходной смеси.
- Для растворения смеси карбоната кальция и карбоната магния в воде потребовалось 2,016 г углекислого газа (н.у.) определите количественный состав смеси карбонатов.
- При взаимодействии 30,7 г смеси цинка и алюминия, в разбавленной серной кислоте выделился водород объёмом 11,2 л (н.у.). Вычислите массовую долю цинка в смеси.
- На нейтрализацию 100 г раствора, содержащего 5,7 г смеси гидроксида натрия и кальция, израсходовали 9,45 г азотной кислоты. Вычислите массовые доли (в %) солей в исходной смеси.
- * Смесь железа с оксидом железа(II) и оксидом железа (III) обработали соляной кислотой и получили 112 мл водорода. 1 г этой же смеси при восстановлении водородом даёт 0,2115 г воды. Определите массовую долю оксида железа в смеси.
Источник
Тренировочные задания к теме
«Щелочные и щелочноземельные металлы»
Щелочные металлы (Іа группа) — Li Na K Rb Cs Fr – Валентность I — R2O ROH
Щелочноземельные металлы (ІІа группа) — Mg Ca Sr Ba Ra — Валентность IІ — RO R(OH)2
1.Щелочной металл образует оксид , молярная масса которого равна 30 г/моль. Определите металл
2.Оксид металла ІІа группы имеет молярную массу 40 г/моль. Определите металл
3.Гидроксид металла Іа группы имеет молярную массу 40 г/моль. Определите металл
4.Щелочноземельный металл образует гидроксид , молярная масса которого равна 74 г/моль. Определите металл
5.Молярная масса хлорида щелочноземельного металла равна 95 г/моль. Определите металл
6.Сульфид щелочного металла имеет молярную массу 110 г/моль. Определите металл.
7.Сульфат двухвалентного металла имеет молярную массу 233 г/моль. Определите металл.
8.Одновалентный металл массой 2,34 г вытесняет из хлоридной кислоты 0,672 л водорода. Определите металл.
9.Оксид щелочноземельного металла массой 16,8 г в реакции с углекислым газом образует 30 г соли. Определите металл.
10.Гидроксид двухвалентного металла массой 23,2 г растворяется в нитратной кислоте, образуя соль и воду, массой 7,2 г. Определите металл.
11.Щелочной металл массой 1,4 г в реакции с водой образует основание массой 4,8 г . Определите металл
Источник
Для учащихся 9-11 классов подобраны задачи по теме «Металлы». Рассматриваются основные алгоритмы решения таких задач, а так же типичные ошибки,возникающие при решении задач на смеси.
Скачать:
| Вложение | Размер |
|---|---|
| reshaem_zadachi_po_teme_metally.doc | 87 КБ |
Предварительный просмотр:
- Задачи на смеси и сплавы металлов
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет. О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
- Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.
Получается примерно так: «Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl 2 + BaCl 2 + 2H 2 O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида. А в приведенном уравнении предполагается, что их равное количество . - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl 2 + H 2
2Al + 6HCl = 2AlCl 3 + 3H 2
Количество цинка принимается за х , а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны. - Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
- Необходимые теоретические сведения.
- Способы выражения состава смесей.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
ω [«омега»] = m компонента / m смеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = n компонента А / ( n(A) + n(B) + n(С) )
- Мольное соотношение компонентов. Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
n компонента А : n компонента В = 2 : 3
- Объёмная доля компонента в смеси (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
φ [«фи»] = V компонента / V смеси
- Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
- Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты ( кроме азотной и концентрированной серной , взаимодействие которых с металлами происходит по-особому), реагируют только металлы , в электрохимическом ряду напряжений находящиеся до (левее) водорода .
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2 .
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
- Продукты восстановления азотной кислоты.
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
Неактивные металлы (правее железа) + разб. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота
Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления
Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота
Пассивация: с холодной концентрированной азотной кислотой не реагируют:
Al, Cr, Fe, Be, Co.
Не реагируют с азотной кислотой ни при какой концентрации :
Au, Pt, Pd.
- Продукты восстановления серной кислоты.
Неактивные металлы (правее железа) + конц. кислота
Неметаллы + конц. кислота
Щелочноземельные металлы + конц. кислота
Щелочные металлы и цинк + концентрированная кислота.
Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная)
Пассивация: с холодной концентрированной серной кислотой не реагируют:
Al, Cr, Fe, Be, Co.
Не реагируют с серной кислотой ни при какой концентрации :
Au, Pt, Pd.
- Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы ( Li, Na, K, Rb, Cs ), а также металлы IIA группы: Са, Sr, Ba . При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
- Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
- Решение примера 1.
- Находим количество водорода:
n = V / V m = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
Количество железа тоже 0,25 моль. Можно найти его массу:
m Fe = 0,25 • 56 = 14 г.
- Теперь можно рассчитать массовые доли металлов в смеси:
ω Fe = m Fe /m всей смеси = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
- Решение примера 2.
- Находим количество водорода:
n = V / V m = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
1,5x (мольное соотношение Al:Н2 = 2:3)
- Нам известно общее количество водорода: 0,4 моль. Значит,
1,5х + у = 0,4 (это первое уравнение в системе). - Для смеси металлов нужно выразить массы через количества веществ.
m = M • n
Значит, масса алюминия
m Al = 27x,
масса железа
m Fe = 56у,
а масса всей смеси
27х + 56у = 11 (это второе уравнение в системе). - Итак, мы имеем систему из двух уравнений:
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:
(56 − 18)у = 11 − 7,2
у = 3,8 / 38 = 0,1 моль (Fe)
х = 0,2 моль (Al)
- Дальше находим массы металлов и их массовые доли в смеси:
m Fe = n • M = 0,1 • 56 = 5,6 г
m Al = 0,2 • 27 = 5,4 г
ω Fe = m Fe / m смеси = 5,6 / 11 = 0,50909 (50,91%),
соответственно,
ω Al = 100% − 50,91% = 49,09%
Ответ: 50,91% железа, 49,09% алюминия.
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
- Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
n SO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
2H 2 SO 4 (конц.) = CuSO 4 +
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль. Можно найти массу меди:
m Cu = n • M = 0,25 • 64 = 16 г.
- В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
- Число моль водорода:
n H2 = 3,36 / 22,4 = 0,15 моль,
мольное соотношение алюминия и водорода 2:3 и, следовательно,
n Al = 0,15 / 1,5 = 0,1 моль.
Масса алюминия:
m Al = n • M = 0,1 • 27= 2,7 г - Остаток — это железо, массой 3 г. Можно найти массу смеси:
m смеси = 16 + 2,7 + 3 = 21,7 г. - Массовые доли металлов:
ω Cu = m Cu / m смеси = 16 / 21,7 = 0,7373 (73,73%)
ω Al = 2,7 / 21,7 = 0,1244 (12,44%)
ω Fe = 13,83%
Ответ: 73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО 3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
- Решение примера 5.
- Определяем количество вещества газа:
n N2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
m раствора = ρ • V = 1,115 • 565 = 630,3 г
m HNO3 = ω • m раствора = 0,2 • 630,3 = 126,06 г
n HNO3 = m / M = 126,06 / 63 = 2 моль
Обратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке , и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций ( не забудьте про электронный баланс ) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
+ 12HNO 3 = 5Zn(NO 3 ) 2 +
+ 36HNO 3 = 10Al(NO 3 ) 3 +
- Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы — 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
х + 3у = 0,13 (количество азота)
65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов)
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
х = 0,04, значит, n Zn = 0,04 • 5 = 0,2 моль
у = 0,03, значит, n Al = 0,03 • 10 = 0,3 моль
Проверим массу смеси:
0,2 • 65 + 0,3 • 27 = 21,1 г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
- Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?
По уравнениям реакций, количество кислоты, вступившей в реакцию:
n HNO3 = 0,48 + 1,08 = 1,56 моль,
т.е. кислота была в избытке и можно вычислить её остаток в растворе:
n HNO3 ост. = 2 − 1,56 = 0,44 моль. - Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль:
m Zn(NO3)2 = n • M = 0,2 • 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
m Al(NO3)3 = n • M = 0,3 • 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
m HNO3 ост. = n • M = 0,44 • 63 = 27,72 г
- Какова масса итогового раствора?
Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
Сумма масс
смешиваемых
растворов и/или веществ
Тогда для нашей задачи:
m нов. раствора = масса раствора кислоты + масса сплава металлов — масса азота
m N2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
m нов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г
- Теперь можно рассчитать массовые доли веществ в получившемся растворе:
ωZn(NO 3 ) 2 = m в-ва / m р-ра = 37,8 / 648,04 = 0,0583
ωAl(NO 3 ) 3 = m в-ва / m р-ра = 63,9 / 648,04 = 0,0986
ω HNO3 ост. = m в-ва / m р-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO 2 , а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
- Задачи для самостоятельного решения.
- 1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
- 3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
- Ответы и комментарии к задачам для самостоятельного решения.
1-1. 36% (алюминий не реагирует с концентрированной азотной кислотой);
1-2. 65% (в щелочи растворяется только амфотерный металл — цинк);
1-5. 30,1% Fe (железо, вытесняя медь, переходит в степень окисления +2);
1-7. 36,84% Fe (железо в азотной кислоте переходит в +3);
1-8. 75,68% Fe (железо в реакции с соляной кислотой переходит в +2); 12,56 мл раствора HCl.
2-1. 42,55 % Са (кальций и алюминий с графитом (углеродом) образуют карбиды СаС 2 и Al 4 C 3 ; при их гидролизе водой или HCl выделяются, соответственно, ацетилен С 2 Н 2 и метан СН 4 );
2-3. 61,76% Fe (гептагидрат сульфата железа — FeSO 4 • 7H 2 O);
2-7. 5,9% Li 2 SO 4 , 22,9% Na 2 SO 4 , 5,47% H 2 O 2 (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид Na 2 O 2 , который в воде гидролизуется до пероксида водорода и щелочи);
3-2. 38,1% Fe, 43,5% Cu;
3-3. 1,53% FeCl 3 , 2,56% ZnCl 2 , 1,88% AlCl 3 (железо в реакции с хлором переходит в степень окисления +3);
3-4. 2,77% FeCl 2 , 2,565% ZnCl 2 , 14,86% HCl (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. 2,8 г Si, 5,4 г Al, 5,6 г Fe (кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. 6,9% Cu, 43,1% Fe, 50% Zn;
3-8. 45,1% Ag, 36,6% Cr, 18,3% Zn (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Источник
Adblock
detector
Одна из моих предыдущих статей была посвящена разбору решения задач «на пластинку». В продолжение этой темы, хочу предложить разбор еще двух задач “на пластинку”. Особенностью этих задач является определение неизвестного металла пластинки или металла оседающего на пластинке.
И вот эти задачи.
Условие первой задачи:
Две пластинки с одинаковой массой, изготовленные из одного и того же металла, проявляющего в соединениях степень окисления +2, погрузили одну в раствор сульфата меди, а другую – в раствор нитрата свинца. Через некоторое время масса первой пластинки уменьшилась на 3,6%, а масса второй увеличилась на 7,125%. Определить, какой это металл.
Решение:
Для ответа на этот вопрос нужно искать молярную массу металла.
Введем условные обозначения:
Ме – металл пластинки;
х – молярная масса металла, г/моль;
у – количество прореагировавшего металла, моль.
Запишем уравнения реакции:
Ме + СuSO4 = Cu+ MeSO4 (1)
Ме + PbSO4 = Pb+ MeSO4 (2)
Примем, что исходная масса каждой пластинки равна 100 г. Тогда, масса первой пластинки уменьшилась на 3,6 г, а масса второй увеличилась на 7,125 г.
Изменение массы пластинок связано с растворением металла пластинки и оседанием на нем меди (первое уравнение) или свинца (второе уравнение):
Откуда,
143y = 10,725
y = 0,075
-0,075х + 4,8 = -3,6
0,075х = 8,4
x =112
M(Me) = 112 г/моль. Металл пластинок – кадмий.
Условие второй задачи:
Цинковую пластинку поместили в раствор сульфата некоторого металла. Масса раствора составляет 50 г. Металл в сульфате находится в степени окисления +2. Через некоторое время масса пластинки увеличилась на 1,08 г. Массовая доля сульфата цинка в растворе стала равна 6,58%. Определите, какой металл выделился на пластинке?
Решение:
Уравнение реакции:
Zn + МеSO4 = Me + ZnSO4
Для решения введем обозначения:
х – молярная масса металла, г/моль;
у – количество моль прореагировавшего цинка.
Изменение массы пластинки происходит из-за растворения цинка и оседания на пластинке металла из соли:
-65у+ху=1,08
Массовая доля сульфата цинка в растворе:
w(ZnSO4) = m(ZnSO4)/m(p-pa)
где m(ZnSO4) – масса сульфата цинка, г.
m(ZnSO4) = M(ZnSO4)*y = 161y
m(p-pa) – масса раствора после реакции, г.
m(p-pa) = 50-1,08 = 48,92
0,0658 =161y/48,92
161y = 3,219
y= 0,02
n(Zn) = 0,02 моль.
Подставляя полученное значение в первое уравнение, получим:
-65*0,02+0,02х =1,08
0,02х = 2,38
х = 119
Молярная масса металла: М(Ме) = 119 г/моль
Металл пластинки – олово.
Задачи для самостоятельного решения:
1. Кусочек железа поместили в раствор нитрата металла, который проявляет в соединениях степень окисления +1. Масса образца металла увеличилась на 16 г. через полученный раствор нитрата железа пропустили избыток сероводорода, получив сульфид железа массой 8,8 г. Какой металл выделен из раствора? [Cеребро]
2. В раствор, содержащий 3,2 г 2-х валентного металла в виде хлорида, погрузили железную пластинку массой 50 г. После полного осаждения металла масса пластинки увеличилась на 0,8%. Определите, соль какого металла находилась в растворе? [Медь]
3. Две пластинки одинаковой массы, изготовленные из одного и того же металла, проявляющего в своих соединениях валентность, равную 2, погрузили в растворы одинаковой концентрации: одну – в раствор соли кадмия, другую – в раствор соли свинца. Через некоторое время оказалось, что масса первой пластинки увеличилась на 0,47%, второй – на 1,42%. Определите металл, из которого были изготовлены пластинки? (железо).
4. Пластинку неизвестного металла поместили в 800 г раствора нитрата свинца с массовой долей соли 5 %. Через некоторое время масса пластинки увеличилась на 14,3 г, а массовая доля нитрата свинца стала равна 0,88 %. Какой металл был взят, если известно, что в нитрате он находится в степени окисления +2.
Успехов в решении задач!
Тема 6: «Металлы»
Задача №1
При сжигании 10
г металла было получено 18,9 г оксида, при этом металл окислился до степени
окисления +3. Что это за металл, и какой объем кислорода был израсходован при
этом.
Решение:
Составим
уравнение сжигания металла в общем виде:
Х 0,5х
4 Ме
+ 3 О2 2 Ме2О3
Пусть количество
Ме будет х моль тогда по уравнению реакции:
Выразим массу Ме и оксида:
увеличение массы произошло за счет
присоединения кислорода Подставим значение
массы веществ: 0,5х(2Mr+48)-Mrх=8,9
Mrx+24x–Mrx=8,9
X=0,37 (моль)
Найдем молярную
массу металлов исходный металл алюминий. По
уравнению реакции определяем количество вещ -ва кислорода.
Примечание: если
в задаче не указаны условия мы принимаем их как нормальные (н.у.).
Задачу можно
решить и более простым путем:
Когда была
найдена масса присоединившегося кислорода 8,9
г можно найти и его количество:
, а затем по уравнению реакции найти
В этом случае не пришлось бы решать с неизвестным х.
Ответ:
неизвестный металл алюминий.
Задача №2
Образец кальция и натрия массой 6,3
г растворили в воде. Полученный раствор нейтрализовали азотной кислотой. Для
нейтрализации потребовалось 18,9г HNO3. Определите массу натрия в сплаве.
Решение:
Составим уравнения реакции:
0,3-х 0,3-х
1) 2
Na + 2HOH 2 NaOH + H2
0,5х 0,5х
2) Ca + 2HOH Ca(OH)2 + H2
0,3-х 0,3-х
3) 
NanO3
+ H2O
0,3 моль
0,5х х
4) Ca(OH)2
+ 2HNO3 Ca(NO3)2 + 2 H2O
Находим
количество затраченной азотной кислоты
М (HNO3)=63 г/моль
Многие методики
предлагают решать подобные задачи через систему уравнений. Мне же более
простым, кажется другой способ решения.
0,3 моль HNO3 затратилось на протекание реакции №3 и №4.
Обозначим кол-во HNO3 затраченное в реакции №4 за х моль, тогда затраченное в реакции №3 будет равно
(0,3-х) моль
По уравнению №4
находим
По уравнению№3
находим
По уравнению №2
находим
По уравнению №1
находим
Выразим массы металлов:
23(0,3-х)+40*0,5х=6,3
0,6=3х
Х=0,2 (моль)
m(Na)=23(0,3-0,2)=2,3
(г)
Ответ:
масса натрия равна 2,3 г
Задача №3
Определить
массу меди в смеси железа, меди и алюминия, если при действии на 13
г этой смеси избытка раствора гидроксида натрия выделяется 6,72
л газа, а при действии избытка соляной кислоты 8,96
л газа (н.у.)
Решение:
Составим
уравнения реакций. С щелочами взаимодействуют только амфотерные металлы. В
нашем случае это алюминий.
1. 2 Al + 2 NaOH + 6 H2O 2
При действии соляной кислоты реагировать
будут железо и алюминий.
0,1 моль
0,1 моль
2. Fe + 2HCl FeCl2 + H2
0,2 моль 0,3
моль
3. 2Al + 6HCl
AlCl3 + 3 H2
Находим количество водорода выделившегося в
первой реакции:
По уравнению находим
Находим объем водорода выделившегося во 2 и
3 реакциях.
так как мы уже знаем,
что в смеси=0,2 моль по уравнению реакции №3
находим
Следовательно, по
уравнению реакции №2 определяем находим массы алюминия
и железа
Ответ: масса меди
в смеси равна 2 грамма.
Задача №4
Металлический
магний массой 6 г опустили в 100 г раствора сульфата меди с массовой долей CuSO4 8%. Определите массу металла к окончанию
реакции.
Решение:
Составляем
уравнение реакции:
0,05 моль 0,05 моль 0,05
моль
Mg + CuSO4 MgSO4 + Cu
– недостаток
По уравнению
реакции определяем:
Ответ:
масса металла после реакции равна 8 г.
Задача №5
Железную
пластинку массой 8 г. некоторое время выдержали в растворе массой 200
г с массовой долей сульфата меди(II) 15%, после этого
масса пластинки составила 8,8 г. Определите массовую долю (в процентах)
сульфата меди в растворе после реакции.
Решение:
Составим уравнение реакции:
Fe + CuSO4 FeSO4 +cu
Находим массу сульфата меди II в исходном р-ре
Увеличение массы пластинки произошло
потому, что масса выделившейся меди больше, чем масса железа вступившего в
реакцию.
пусть
прореагировавшего будет равно х моль. По
уравнению реакции определяем, что
По уравнению реакции определяем
Ответ:(CuSO4)= 7%
Задача №6
30 г магния опустили в раствор сульфата
неизвестного металла, проявляющего степень окисления +2. Через некоторое время
масса пластинки стала равной 39,5 г, а масса сульфата магния – 12
г. определите неизвестный металл.
Решение:
Составляем
уравнение реакции в общем виде:
0,1 моль
0,1 моль 0,1 моль
Mg + MeSO4
MgSO4 + Me
по уравнению реакции определяем
Ответ:
неизвестный металл олово Sn.
Расчеты по формулам.
|
|
Расчёты по уравнениям:
1. дано: n(моль) –
найти: n(моль).
|
|
|
2. дано: m (г, кг, т)
– найти: m (г, кг, т).
|
|
|
3. дано: m (г, кг, т)
– найти:V (мл, л, м3).
|
|
|
4. дано: V (мл, л, м3).–
найти: m (г, кг, т)
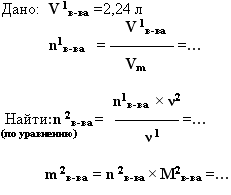 |
|
5. дано: m р-ра(смеси)
и ω (%)в-ва(примеси)
– найти: mв-ва
или V в-ва
|
|
|
6. дано: mв-ва
(или V в-ва),
ω (%)в-ва – найти: m
р-ра
|
|
|
7. дано: m1в-ва
и m2в-ва
– исходные вещества (какое-то их них
находится в избытке)
найти: m3
в-ва продукт реакции.
|
|
|
8. дано: m1в-ва
исход. и m2в-ва
– продукта реакции- практический выход –
найти: m2
в-ва продукта реакции- теоретический
выход. и ωвых
|
|
|
9. дано: m1в-ва
исход. и ωвых –
найти: m2
в-ва продукта реакции- практический
выход
|
|
|
10. дано: m1
в-ва продукта реакции- практический
выход и его ωвых –
найти: m2в-ва
исход.
|
|
|
11. дано: m
смеси, m в-ва
(или V в-ва)
прод. реакции, –
найти: mв-ва
и его долю – ω (%)в-ва
в смеси.
А).В реакцию вступает один компонент.
|
|
|
- При восстановлении водородом 40 г смеси
меди с оксидом меди(II)
образовалось 6 г воды. Определите массовую
долю (в %) каждого компонента в смеси. - Определите массовую долю каждого
компонента в смеси, образующейся в
результате взаимодействия 27 г
порошкообразного алюминия и 64 г оксида
железа(III). - Какая масса 20% соляной кислоты
потребуется для полного растворения 10 г
смеси цинка с оксидом цинка, если при этом
выделился водород объёмом 2,24 л (н.у.). - Определите массовую долю (в %) железа в
сплаве с углеродом, если при обработке
образца сплава массой 6 г соляной
кислотой выделилось 2,24 л газа (н.у.). Какой
объём соляной кислоты (ρ=
1,09г/мл) с массовой долей HCl
18,25% вступил в реакцию. - При взаимодействии со щелочью 4,5 г
сплава алюминия с магнием выделилось 3,36 л
водорода (н.у.). Какова массовая доля
алюминия в сплаве? - Через известковую воду пропустили 1 л
смеси оксида углерода (II)
и оксида углерода(IV).
Выпавший осадок отфильтровали, промыли и
просушили. Его масса составила 2,45 г.
Определите объёмную долю каждого газа в
исходной смеси. - 4 г смеси кремния, алюминия и оксида
магния обработали избытком соляной
кислоты. Объём выделившегося газа
составил 2,24 л, а масса нерастворившегося
остатка составила 1,2 г. Определите
количество вещества оксида магния в
смеси. - При растворении 4,5 г оксида меди(II),
загрязнённого песком, был использован 16%-ный
раствор азотной кислоты объёмом 36,1 мл (ρ=
1,093г/мл). Рассчитайте массы чистого оксида
меди и песка, содержащихся в навеске.
В реакцию вступает два компонента. (Составляется
2 уравнения химических реакций и
алгебраическое уравнение или система
уравнений.)
- При взаимодействии смеси порошков
железа и цинка массой 6,05 г с избытком
раствора хлорида меди(II)
образовалась металлическая медь массой 6,4
г. Определите количественный состав
исходной смеси. - Для растворения смеси карбоната кальция
и карбоната магния в воде потребовалось
2,016 г углекислого газа (н.у.) определите
количественный состав смеси карбонатов. - При взаимодействии 30,7 г смеси цинка и
алюминия, в разбавленной серной кислоте
выделился водород объёмом 11,2 л (н.у.).
Вычислите массовую долю цинка в смеси. - На нейтрализацию 100 г раствора,
содержащего 5,7 г смеси гидроксида натрия
и кальция, израсходовали 9,45 г азотной
кислоты. Вычислите массовые доли (в %)
солей в исходной смеси. - * Смесь железа с оксидом железа(II)
и оксидом железа (III)
обработали соляной кислотой и получили 112
мл водорода. 1 г этой же смеси при
восстановлении водородом даёт 0,2115 г воды.
Определите массовую долю оксида железа в
смеси.
- Задачи на смеси и сплавы металлов
Задачи на смеси — очень частый вид задач в химии. Они требуют чёткого представления о том, какие из веществ вступают в предлагаемую в задаче реакцию, а какие нет. О смеси мы говорим тогда, когда у нас есть не одно, а несколько веществ (компонентов), «ссыпанных» в одну емкость. Вещества эти не должны взаимодействовать друг с другом.
- Типичные заблуждения и ошибки, возникающие при решении задач на смеси.
- Попытка записать оба вещества в одну реакцию.
Получается примерно так: «Смесь оксидов кальция и бария растворили в соляной кислоте…»
Уравнение реакции составляется так:
СаО + ВаО + 4HCl = СаCl2 + BaCl2 + 2H2O.
Это ошибка, ведь в этой смеси могут быть любые количества каждого оксида. А в приведенном уравнении предполагается, что их равное количество. - Предположение, что их мольное соотношение соответствует коэффициентам в уравнениях реакций.
Например:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
Количество цинка принимается за х, а количество алюминия — за 2х (в соответствии с коэффициентом в уравнении реакции). Это тоже неверно. Эти количества могут быть любыми и они никак между собой не связаны. - Попытки найти «количество вещества смеси», поделив её массу на сумму молярных масс компонентов.
Это действие вообще никакого смысла не имеет. Каждая молярная масса может относиться только к отдельному веществу.
Часто в таких задачах используется реакция металлов с кислотами. Для решения таких задач надо точно знать, какие металлы с какими кислотами взаимодействуют, а какие — нет.
- Необходимые теоретические сведения.
- Способы выражения состава смесей.
- Массовая доля компонента в смеси — отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
ω [«омега»] = mкомпонента / mсмеси
- Мольная доля компонента в смеси — отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = nкомпонента А / (n(A) + n(B) + n(С))
- Мольное соотношение компонентов. Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
nкомпонента А : nкомпонента В = 2 : 3
- Объёмная доля компонента в смеси (только для газов) — отношение объёма вещества А к общему объёму всей газовой смеси.
φ [«фи»] = Vкомпонента / Vсмеси
- Электрохимический ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
- Реакции металлов с кислотами.
- С минеральными кислотами, к которым относятся все растворимые кислоты (кроме азотной и концентрированной серной, взаимодействие которых с металлами происходит по-особому), реагируют только металлы, в электрохимическом ряду напряжений находящиеся до (левее) водорода.
- При этом металлы, имеющие несколько степеней окисления (железо, хром, марганец, кобальт), проявляют минимальную из возможных степень окисления — обычно это +2.
- Взаимодействие металлов с азотной кислотой приводит к образованию, вместо водорода, продуктов восстановления азота, а с серной концентрированной кислотой — к выделению продуктов восстановления серы. Так как реально образуется смесь продуктов восстановления, часто в задаче есть прямое указание на конкретное вещество.
- Продукты восстановления азотной кислоты.
|
Чем активнее металл и чем меньше концентрация кислоты, тем дальше восстанавливается азот |
||||
|
NO2 |
NO |
N2O |
N2 |
NH4NO3 |
|
Неактивные металлы (правее железа) + конц. кислота |
Неактивные металлы (правее железа) + разб. кислота |
Активные металлы (щелочные, щелочноземельные, цинк) + конц. кислота |
Активные металлы (щелочные, щелочноземельные, цинк) + кислота среднего разбавления |
Активные металлы (щелочные, щелочноземельные, цинк) + очень разб. кислота |
|
Пассивация: с холодной концентрированной азотной кислотой не реагируют: |
||||
|
Не реагируют с азотной кислотой ни при какой концентрации: |
- Продукты восстановления серной кислоты.
|
SO2 |
S |
H2S |
H2 |
|
|
Неактивные металлы (правее железа) + конц. кислота |
Щелочноземельные металлы + конц. кислота |
Щелочные металлы и цинк + концентрированная кислота. |
Разбавленная серная кислота ведет себя как обычная минеральная кислота (например, соляная) |
|
|
Пассивация: с холодной концентрированной серной кислотой не реагируют: |
||||
|
Не реагируют с серной кислотой ни при какой концентрации: |
- Реакции металлов с водой и со щелочами.
- В воде при комнатной температуре растворяются только металлы, которым соответствуют растворимые основания (щелочи). Это щелочные металлы (Li, Na, K, Rb, Cs), а также металлы IIA группы: Са, Sr, Ba. При этом образуется щелочь и водород. При кипячении в воде также можно растворить магний.
- В щелочи могут раствориться только амфотерные металлы: алюминий, цинк и олово. При этом образуются гидроксокомплексы и выделяется водород.
- Примеры решения задач.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
- Решение примера 1.
- Находим количество водорода:
n = V / Vm = 5,6 / 22,4 = 0,25 моль. - По уравнению реакции:
|
0,25 |
0,25 |
|
|
Fe + |
2HCl = FeCl2 + |
H2 |
|
1 моль |
1 моль |
Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 • 56 = 14 г.
- Теперь можно рассчитать массовые доли металлов в смеси:
ωFe = mFe/mвсей смеси = 14 / 20 = 0,7 = 70%
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н.у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х — число моль одного из металлов, а за у — количество вещества второго.
- Решение примера 2.
- Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль. - Пусть количество алюминия — х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
|
x |
1,5x (мольное соотношение Al:Н2 = 2:3) |
||
|
2Al |
+ 6HCl = 2AlCl3 + |
3H2 |
|
|
y |
y |
||
|
Fe |
+ 2HCl = FeCl2 + |
H2 |
- Нам известно общее количество водорода: 0,4 моль. Значит,
1,5х + у = 0,4 (это первое уравнение в системе). - Для смеси металлов нужно выразить массы через количества веществ.
m = M • n
Значит, масса алюминия
mAl = 27x,
масса железа
mFe = 56у,
а масса всей смеси
27х + 56у = 11 (это второе уравнение в системе). - Итак, мы имеем систему из двух уравнений:
|
{ |
1,5x + y = 0,4 |
|
27x + 56y = 11 |
Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:
(56 − 18)у = 11 − 7,2
у = 3,8 / 38 = 0,1 моль (Fe)
х = 0,2 моль (Al)
- Дальше находим массы металлов и их массовые доли в смеси:
mFe = n • M = 0,1 • 56 = 5,6 г
mAl = 0,2 • 27 = 5,4 г
ωFe = mFe / mсмеси = 5,6 / 11 = 0,50909 (50,91%),
соответственно,
ωAl = 100% − 50,91% = 49,09%
Ответ: 50,91% железа, 49,09% алюминия.
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н.у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г — это масса меди. Количества остальных двух металлов — цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Следующие три примера задач (№4, 5, 6) содержат реакции металлов с азотной и серной кислотами. Главное в таких задачах — правильно определить, какой металл будет растворяться в ней, а какой не будет.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н.у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью реагирует только алюминий — амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи — ещё можно растворить бериллий).
- Решение примера 4.
- С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
|
0,25 |
0,25 |
|
|
Cu + |
2H2SO4 (конц.) = CuSO4 + |
SO2 + 2H2O |
(не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль. Можно найти массу меди:
mCu = n • M = 0,25 • 64 = 16 г.
- В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
|
Al0 − 3e = Al3+ |
| |
2 |
|
2H+ + 2e = H2 |
3 |
- Число моль водорода:
nH2 = 3,36 / 22,4 = 0,15 моль,
мольное соотношение алюминия и водорода 2:3 и, следовательно,
nAl = 0,15 / 1,5 = 0,1 моль.
Масса алюминия:
mAl = n • M = 0,1 • 27= 2,7 г - Остаток — это железо, массой 3 г. Можно найти массу смеси:
mсмеси = 16 + 2,7 + 3 = 21,7 г. - Массовые доли металлов:
ωCu = mCu / mсмеси = 16 / 21,7 = 0,7373 (73,73%)
ωAl = 2,7 / 21,7 = 0,1244 (12,44%)
ωFe = 13,83%
Ответ: 73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н.у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота — «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это — азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
- Решение примера 5.
- Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль. - Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ • V = 1,115 • 565 = 630,3 г
mHNO3 = ω • mраствора = 0,2 • 630,3 = 126,06 г
nHNO3 = m / M = 126,06 / 63 = 2 моль
Обратите внимание, что так как металлы полностью растворились, значит — кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке, и сколько ее осталось после реакции в полученном растворе.
- Составляем уравнения реакций (не забудьте про электронный баланс) и, для удобства расчетов, принимаем за 5х — количество цинка, а за 10у — количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй — 3у моль:
|
5x |
x |
|||
|
5Zn |
+ 12HNO3 = 5Zn(NO3)2 + |
N2 |
+ 6H2O |
|
|
Zn0 − 2e = Zn2+ |
| |
5 |
||
|
2N+5 + 10e = N2 |
1 |
|||
|
10y |
3y |
|||
|
10Al |
+ 36HNO3 = 10Al(NO3)3 + |
3N2 |
+ 18H2O |
|
|
Al0 − 3e = Al3+ |
| |
10 |
||
|
2N+5 + 10e = N2 |
3 |
- Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы — 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
|
{ |
х + 3у = 0,13 (количество азота) |
|
65 • 5х + 27 • 10у = 21,1 (масса смеси двух металлов) |
Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
х = 0,04, значит, nZn = 0,04 • 5 = 0,2 моль
у = 0,03, значит, nAl = 0,03 • 10 = 0,3 моль
Проверим массу смеси:
0,2 • 65 + 0,3 • 27 = 21,1 г.
- Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
|
0,2 |
0,48 |
0,2 |
0,03 |
||
|
5Zn |
+ 12HNO3 = |
5Zn(NO3)2 |
+ N2 + |
6H2O |
|
|
0,3 |
1,08 |
0,3 |
0,09 |
||
|
10Al |
+ 36HNO3 = |
10Al(NO3)3 |
+ 3N2 + |
18H2O |
- Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?
По уравнениям реакций, количество кислоты, вступившей в реакцию:
nHNO3 = 0,48 + 1,08 = 1,56 моль,
т.е. кислота была в избытке и можно вычислить её остаток в растворе:
nHNO3ост. = 2 − 1,56 = 0,44 моль. - Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль:
mZn(NO3)2 = n • M = 0,2 • 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
mAl(NO3)3 = n • M = 0,3 • 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
mHNO3ост. = n • M = 0,44 • 63 = 27,72 г
- Какова масса итогового раствора?
Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
|
Масса |
= |
Сумма масс |
– |
Масса осадков |
– |
Масса газов |
Тогда для нашей задачи:
mнов. раствора = масса раствора кислоты + масса сплава металлов — масса азота
mN2 = n • M = 28 • (0,03 + 0,09) = 3,36 г
mнов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г
- Теперь можно рассчитать массовые доли веществ в получившемся растворе:
ωZn(NO3)2 = mв-ва / mр-ра = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mв-ва / mр-ра = 63,9 / 648,04 = 0,0986
ωHNO3ост. = mв-ва / mр-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н.у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты — 8,96 л газа (н.у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
- Задачи для самостоятельного решения.
- 1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н.y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н.у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н.у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н.у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н.у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
- 2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н.у.), выделившегося при растворения сплава.
2-3. При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
2-4. При взаимодействии железа массой 28 г с хлором образовалась смесь хлоридов железа (II) и (III) массой 77,7 г. Вычислите массу хлорида железа (III) в полученной смеси.
2-5. Чему была равна массовая доля калия в его смеси с литием, если в результате обработки этой смеси избытком хлора образовалась смесь, в которой массовая доля хлорида калия составила 80%?
2-6. После обработки избытком брома смеси калия и магния общей массой 10,2 г масса полученной смеси твердых веществ оказалась равной 42,2 г. Эту смесь обработали избытком раствора гидроксида натрия, после чего осадок отделили и прокалили до постоянной массы. Вычислите массу полученного при этом остатка.
2-7. Смесь лития и натрия общей массой 7,6 г окислили избытком кислорода, всего было израсходовано 3,92 л (н.у.). Полученную смесь растворили в 80 г 24,5%-го раствора серной кислоты. Вычислите массовые доли веществ в образовавшемся растворе.
2-8. Сплав алюминия с серебром обработали избытком концентрированного раствора азотной кислоты, остаток растворили в уксусной кислоте. Объемы газов, выделившихся в обеих реакциях измеренные при одинаковых условиях, оказались равными между собой. Вычислите массовые доли металлов в сплаве.
- 3. Три металла и сложные задачи.
3-1. При обработке 8,2 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 2,24 л газа. Такой же объем газа выделяется и при обработке этой же смеси такой же массы избытком разбавленной серной кислоты (н.у.). Определите состав исходной смеси в массовых процентах.
3-2. 14,7 г смеси железа, меди и алюминия, взаимодействуя с избытком разбавленной серной кислоты, выделяет 5,6 л водорода (н.у.). Определите состав смеси в массовых процентах, если для хлорирования такой же навески смеси требуется 8,96 л хлора (н.у.).
3-3. Железные, цинковые и алюминиевые опилки смешаны в мольном отношении 2:4:3 (в порядке перечисления). 4,53 г такой смеси обработали избытком хлора. Полученную смесь хлоридов растворили в 200 мл воды. Определить концентрации веществ в полученном растворе.
3-4. Сплав меди, железа и цинка массой 6 г (массы всех компонентов равны) поместили в 18,25 % раствор соляной кислоты массой 160 г. Рассчитайте массовые доли веществ в получившемся растворе.
3-5. 13,8 г смеси, состоящей из кремния, алюминия и железа, обработали при нагревании избытком гидроксида натрия, при этом выделилось 11,2 л газа (н.у.). При действии на такую массу смеси избытка соляной кислоты выделяется 8,96 л газа (н.у.). Определите массы веществ в исходной смеси.
3-6. При обработке смеси цинка, меди и железа избытком концентрированного раствора щелочи выделился газ, а масса нерастворившегося остатка оказалась в 2 раза меньше массы исходной смеси. Этот остаток обработали избытком соляной кислоты, объем выделившегося газа при этом оказался равным объему газа, выделившегося в первом случае (объемы измерялись при одинаковых условиях). Вычислите массовые доли металлов в исходной смеси.
3-7. Имеется смесь кальция, оксида кальция и карбида кальция с молярным соотношением компонентов 3:2:5 (в порядке перечисления). Какой минимальный объем воды может вступить в химическое взаимодействие с такой смесью массой 55,2 г?
3-8. Смесь хрома, цинка и серебра общей массой 7,1 г обработали разбавленной соляной кислотой, масса нерастворившегося остатка оказалась равной 3,2 г. Раствор после отделения осадка обработали бромом в щелочной среде, а по окончании реакции обработали избытком нитрата бария. Масса образовавшегося осадка оказалась равной 12,65 г. Вычислите массовые доли металлов в исходной смеси.
- Ответы и комментарии к задачам для самостоятельного решения.
1-1. 36% (алюминий не реагирует с концентрированной азотной кислотой);
1-2. 65% (в щелочи растворяется только амфотерный металл — цинк);
1-3. 37,5%;
1-4. 21,1%;
1-5. 30,1% Fe (железо, вытесняя медь, переходит в степень окисления +2);
1-6. 88,8 г;
1-7. 36,84% Fe (железо в азотной кислоте переходит в +3);
1-8. 75,68% Fe (железо в реакции с соляной кислотой переходит в +2); 12,56 мл раствора HCl.
2-1. 42,55 % Са (кальций и алюминий с графитом (углеродом) образуют карбиды СаС2 и Al4C3; при их гидролизе водой или HCl выделяются, соответственно, ацетилен С2Н2 и метан СН4);
2-2. 74,3 % Mg;
2-3. 61,76% Fe (гептагидрат сульфата железа — FeSO4 • 7H2O);
2-4. 44,7 г;
2-5. 92,7%;
2-6. 4 г;
2-7. 5,9% Li2SO4, 22,9% Na2SO4, 5,47% H2O2 (при окислении кислородом лития образуется его оксид, а при окислении натрия — пероксид Na2O2, который в воде гидролизуется до пероксида водорода и щелочи);
2-8. 14,3 % Al;
3-1. 39% Cu, 3,4% Al;
3-2. 38,1% Fe, 43,5% Cu;
3-3. 1,53% FeCl3, 2,56% ZnCl2, 1,88% AlCl3 (железо в реакции с хлором переходит в степень окисления +3);
3-4. 2,77% FeCl2, 2,565% ZnCl2, 14,86% HCl (не забудьте, что медь не реагирует с соляной кислотой, поэтому её масса не входит в массу нового раствора);
3-5. 2,8 г Si, 5,4 г Al, 5,6 г Fe (кремний — неметалл, он реагирует с раствором щелочи, образуя силикат натрия и водород; с соляной кислотой он не реагирует);
3-6. 6,9% Cu, 43,1% Fe, 50% Zn;
3-7. 32,4 мл;
3-8. 45,1% Ag, 36,6% Cr, 18,3% Zn (хром при растворении в соляной кислоте переходит в хлорид хрома (II), который при действии брома в щелочной среде переходит в хромат; при добавлении соли бария образуется нерастворимый хромат бария)
Литература:
Интернет рессурсы
http://www.alleng.ru/edu/chem2.htm
http://5-ege.ru/kak-reshat-zadachi-po-ximii/
http://iumka.ru/himiya/zadachi-po-himii/