
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end{matrix}
Следом запишем молярные массы для этих веществ
begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
frac{49}{98} = frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
8 класс. Химия. Расчеты массы вещества по уравнению химической реакции
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Соотношение количеств веществ, участвующих в реакции
Коэффициенты в уравнении реакции показывают не только число молекул каждого вещества, но и соотношение количеств веществ, участвующих в реакции. Так, по уравнению реакции: 2H2 + O2 = 2H2O – можно утверждать, что для образования определенного количества воды (например, 2 моль) необходимо столько же моль простого вещества водорода (2 моль) и в два раза меньше моль простого вещества кислорода (1 моль). Приведем примеры подобных расчетов.
ЗАДАЧА 1. Определим количество вещества кислорода, образующегося в результате разложения 4 моль воды.
АЛГОРИТМ решения задачи:
1. Составить уравнение реакции
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию задачи (обозначить неизвестное количество вещества за х моль).
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти х.
Рис. 1. Оформление краткого условия и решения задачи 1
ЗАДАЧА 2. Какое количество кислорода потребуется для полного сжигания 3 моль меди?
Воспользуемся алгоритмом решения задач с использованием уравнения химической реакции.
Рис. 2. Оформление краткого условия и решения задачи 2.
I. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с достаточным количеством кислорода (4Al +3O2=2Al2O3).
2. Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с достаточным количеством кислорода (4Na+O2=2Na2O).
Алгоритм №1
Вычисление количества вещества по известному количеству вещества, участвующего в реакции.
Пример. Вычислите количество вещества кислорода, выделившегося в результате разложения воды количеством вещества 6 моль.
II. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль (S+O2=SO2).
2. Вычислите массу лития, необходимого для получения хлорида лития количеством вещества 0,6 моль (2Li+Cl2=2LiCl).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №2
Вычисление массы вещества по известному количеству другого вещества, участвующего в реакции.
Пример: Вычислите массу алюминия, необходимого для получения оксида алюминия количеством вещества 8 моль.
III. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите количество вещества сульфида натрия, если в реакцию с натрием вступает сера массой 12,8 г (2Na+S=Na2S).
2. Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г (CuO + H2 = Cu + H2O).
Внимательно изучите алгоритм и запишите в тетрадь
Алгоритм №3
Вычисление количества вещества по известной массе другого вещества, участвующего в реакции.
Пример. Вычислите количество вещества оксида меди (I), если в реакцию с кислородом вступает медь массой 19,2г.
Внимательно изучите алгоритм и запишите в тетрадь
IV. Используя алгоритм, решите самостоятельно следующие задачи:
1. Вычислите массу кислорода, необходимую для реакции с железом массой 112 г
Алгоритм №4
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Пример. Вычислите массу кислорода, необходимую для сгорания фосфора, массой 0,31г.
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.
Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
ИСТОЧНИКИ
исчтоник конспекта – http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
источник видео – http://www.youtube.com/watch?v=wZbj-o5J5Vs
источник видео – http://www.youtube.com/watch?v=8sPwPk7a7p0
источник видео – http://www.youtube.com/watch?v=ygaarSGQDwE
источник видео – http://www.youtube.com/watch?v=Gv-jZX0wZxE
Файлы
Нет дополнительных материалов для этого занятия.
Расчеты массы вещества по уравнению химической реакции
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.

Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.

Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).

Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·10 23 атомов . Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·10 23 молекул . Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
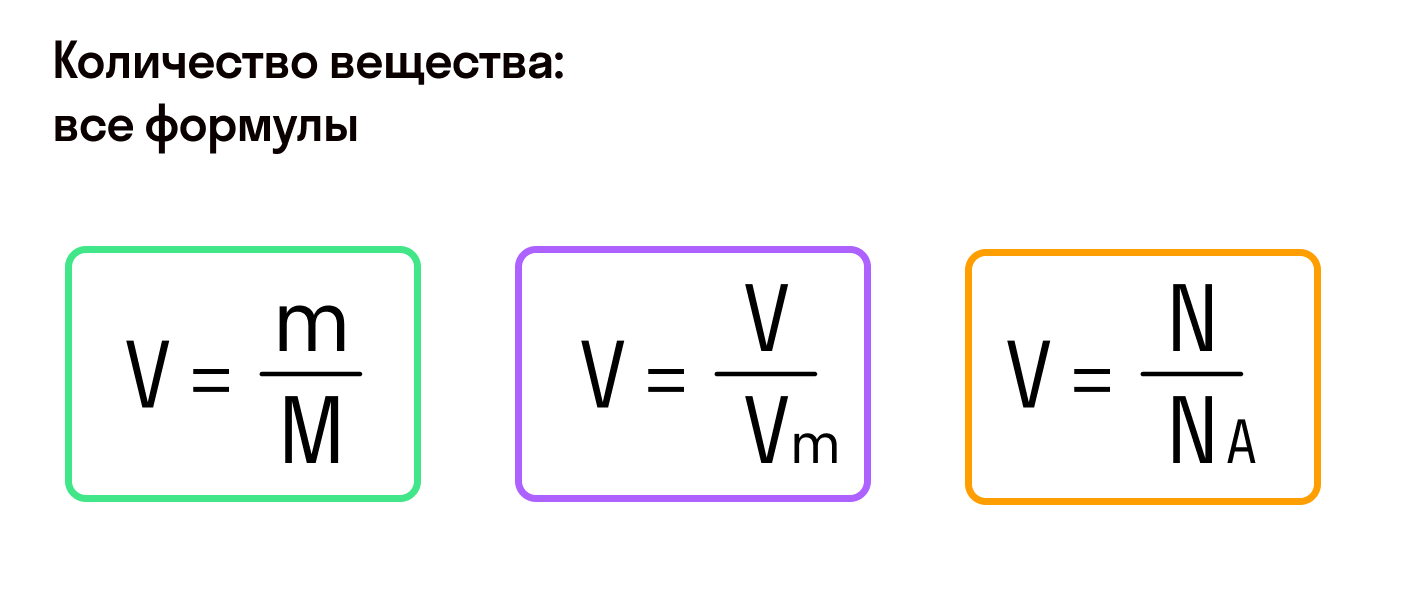
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
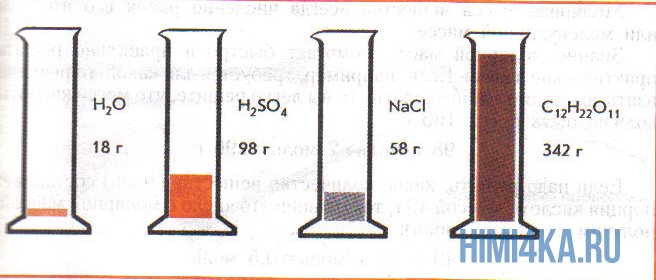
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
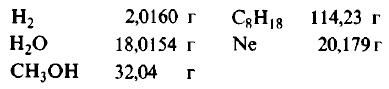
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·10 23 × 0,25 = 1,505·10 23 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
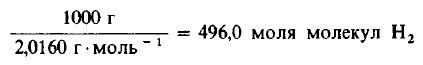
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
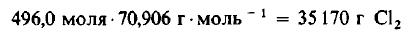
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
[spoiler title=”источники:”]
http://interneturok.ru/lesson/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/raschety-massy-veschestva-po-uravneniyu-himicheskoy-reaktsii
[/spoiler]
Молярная масса

О чем эта статья:
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 10 23 . Постоянная Авогадро обозначается NA, а измеряется в моль -1 .
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 10 23 моль -1 .
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.

Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
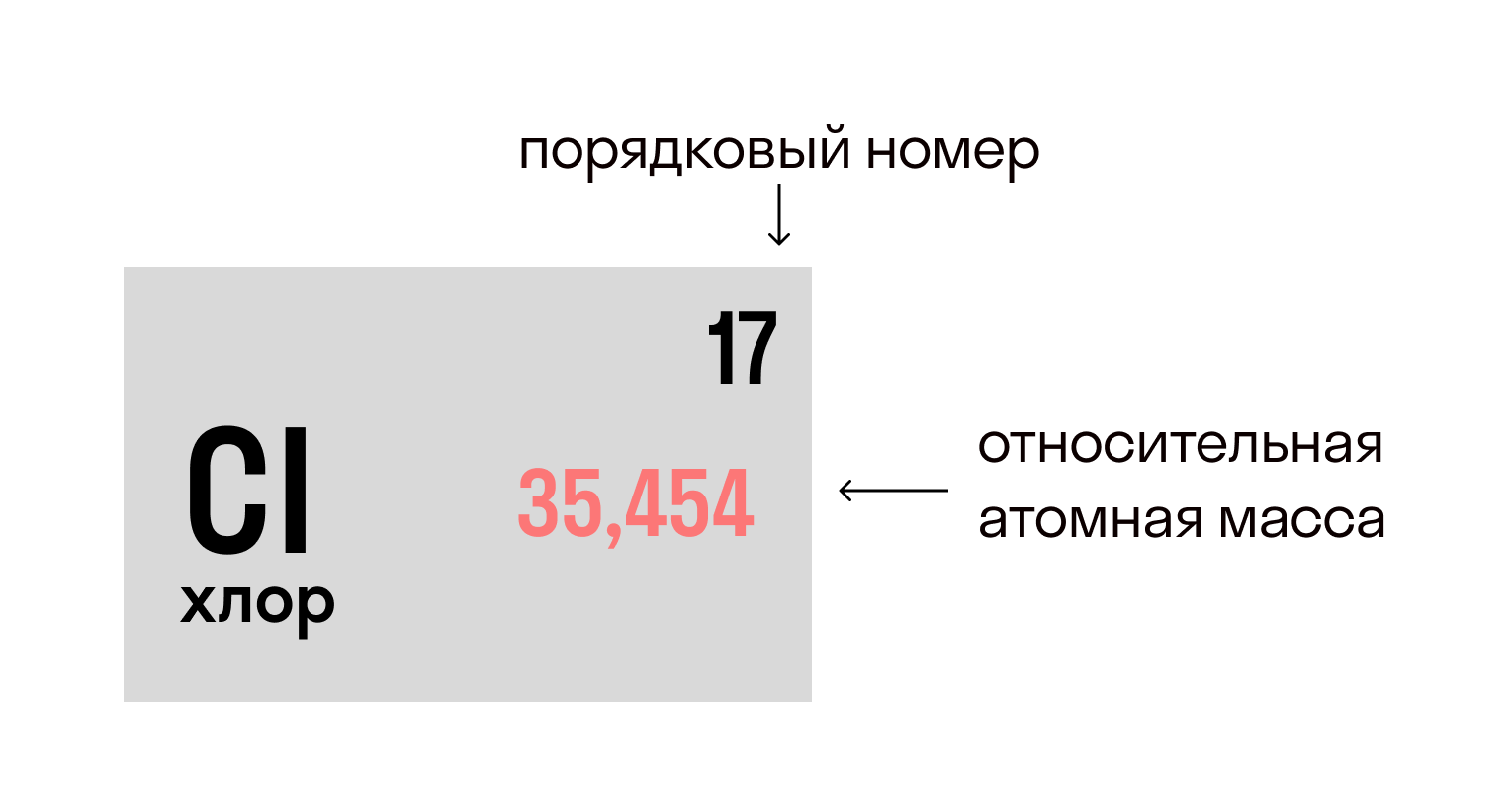
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Подставим значение молярной массы в формулу:
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 10 23 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 10 23 молекул. Чему равна молярная масса данного вещества?
N(х) = 12,04 · 10 23 .
Найдем количество вещества моль.
Подставим количество вещества в формулу :
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 10 23 атомов кислорода. Какова масса этой порции?
N(O) = 8,356 · 10 23 .
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
Зная количество молекул, рассчитаем количество вещества:
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 10 23 молекул? Назовите это вещество.
N(x) = 15,05 · 10 23 .
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
Исходя из этого, рассчитаем молярную массу:
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Нам требуется вычислить относительную плотность сероводорода по водороду:
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.
Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
Моль — условное количество вещества

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию». Школьный курс химии включает понятия «моль» и «молярная масса». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода. Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше. Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.

Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц. Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — то есть масса 1 моль вещества или масса 6,022⋅10 23 структурных единиц этого вещества.
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16. Подставим соответствующие значения в исходную формулу и получим:
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Как решать задачи по химии. Расчет по уравнениям химических реакций.

Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_<2>SO_ <4>+ NaOH → Na_<2>SO_ <4>+ H_<2>O
H_<2>SO_ <4>+ 2NaOH → Na_<2>SO_ <4>+ 2H_<2>O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
источники:
http://egevpare.ru/mol-i-moljarnaja-massa/
http://in-chemistry.ru/kak-reshat-zadachi-po-himii-raschet-po-uravneniyam-himicheskih-reaktsij
Между количествами веществ, участвующих в химической реакции, существует прямо пропорциональная зависимость: чем большее количество одного из веществ принимает участие в данном превращении, тем большее количество других веществ в нём участвует, и наоборот.
Если в химической реакции участвуют вещества (A) и (B), то уравнение реакции имеет вид
(…aA) (+) (…bB), где (a) и (b) — коэффициенты, относящиеся к формулам соответствующих веществ.
Прямо пропорциональную зависимость, существующую между количествами веществ (A) и (B), можно выразить математически:
, отсюда:
n(A)=a⋅n(B)b
или
n(B)=b⋅n(A)a
.
Для того чтобы произвести простейший расчёт по уравнению химической реакции, следует, как правило, сделать четыре шага:
1. написать уравнение химической реакции, упомянутой в условии задачи: (…aA) (+) (…) (…bB).
2. Если в условии задачи не указано количество вещества ((A)), участвующего в превращении, следует, исходя из того, что дано, сделать такой расчёт:
а) если известна масса вещества, его количество можно рассчитать путём деления массы на его молярную массу:
n(A)=m(A)M(A)
.
б) Если известен объём газообразного вещества, измеренный при нормальных условиях (н. у.), количество вещества можно рассчитать путём деления объёма на молярный объём:
n(A)=V(A)Vm
, где
Vm=22,4
л/моль.
в) Если известно число частиц вещества (атомов, молекул или др.), принимающих участие в реакции, его количество можно рассчитать путём деления числа частиц на число Авогадро:
n(A)=N(A)NA
, где
NA=6,02⋅1023
1/моль.
3. Зная количество одного вещества ((A)), участвующего в реакции, можно рассчитать количество второго вещества ((B)), принимающего участие в этой реакции:
n(B)=b⋅n(A)a
.
4. Если требуется рассчитать не количество второго вещества ((B)), а численное значение другой физической величины (его массу, объём газа (н. у.) или др.), следует сделать такой расчёт:
а) чтобы рассчитать массу второго вещества, участвующего в реакции, следует его количество умножить на молярную массу данного вещества:
m(B)=n(B)⋅M(B)
.
б) Чтобы рассчитать объём газа (н. у.), участвующего в химической реакции, нужно его количество умножить на молярный объём:
V(B)=n(B)⋅Vm
.
в) Чтобы рассчитать число частиц (атомов, молекул или др.) второго вещества, принимающего участие в данной химической реакции, нужно его количество умножить на число Авогадро:
N(B)=n(B)⋅NA
.
г) Чтобы рассчитать молярную массу второго вещества, участвующего в химической реакции, следует его массу разделить на количество этого вещества:
M(B)=m(B)n(B)
.
Обрати внимание!
Все вышеупомянутые вычисления можно сделать, не пользуясь расчётными формулами, а составляя пропорции.
Пример:
для того чтобы рассчитать, какое количество вещества содержится в (4,9) г серной кислоты (её молярная масса равна (98) г/моль), следует составить такую пропорцию:
в (98) г серной кислоты содержится (1) моль этого вещества,
а в (4,9) г серной кислоты содержится (x) моль вещества;
.
Для того чтобы решить любую задачу из этого раздела, необходимо знать
- теоретические основы задачи;
- общие принципы оформления расчёта по уравнению химической реакции.
Поскольку теоретические основы изложены в различных разделах Самоучителя и других учебниках, нужно перед решением задачи повторить нужный раздел.
Рассмотрим общие принципы оформления расчётов по уравнениям реакций.
Содержание
- Оформление расчётов по уравнениям реакций
- Задачи для самостоятельного решения
- Задачи по теме «Количественный состав смесей»
- Задачи для самостоятельного решения
- Задачи на «избыток–недостаток»
- Задачи для самостоятельного решения
- Задачи на установление формулы вещества
- Задачи для самостоятельного решения
- Задачи, в которых учитывается «выход» полученного вещества
- Задачи для самостоятельного решения
Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
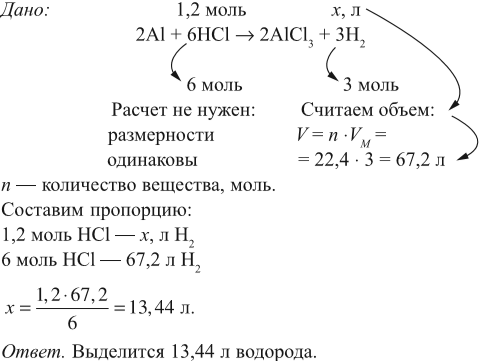
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.

В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.


Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?

Задачи по теме «Количественный состав смесей»
Состав смесей очень часто определяют в различных задачах, например в которых упоминаются растворы. Дело в том, что растворы — это однородные смеси. Задачи такого типа решаются по разному, но в любом случае следует помнить, что массу (объём) смеси нельзя подставлять в уравнение реакции и нельзя находить по уравнению реакции. По уравнению реакции можно найти только массу или объём компонента смеси.
Внимание! Если в условии упоминается смесь веществ или раствор, то составлять уравнения реакций нужно для всех компонентов смеси, указывая, идёт реакция или нет, а затем выполнять расчёт, оформляя решение задачи по каждому уравнению так, как показано выше.
Задачи такого типа можно условно разделить на две группы:
- задачи, в которых имеется хотя бы одна величина, которую можно сразу подставить в уравнение реакции и сделать необходимый расчёт;
- задачи, в которых таких данных нет.
Рассмотрим задачу первого типа.
Задача 20. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:
Составим пропорцию и определим массу алюминия в смеси:
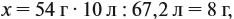
отсюда:
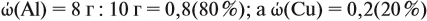
Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
В задачах второго типа в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции. В этих случаях нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в задачи), принимается за известную, и обозначается А.
Задача 21. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
Составим уравнения реакций:
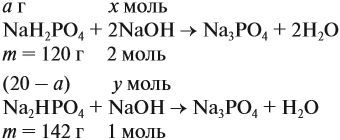
Определим количество вещества NaOH, которое содержится в растворе (можно считать, используя значение массы этого вещества, но более простые числа получаются, если используется величина «моль»):
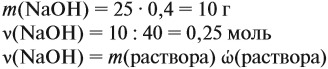
Внимание: количество вещества щёлочи можно рассчитать сразу:
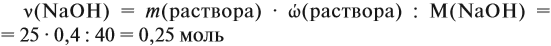
Теперь используем приём, который был отработан в задаче 16: пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:

Поскольку х + у = 0,25 моль, получаем уравнение

Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
При получении растворов происходят не только физические процессы (дробление вещества, диффузия), но и взаимодействие вещества и растворителя. (Подробнее см. урок 6) Иногда в результате такого взаимодействия образуются совершенно новые вещества. В этом случае необходимо составить уравнение или схему происходящего процесса, а в расчётной формуле указывать, о каком веществе идёт речь.
Задача 22. В 100 мл воды растворили 2 г кальция. Определить массовую долю вещества в полученном растворе.
Решение. Поскольку кальций реагирует с водой, составим уравнение соответствующей реакции:
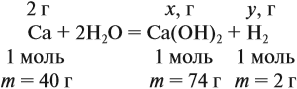
Таким образом, в растворе содержится не кальций, а гидроксид кальция. Отразим это в расчётной формуле:
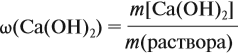
Значит, нам нужно вычислить m[Са(ОН)2] по уравнению реакции:
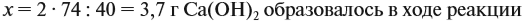
а затем массу раствора:
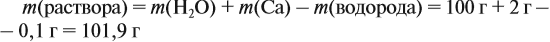
Обратите внимание: массу полученного раствора вычисляют, исходя из массы исходных веществ или смесей, добавляя к ним массы тех веществ, которые были добавлены, и, вычитая массы веществ, которые вышли из сферы реакции в виде газа или осадка.

Ответ. Массовая доля щёлочи составит 3,6 %.

Задачи для самостоятельного решения
43. Через известковую воду пропустили 3 л воздуха. Выпало 0,1 г осадка. Определить объёмную долю (φ) углекислоты (CO2) в воздухе.
44. 20 г мела опустили в соляную кислоту. При этом выделилось 4 л газа. Определить массовую долю (ώ) карбоната кальция в образце этого мела.
45. В 200 г воды растворили 15 г оксида лития. Найти массовую долю веществ в полученном растворе.
46. 20 г смеси хлорида натрия и карбоната натрия обработали соляной кислотой. При этом выделилось 2,24 л газа. Установить состав смеси в масс.%.
47. Для превращения 2,92 г смеси гидроксида и карбоната натрия потребовалось 1,344 л хлороводорода. Вычислить состав смеси.
48. При растворении 3 г сплава меди и серебра в разбавленной азотной кислоте получено 7,34 г смеси нитратов. Определить процентный состав смеси и объём газов, полученных при прокаливании образовавшихся солей.
49. Сколько граммов 30 %-ной азотной кислоты нужно взять для нитрования 5,6 л пропана?
50. Какой, объём кислорода потребуется для сжигания смеси, состоящей из 8 г метана и 11,2 л этана?
51. Какой объём метана можно получить при нагревании 20 г смеси, содержащей 25 % ацетата натрия, остальное — щёлочь?
52. Через бромную воду пропустили смесь, которая состоит из 8 г метана и 5,6 л этена. Сколько граммов брома вступит в реакцию?
53. Какой объём природного газа, который содержит 98 % метана, потребуется для получения 52 кг ацетилена?
54. Из 10 г загрязнённого карбида кальция получили 2,24 л ацетилена. Чему равна массовая доля карбида кальция в исходном образце?
55. Какой объём кислорода нужен для сжигания смеси, которая состоит из 4 г метана, 10 л этена и 1 моль этина?
56. Сколько граммов 40 %-ной азотной кислоты нужно взять для получения 24,2 г нитробензола?
57. Сколько граммов азотной кислоты потребуется для нитрования 4,7 г фенола, если ώ(кислоты) в исходном растворе равна 30 %.
58. Сколько граммов 30 %-ной муравьиной кислоты нужно для растворения 2,7 г алюминия?
59. Сколько граммов 40 %-ного раствора КОН требуется для омыления (гидролиза) 3 моль тристеарина?
60. Рассчитать объём газа, который должен выделиться при брожении 160 г 20 %-ного раствора глюкозы (брожение прошло полностью).
61. На реакцию с 50 мл раствора анилина пошло 4,2 г брома. Рассчитать массовую долю анилина в исходном растворе (плотность раствора равна единице).

Задачи на «избыток–недостаток»
Такие задачи имеют в условии легко узнаваемый признак: указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ.
Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) ведутся последующие расчёты.
Задача 23. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
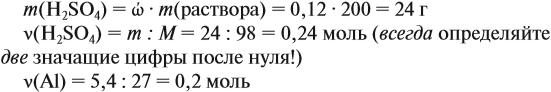
Составим уравнение реакции:
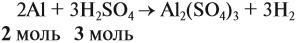
Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:
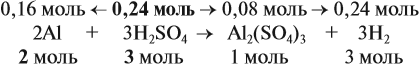
Теперь можно ответить на все вопросы задачи. Объём водорода рассчитать несложно, поскольку мы уже определили количество (моль) этого вещества.
Задание. Рассчитайте объём водорода.
Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по количеству вещества её.
Массу раствора всегда следует рассчитывать по формуле:
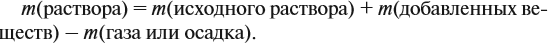
В данном случае:
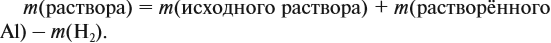
Обратите внимание: следует добавить не ту массу алюминия, которую, добавили в раствор, а только ту, которая вступила в реакцию:
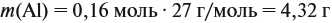
Задание. Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитаем массовую долю соли в полученном растворе:
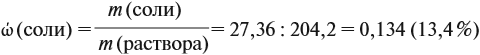
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Анализ на «избыток — недостаток» позволяет установить и качественный и количественный состав реакционной смеси. Особенно важен этот анализ в случае, когда могут получаться кислые или основные соли.
Задача 24. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При решении подобных задач следует учитывать, что при взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. В данном случае, если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
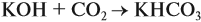
А если щёлочь в избытке (2 : 1 и более), то получается средняя соль:
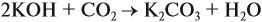
Поэтому в начале нужно рассчитать количество вещества обоих компонентов:
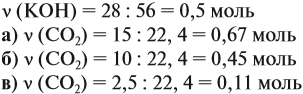
В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
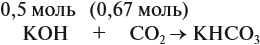
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) < ν (КОН), т. е. когда КОН в избытке, происходят обе реакции. Легко видеть, что 0,11 моль СО2 полностью прореагирует с 0,11 · 2 = 0,22 моль КОН. Поэтому, фактически, идёт только вторая реакция:
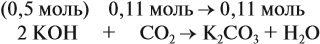
и образуется только средняя соль в количестве 0,11 моль.
Во втором случае (б) идут обе реакции:
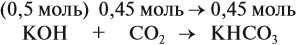
Здесь остаётся в избытке 0,5 – 0,45 = 0,05 моль КОН, который вступает в следующую стадию процесса:
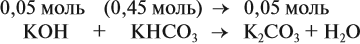
В этой реакции остаётся 0,45 – 0,05 = 0,4 моль КНСО3 и образуется 0,05 моль К2СО3.
Внимание!
Теперь можно подвести итог, определив, когда нужно определять количества заданных веществ в моль, а когда — нет.
Определять количества заданных веществ в моль НЕ НУЖНО, когда:
- расчёт ведут по одному уравнению, по которому нужно определить массу или объём реагирующих веществ (см. задачу 18);
- расчёт ведут для газов, для которых известен объём (см. задачу 19).
Определять количества заданных веществ в моль НУЖНО, когда:
- определяют избыток (недостаток) реагирующих веществ (см. задачу 23);
- расчёт ведут по нескольким уравнениям. Для примера рассмотрим задачу 25.
Задача 25. Для нейтрализации раствора фенола в этаноле потребовалось 25 мл 40 %-ного раствора КОН (ρ = 1,4 г/мл). При взаимодействии исходного раствора с натрием может выделиться 6,72 л газа. Определить состав исходной смеси.
Известно, что со щелочами реагируют только фенолы:
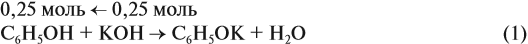
Рассчитаем:
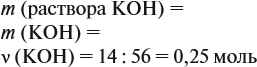
подставим полученную величину в уравнение реакции (1). Составим уравнения реакций с натрием и перенесём в уравнение (2) количество вещества фенола:
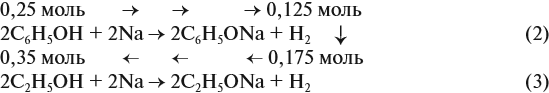
Но в реакциях (2) и (3) было получено 0,3 моль водорода (6,72 л : 22,4 л/моль = 0,3 моль), значит, в реакции (3) было получено 0,175 моль Н2. Теперь легко найти количественный состав смеси.
И, наконец, понятие моль необходимо при установлении формулы вещества (см. урок 31.4).

Задачи для самостоятельного решения
62. Через 200 мл 13 %-ного раствора гидроксида бария (пл. = 1,1 г/мл) пропустили 2 л хлороводорода. Определить цвет индикатора в полученном растворе и массу полученной соли.
63. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59 %-ной ортофосфорной кислоты. Определить состав и массовую долю соли в полученном растворе.
64. 8,4 г карбоната магния растворили в 250 мл 15 %-ного раствора серной кислоты (пл. = 1,08 г/мл). Определить массовую долю соли в полученном растворе.
65. 8,4 г цинка растворили в 70 г 120 %-ной соляной кислоты. Определить массовую долю соли в полученном растворе.
66. 25 л СО2 пропустили через 500 г 7,5 %-ного раствора едкого натра. Рассчитать массовые доли солей в полученном растворе.
67. Рассчитать массовую долю кислоты в растворе, полученном смешением 200 мл 15 %-ного раствора серной кислоты (пл. = 1,2 г/мл) с 150 мл 10 %-ного раствора нитрата бария (пл. = 1,04 г/мл).
68. Какой объём газа выделится, если 3,2 г меди растворить в 50 г 30 %-ной азотной кислоты? Чему равны массовые доли растворённых веществ в полученном растворе?
69. Твёрдое вещество, полученное при прокаливании карбоната кальция, растворили в воде. Через полученный раствор пропустили сернистый газ, в результате чего образовалась кислая соль массой 101 г. Определить массу карбоната и объёмы газов.
70. Смешали 200 г 12 %-ного раствора дигидрофосфата натрия и 150 г 5 %-ного раствора гидроксида натрия. Какие вещества содержатся в полученном растворе? Определить их массовые доли и реакцию среды раствора.
71. Через 100 мл 1,48 %-ного раствора сульфата меди (пл. = 1,08 г/мл) пропустили 300 мл сероводорода. Рассчитать массу осадка и массовую долю кислоты в полученном растворе.
72. Смешали 12 л бутена и 12 л кислорода. Смесь подожгли. Какой из этих газов и в каком объёме останется в смеси после реакции? Какой объём газа и жидкой воды образуется при этом?
73. Вычислить массу фенолята натрия, который образуется при взаимодействии 9,4 г фенола с 50 г 12 %-ного раствора гидроксида натрия.
74. Сколько граммов карбида кальция, который содержит 16 % примесей, нужно для получения 30 г уксусной кислоты?

Задачи на установление формулы вещества
Молекулярная формула вещества отражает его количественный состав. Количественный состав вещества, как и количественный состав раствора, выражают при помощи массовых долей элементов в нём:
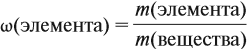
Поскольку масса вещества в условии задачи, как правило, не указывается, применяем уже опробованный способ:
Пусть количество вещества равно 1 моль, тогда:
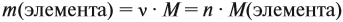
где n — число атомов этого элемента в веществе;
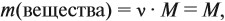
так как количество вещества равно 1 моль.
Получаем:
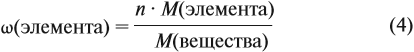
Задача 26. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
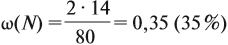
Ответ. ω(N) = 35 %.
Зная массовые доли химических элементов в веществе (элементный состав), можно определять молекулярную формулу неизвестного вещества.
Задача 27. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы (4) следует, что:
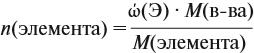
Поэтому отношение числа атомов n элементов данном в веществе равно:
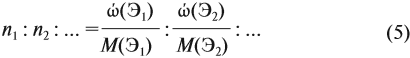
Согласно этой формуле, нам нужно найти ώ(О) в этом оксиде:
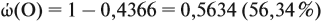
Подставим все данные в формулу (5):
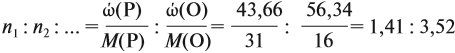
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число:
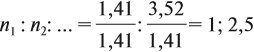
Поскольку число атомов не может быть дробным, обе величины умножим на 2:
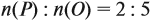
Ответ. Искомая формула — Р2О5.
Если в задаче не указано, какой элемент входит в состав оксида, но указана его валентность, задача упрощается.
Задача 28. Массовая доля трёхвалентного элемента в оксиде равна 70 %. Установить формулу этого оксида.
Решение. Формула оксида Э2О3:
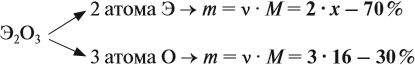
Из выделенной жирным шрифтом пропорции получаем:
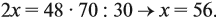
Это железо.
Ответ. Формула оксида Fe2O3.
Эту задачу можно решить и по формуле:
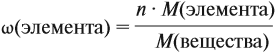
Подставив данные задачи, получаем:

если М(элемента) = х, то М(вещества) равна 2х + 48.
Решите теперь полученное уравнение:
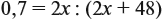
Ответ. х = 56, значит, формула оксида Fe2O3.
Задача 29. Установить формулу углеводорода, если он содержит 12,19 % водорода. Плотность по водороду равна 41.
Решение. Сначала составим общую формулу углеводорода СхHу и рассчитаем массовую долю Н в нём:
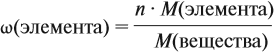
где n — число атомов.
По данным задачи рассчитаем массовую долю углерода:
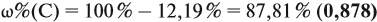
и молярную массу вещества:
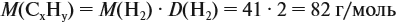
Подставив эти данные в формулу, получаем:
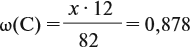
Решив полученное уравнение, получаем n = 6 (атомов углерода).
Найдём массу атомов водорода:
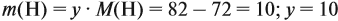
Поэтому формула углеводорода С6H10. Если известен гомологический ряд вещества (общая формула этого ряда), то задача упрощается.
Задача 30. Установить формулу алкина, если он содержит 12,19 % водорода.
Решение. Сначала составим общую формулу алкина СnH2n–2 и рассчитаем массовую долю Н в нём:
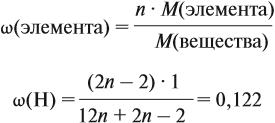
Решив полученное уравнение, получаем n = 6 (атомов углерода). Поэтому формула алкина С6H10.
Аналогично задаче 27 решаются все задачи, в которых дан элементный состав вещества, независимо от числа элементов.
Задача 31. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:
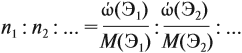
Подставим данные задачи в эту формулу:
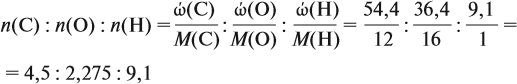
Полученные величины (они должны содержать 2 значащие цифры после запятой) разделим на наименьшее число (2,275):
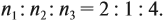
Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2. Это может быть или одноосновная предельная кислота, или её эфир.
Задача 32. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:
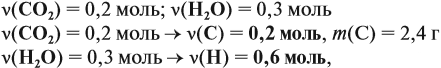
поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:
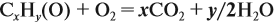
получаем молярные соотношения продуктов реакции:
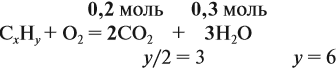
Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:
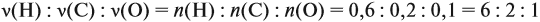
Молекулярная формула вещества С2Н6О.
Этот способ определения молекулярной формулы оптимален, когда неизвестна молекулярная масса вещества, поскольку, если молярная масса дана и задана в задаче через плотность или иначе, то задача решается «в лоб» — по уравнению химической реакции.
Задача 33. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
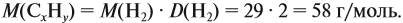
Теперь составим схему реакции, обозначив формулу исходного вещества СхНу
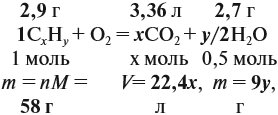
Из выделенных параметров составим пропорции, сначала для СО2:
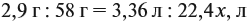
а затем для воды:
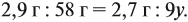
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Задача 34. Установить формулу алкена, если 11,2 г его при взаимодействии с бромоводородом образует 27,4 г бромида с положением брома у третичного атома углерода.
Решение. Вначале рассчитаем массу бромоводорода, согласно закону сохранения массы:
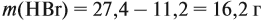
и составим уравнение реакции, используя общую формулу алкенов:
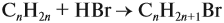
откуда найдём количество вещества алкена:
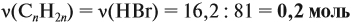
Теперь легко определить молярную массу неизвестного вещества:
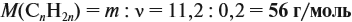
Определим молярную массу неизвестного вещества через n:
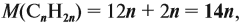
отсюда: 14n = 56; n = 4.
Ответ. Состав искомого алкена С4Н8; это 2-метилпропен.

Задачи для самостоятельного решения
75. Оксид неметалла (V), содержащего 56,3 % кислорода, растворили в воде. Определить массовую долю вещества в этом растворе, если исходный оксид был получен из 3,1 г неметалла.
76. Какой щелочной металл образует сульфат с массовой долей кислорода 23,9 %?
77. Плотность паров алкана равна 3,214 г/л. Определите его молекулярную массу. Какую формулу имеет этот углеводород?
78. Один литр алкена имеет массу 1,25 г. Определите молярную массу этого вещества. Составьте его графическую формулу.
79. Углеводород с плотностью по гелию 28,5 содержит 15,8 % водорода. Установить его формулу.
80. При сгорании 2,24 л углеводорода получили 8,96 л СО2 и 7,2 мл воды. Определить формулу углеводорода.
81. Органическое вещество содержит 37,7 % С, 6,3 % Н и 56 % Сl; 6,35 г его паров занимает объём 11,2 л. При гидролизе этого соединения образуется вещество, которое при восстановлении даёт вторичный спирт. Определить состав и строение исходного вещества.
82. При сгорании 1 л газообразного углеводорода, обесцвечивающего раствор перманганата калия, расходуется 4,5 л кислорода и образуется 3 л СО2. Определить формулу углеводорода.
83. Установить формулу вещества, при сгорании 4,6 г которого образуется 4,48 л СО2 и 5,4 мл воды. Плотность паров этого вещества по водороду равна 23.
84. При взаимодействии 16 г одноатомного спирта с натрием выделилось 5,6 л водорода. Какой спирт был взят для реакции?
85. Одноосновная кислота имеет состав: ώ(С) = 40 %; ώ(Н) = 6,67 %; ώ (О) = 53,33 %. Плотность паров её по аргону 1,5. Какая это кислота?
86. Определить строение сложного эфира предельной α-аминоуксусной кислоты, если известно, что он содержит 15,73 % азота.
87. Имеется смесь четырёх изомеров, каждый из которых реагирует с НСl и содержит в молекуле 23,7 % азота. Определить строение этих соединений и массу исходной смеси, если известно, что вещества предельные, а при сгорании смеси образуется 4,48 л азота.

Задачи, в которых учитывается «выход» полученного вещества
Реальные химические процессы никогда не происходят со 100 %-ным выходом, который рассчитывается по уравнению реакции. Например, вы рассчитали, что должно выделиться 100 л газа, а реально его получено 60 л. Значит, выход (ή) в этой реакции равен:

Выход продукта выражается в долях единицы или в процентах. В нашем примере:
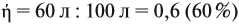
Задача 35. Рассчитать массы исходных веществ, необходимых для получения 91 г нитрида кальция, что составляет 80 % от теоретически возможного.
Следует помнить, что в уравнение химической реакции можно подставлять данные только теоретического выхода. Поэтому рассчитаем его (Т):
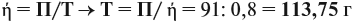
Подставим полученную величину в уравнение реакции и найдём искомые величины:
Задание. Остальной расчёт сделайте самостоятельно.
Задачи для самостоятельного решения
88. Какой объем этилена можно получить из 92 граммов спирта? Выход составляет 80 % от теоретически возможного количества.
89. Сколько граммов хлорвинила можно получить из 56 л ацетилена, если выход составляет 80 %?
90. 46 г глицерина обработали азотной кислотой. Рассчитайте массу полученного вещества, если выход составляет 40 %. Где применяется это вещество?
91. Из 56 л ацетилена получили 88 г этаналя. Рассчитайте выход в % от теоретически возможного.
92. Сколько граммов спирта нужно взять, чтобы получить 7,4 г этилформиата, что составляет 80 % от теоретического выхода?
93. При нагревании 2,84 г иодметана с 0,69 г натрия получено 179,2 мл углеводорода. Определить выход в % от теоретически возможного.
94. 184 г толуола прореагировали с 1,5 моль хлора в присутствии хлорида алюминия. Реакция протекала с выходом 90 % от теоретически возможного. Вычислить объём полученного газа, водный раствор которого не окрашивает раствор фенолфталеина.
95. При нагревании 28,75 мл алканола (ρ = 0,8 г/мл) с концентрированной серной кислотой, получили газ, который может присоединить 8,96 л водорода. Определить строение спирта, если выход газа составляет 80 %.
96. Какой объём 40 %-ного формалина с плотностью 1,1 г/мл можно получить из 48 мл метанола? Плотность спирта 0,8 г/мл. Выход 80 %.
97. Сколько граммов эфира можно получить при взаимодействии 30 г уксусной кислоты и 30 г этанола с выходом 30 %?
