Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 – mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Расчёт мольной доли (φ) вещества
Для характеристи состава многокомпонентной системы (смеси веществ или раствора) часто требуется определить мольную долю (φ) отдельного компонента в этой системе.
Мольная доля вещества – содержание вещества в смеси (растворе), выраженное отношением числа молей этого вещества к общему числу молей всех веществ, содержащихся в смеси.
Мольная доля φ(компонента) в смеси вычисляется по формуле:
φ(компонента) = ν(компонента) / сумма ν(компонентов смеси).
Задача 1. Какова мольная доля пропана в пропан-бутановой смеси, если его массовая доля в этой смеси составляет 75%?
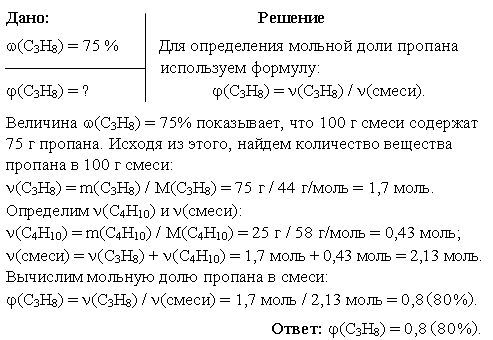
Задача 2. Синтетический каучук марки СКC-30 (сополимер бутадиена-1,3 и стирола) содержит 23,5% (по массе) звеньев стирола. Определите мольную долю звеньев бутадиена-1,3 в этом сополимере.
Решение
Сополимер бутадиена-1,3 и стирола образуется по схеме:
nCH2=CH–CH=CH2 + mCH2=СН–C6H5  [(–CH2–CH=CH–CH2–)x(–CH2–CH(C6H5)–)y]n+m
[(–CH2–CH=CH–CH2–)x(–CH2–CH(C6H5)–)y]n+m
1 ≤ x << n; 1 ≤ y << m;
По условию задачи ω(–CH2–CH(C6H5)–) = 23,5%, то есть 100 г сополимера содержат 23,5 г звеньев стирола C8H8 и 76,5 г бутадиеновых звеньев C4H6.
Найдём количество вещества C4H6 в 100 г сополимера:
ν(C4H6) = m(C4H6) / M(C4H6) = 76,5 г / 54 г/моль = 1,42 моль.
Определим количество вещества C8H8:
ν(C8H8) = m(C8H8) / M(C8H8) = 23,5 г / 104 г/моль = 0,22 моль.
Мольную долю звеньев бутадиена-1,3 рассчитаем по формуле:
φ(C4H6) = ν(C4H6) / [ν(C4H6) + ν(C8H8)] = 1,42 / 1,64 = 0,87 или 87%.
Ответ: φ(C4H6) = 0,87 (87%)
2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
![]() ,
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
![]() или
или
![]() ,
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
![]() ,
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
![]()
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
![]() ,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
![]() или
или
для двух состояний
![]() ,
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
![]()
или
для двух состояний
![]() ,
,
г)
объединенный газовый закон (m=const)
![]() или
или
для двух состояний
![]() .
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
![]() ,
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
![]() .
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
![]() ,
,
где
т
—
масса смеси.
Концентрация молекул
![]() ,
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
![]() ,
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно – кинетической теории газов
![]() ,
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как найти моль вещества
В химии широко используется понятие «моль». Это такое количество вещества, в котором содержится приблизительно 6,02214*10^23 его элементарных частиц — молекул, ионов или атомов. Для облегчения расчетов это огромное число, которое называется числом Авогадро, часто округляют до 6,022*10^23. Моль измеряется в граммах.

Инструкция
Чтобы найти моль вещества, нужно запомнить очень простое правило: масса одного моля любого вещества численно равна его молекулярной массе, только выражается в других величинах. А как определяется молекулярная масса? С помощью таблицы Менделеева вы узнаете атомную массу каждого элемента, входящего в состав молекулы вещества. Далее нужно сложить атомные массы с учетом индекса каждого элемента и получится ответ.
Например, широко используемое в сельском хозяйстве удобрение, аммиачная селитра (или по-другому аммоний азотнокислый). Формула этого вещества NH4NO3. Как определить, чему равен его моль? Прежде всего запишите эмпирическую (то есть общую) формулу вещества: N2H4O3.
Посчитайте его молекулярную массу с учетом индекса каждого элемента: 12*2 + 1*4 + 16*3 = 76 а.е.м. (атомных единиц массы). Следовательно, его молярная масса (то есть масса одного моля) также составляет 76, только ее размерность: грамм/моль. Ответ: один моль аммиачной селитры весит 76 грамм.
Предположим, вам задана такая задача. Известно, что масса 179,2 литров какого-то газа составляет 352 грамма. Необходимо определить, сколько весит один моль этого газа. Известно, что при нормальных условиях один моль любого газа или смеси газов занимает объем, приблизительно равный 22,4 литра. А у вас 179,2 литра. Произведите вычисление: 179,2/22,4 = 8. Следовательно, в этом объеме содержится 8 молей газа.
Разделив известную по условиям задачи массу на количество молей, получите: 352/8 = 44. Следовательно, один моль этого газа весит 44 грамма – это углекислый газ, СО2.
Если имеется какое-то количество газа массой М, заключенное в объеме V при заданной температуре Т и давлении P. Требуется определить его молярную массу (то есть найти, чему равен его моль). Решить задачу вам поможет универсальное уравнение Менделеева-Клапейрона: PV = MRT/m, где m – та самая молярная масса, которую нам надо определить, а R – универсальная газовая постоянная, равная 8,31. Преобразуя уравнение, получите: m = MRT/PV. Подставив в формулу известные величины, вы найдете, чему равен моль газа.
Полезный совет
В расчетах обычно используются округленные величины атомных весов элементов. Если требуется более высокая точность, то округление недопустимо.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
