Как найти число молекул в газе
Молекула – это электрически нейтральная частица, обладающая всеми химическими свойствами, присущими данному конкретному веществу. В том числе и газам: кислороду, азоту, хлору и т.д. Как можно определить количество молекул газа?

Инструкция
Если вам необходимо подсчитать, сколько молекул кислорода содержится в 320 граммах этого газа при нормальных условиях, прежде всего, определите, какое количество молей кислорода заключено в этом количестве. По таблице Менделеева, можно увидеть, что округленная атомная масса кислорода – 16 атомных единиц. Поскольку молекула кислорода – двухатомная, масса молекулы составит 32 атомные единицы. Следовательно, количество молей 320/32 = 10.
Дальше вам поможет универсальное число Авогадро, названное в честь ученого, предположившего, что равные объемы идеальных газов при постоянных условиях содержат одинаковые количества молекул. Оно обозначается символом N(A) и очень велико – приблизительно составляет 6,022*10(23). Умножьте это число на вычисленное количество молей кислорода и вы узнаете, что искомое количество молекул в 320 граммах кислорода – 6,022*10(24).
А если вам известно давление кислорода, а также объем, занимаемый им, и температура? Как вычислить количество его молекул при таких данных? И тут нет ничего сложного. Надо лишь записать универсальное уравнение Менделеева-Клапейрона для идеальных газов:
PV = RTM/m
Где P – давление газа в паскалях, V – его объем в кубических метрах, R – универсальная газовая постоянная, M – масса газа, а m – его молярная масса.
Cлегка преобразуя это уравнение, вы получите:
M = PVm/RT
Поскольку у вас есть все необходимые данные (давление, объем, температура заданы изначально, R = 8,31, а молярная масса кислорода = 32 грамма/моль), вы элементарно найдете массу газа при данном объеме, давлении и температуре. А дальше задача решается точно так же, как и в вышеописанном примере: N(A)M/m. Произведя вычисления, вы узнаете, сколько молекул кислорода содержится при заданных условиях.
Можно еще более упростить решение, поскольку в полученной дроби N(A)PVm/RTm молярные массы сокращаются, и остается: N(A)PV/RT. Подставив в формулу известные вам величины, вы получите ответ.
Видео по теме
Полезный совет
Ни один реальный газ (включая кислород), конечно же, не является идеальным, поэтому уравнение Менделеева-Клапейрона можно использовать для расчетов лишь при условиях, не очень сильно отличающихся от нормальных.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Газ обладает высокой реакционной способностью по сравнению с жидкими и твердыми телами ввиду большой площади его активной поверхности и высокой кинетической энергии образующих систему частиц. При этом химическая активность газа, его давление и некоторые другие параметры зависят от концентрации молекул. Рассмотрим в данной статье, что это за величина и как ее можно вычислить.
О каком газе пойдет речь?
В данной статье будут рассмотрены так называемые идеальные газы. В них пренебрегают размерами частиц и взаимодействием между ними. Единственным процессом, который происходит в идеальных газах, являются упругие столкновения между частицами и стенками сосуда. Результатом этих столкновений является возникновение абсолютного давления.
Любой реальный газ приближается по своим свойствам к идеальному, если уменьшать его давление или плотность и увеличивать абсолютную температуру. Тем не менее существуют химические вещества, которые даже при низких плотностях и высоких температурах далеки от идеального газа. Ярким и всем известным примером такого вещества является водяной пар. Дело в том, что его молекулы (H2O) являются сильно полярными (кислород оттягивает на себя электронную плотность от атомов водорода). Полярность приводит к появлению существенного электростатического взаимодействия между ними, что является грубым нарушением концепции идеального газа.
Универсальный закон Клапейрона-Менделеева
Чтобы уметь рассчитывать концентрацию молекул идеального газа, следует познакомиться с законом, который описывает состояние любой идеальной газовой системы независимо от ее химического состава. Этот закон носит фамилии француза Эмиля Клапейрона и русского ученого Дмитрия Менделеева. Соответствующее уравнение имеет вид:
P*V = n*R*T.
Равенство говорит о том, что произведение давления P на объем V всегда для идеального газа должно быть прямо пропорционально произведению температуры абсолютной T на количество вещества n. Здесь R – это коэффициент пропорциональности, который получил название универсальной газовой постоянной. Она показывает величину работы, которую 1 моль газа выполняет в результате расширения, если его на 1 К нагреть (R=8,314 Дж/(моль*К)).
Концентрация молекул и ее вычисление
Согласно определению под концентрацией атомов или молекул понимают количество частиц в системе, которое приходится на единицу объема. Математически можно записать:
cN = N/V.
Где N – общее число частиц в системе.
Прежде чем записать формулу для определения концентрации молекул газа, вспомним определение количества вещества n и выражение, которое связывает величину R с постоянной Больцмана kB:
n = N/NA;
kB = R/NA.
Используя эти равенства, выразим отношение N/V из универсального уравнения состояния:
P*V = n*R*T =>
P*V = N/NA*R*T = N*kB*T =>
cN = N/V = P/(kB*T).
Таким образом мы получили формулу для определения концентрации частиц в газе. Как видно, она прямо пропорционально зависит от давления в системе и обратно пропорционально от абсолютной температуры.
Поскольку количество частиц в системе велико, то концентрацией cN пользоваться неудобно при выполнении практических расчетов. Вместо нее чаще используют молярную концентрацию cn. Она для идеального газа определяется так:
cn = n/V = P/(R *T).
Пример задачи
Необходимо рассчитать молярную концентрацию молекул кислорода в воздухе при нормальных условиях.
Для решения этой задачи вспомним, что в воздухе находится 21 % кислорода. В соответствии с законом Дальтона кислород создает парциальное давление 0,21*P0, где P0 = 101325 Па (одна атмосфера). Нормальные условия также предполагают температуру 0 oC (273,15 К).
Мы знаем все необходимые параметры для вычисления молярной концентрации кислорода в воздухе. Получаем:
cn(O2) = P/(R *T) = 0,21*101325/(8,314*273,15) = 9,37 моль/м3.
Если эту концентрацию привести к объему 1 литр, то мы получим значение 0,009 моль/л.
Чтобы понять, сколько молекул O2 содержится в 1 литре воздуха, следует умножить рассчитанную концентрацию на число NA. Выполнив эту процедуру, получим огромное значение: N(O2) = 5,64*1021 молекул.
Во́здух — смесь газов, главным образом состоящая из азота и кислорода (в совокупности 98—99 % в зависимости от влажности, то есть концентрации водяного пара), а также аргона, углекислого газа, водорода, образующая земную атмосферу. Воздух составляет воздушную оболочку Земли и необходим для нормального существования аэробных живых организмов. Кислород, содержащийся в воздухе, в процессе дыхания поступает в клетки организма и используется в процессе окисления, в результате которого происходит выделение необходимой для жизни энергии (метаболизм, аэробы). В промышленности и в быту кислород воздуха используется для сжигания топлива с целью получения тепла и механической энергии в двигателях внутреннего сгорания. Из воздуха, используя метод сжижения, добывают инертные газы.
Доказательства зонального распределения температуры воздуха: температура понижается от экватора к полюсам. В этом направлении угол падения солнечных лучей уменьшается, что приводит к снижению нагревания земной поверхности. Средняя годовая температура на всей земной поверхности +14 °C. Южное полушарие холоднее Северного.
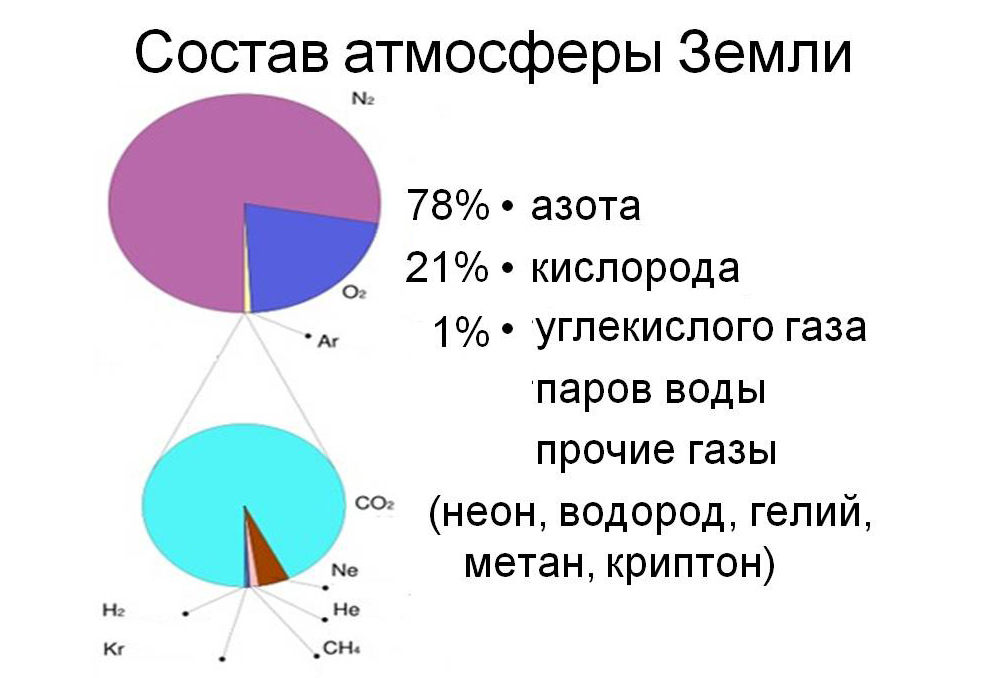
Химический состав[править | править код]
Состав земной атмосферы по объёму, за исключением водяного пара.
В 1754 году Джозеф Блэк экспериментально доказал, что воздух представляет собой смесь газов, а не простое вещество[1].
| Вещество | Обозначение | По объёму, % | По массе, % |
|---|---|---|---|
| Азот | N2 | 78,084 | 75,5 |
| Кислород | O2 | 20,946 | 23,15 |
| Аргон | Ar | 0,934 | 1,292 |
| Углекислый газ | CO2 | 0,03 | 0,046 |
| Неон | Ne | 0,001818 | 0,0014 |
| Криптон | Kr | 0,000114 | 0,0003[2] |
| Метан | CH4 | 0,0002 | 0,000084 |
| Гелий | He | 0,000524 | 0,000073 |
| Водород | H2 | 0,0005 | 0,00008 |
| Ксенон | Xe | 0,0000087 | 0,00004 |
| Другие | 0,007323 |
Состав воздуха может меняться в небольших пределах: в крупных городах содержание углекислого газа немного выше, чем в лесах; в высокогорье и на больших высотах концентрация кислорода немного ниже вследствие того, что молекулы кислорода тяжелее молекул азота и потому концентрация кислорода с высотой уменьшается быстрее.
Существенное влияние на концентрацию газов в воздухе оказывает водяной пар, концентрация которого зависит от температуры, влажности, времени года, климата. Так, при температуре 0 °C 1 м³ воздуха может содержать максимально 5 граммов воды, а при температуре +10 °C — уже 10 граммов.
Физические свойства[править | править код]
| Параметр | Значение | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Средняя молярная масса | 28,98 г/моль | |||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
| Средняя удельная теплоёмкость при постоянном давлении cp | 1,006 кДж/(кг·К) | |||||||||||||||||||||||||||||||
| Средняя удельная теплоёмкость при постоянном объёме cv | 0,717 кДж/(кг·К) | |||||||||||||||||||||||||||||||
| Показатель адиабаты | 1,40 | |||||||||||||||||||||||||||||||
| Скорость звука (при н. у.) | 331 м/с (1193 км/ч)[3] | |||||||||||||||||||||||||||||||
| Средний коэффициент теплового расширения в интервале температур 0—100 °C | 3,67⋅10−3 1/К | |||||||||||||||||||||||||||||||
| Коэффициент динамической вязкости воздуха (при н. у.) | 17,2 мкПа·с | |||||||||||||||||||||||||||||||
| Растворимость воздуха в воде | 29,18 см3/л | |||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
| Показатель преломления (при стандартных условиях) | 1,0002926 | |||||||||||||||||||||||||||||||
| Коэффициент изменения показателя преломления | 2,8⋅10−9 1/Pa | |||||||||||||||||||||||||||||||
| Средняя поляризуемость молекулы | 1,7⋅10−30 | |||||||||||||||||||||||||||||||
| Константа Сатерленда Sat | 171⋅10−7 |
См. также Жидкий воздух
Воздух в философии[править | править код]
В философии Эмпедокла воздух (аэр) — это одна из четырёх стихий космоса, наряду с огнём, землёй и водой. В философии Аристотеля воздух относится к подлунным лёгким элементам.
Немецкий мыслитель Фридрих Вильгельм Ницше писал о воздухе, что это наивысшая и самая тонкая из материй. Из воздуха соткана свобода человека. Поэтому символ воздуха — это в первую очередь символ свободы. Это свобода, для которой нет никаких преград, ведь воздух нельзя ограничить, нельзя поймать и придать ему форму[4][5].
Это символ не только физической, но и духовной свободы, свободы мысли. Поэтому присутствие символов воздуха на какой-либо поверхности говорит о лёгкости мышления, свободе и непредсказуемости[6].
Воздух в искусстве[править | править код]
- Фантастический роман «Продавец воздуха» (автор А. Р. Беляев, 1929 год) и одноимённая экранизация этого романа.
См. также[править | править код]
Примечания[править | править код]
- ↑ Gribbin, John. Science. A History (1543-2001). — L.: Penguin Books, 2003. — 648 с. — ISBN 978-0-140-29741-6.
- ↑ В.Г. Фастовский, А.Е. Ровинский, Ю.В. Петровский. Инертные газы. Изд. 2. — Москва: Атомиздат, 1972. — С. 6. — 352 с.
- ↑
Скорость звука // Физическая энциклопедия / под. ред. А. М. Прохорова. — М.: «Советская энциклопедия», 1988. — Т. 4. - ↑ Ковальчук Т. Ю. Структура художественного пространства в лирике Д. С. Мережковского 1880—1900-х годов Архивная копия от 18 января 2015 на Wayback Machine // Вестник Челябинского государственного университета. Филология. Искусствоведение. — Вып. 49.— 2010. — № 34 (215). — С. 58.
- ↑ Энциклопедия символов, знаков, эмблем. / авт.-сост. В. Андреева и др. — М. : МИФ : АСТ, 2001. — С. 96—97.
- ↑ Воздух // Символы, знаки, эмблемы: Энциклопедия / авт.-сост. В. Э. Багдасарян, И. Б. Орлов, В. Л. Телицын; под общ. ред. В. Л. Телицына. — 2-е изд. — М.: ЛОКИД-ПРЕСС, 2005. — 495 с.
Ссылки[править | править код]
- Физические свойства воздуха — таблица значений
Условие задачи:
Найти число молекул воздуха в комнате, имеющей объем 8x5x4 м3, при температуре 10° C и давлении 100 кПа.
Задача №4.2.22 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(a=8) м, (b=5) м, (c=4) м, (t=10^circ) C, (p=100) кПа, (N-?)
Решение задачи:
Сразу отметим, что молекул воздуха не существует, так как воздух – это смесь газов (азота, кислорода, углекислого газа и других). В этой задаче воздух рассматривается как однородный газ (то есть состоящий из одинаковых молекул), что верно лишь в качестве модели, но в действительности это не так.
Запишем формулу связи давления идеального газа (p) с концентрацией молекул (n) и температурой (T) (она выводится в молекулярно-кинетической теории):
[p = nkT;;;;(1)]
Здесь (k) – постоянная Больцмана, равная 1,38·10-23 Дж/К. Концентрацию молекул (n) можно найти по следующей формуле:
[n = frac{N}{V}]
В этой формуле (N) – число молекул, (V) – объем газа. Полученное выражение для нахождения концентрации подставим в формулу (1), тогда получим:
[p = frac{N}{V}kT]
Откуда число молекул (N) равно:
[N = frac{{pV}}{{kT}}]
Объем комнаты легко найти по следующей формуле:
[V = abc]
В итоге получим:
[N = frac{{pabc}}{{kT}}]
Переведем температуру в Кельвины и посчитаем ответ к задаче:
[10^circ;C = 283;К]
[N = frac{{100 cdot {{10}^3} cdot 8 cdot 5 cdot 4}}{{1,38 cdot {{10}^{ – 23}} cdot 283}} = 4,097 cdot {10^{27}}]
Число молекул в физике является безразмерной величиной.
Ответ: 4,097·1027.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.2.21 Газ массой 16 г при давлении 1 МПа и температуре 112 C занимает объем 1600 см3
4.2.23 Вычислить молярную массу бутана, 2 л которого при температуре 15 C и давлении 87 кПа
4.2.24 Какая часть газа осталась в баллоне, давление в котором было 12,2 МПа, а температура
Когда мы думаем о земной атмосфере, то считаем, что она состоит из кислорода. Но на самом деле атмосфера нашей планеты — это смесь многих газов. Если схватить первую попавшуюся молекулу воздуха, то скорее всего она окажется молекулой азота.
Состав атмосферы Земли
На долю этого газа приходится 77 процентов объема атмосферы Земли. На долю кислорода приходится 21 процент. Остальной объем составляют следы других газов и водяной пар. Остальные газы — это двуокись углерода углекислый газ, используется при изготовлении газированных напитков, неон применяется в электрическом освещении. Гелий – наполнитель воздушных шаров, метан, криптон, закись азота «веселящий газ», обезболивающее средство в хирургии, водород, озон, ксенон и др.
Молекулы газов
Молекулы газов, распространенных и очень редких, равномерно перемешаны в воздухе (хотя большая часть озона находится в тонком слое атмосферы на высоте около 24 километров). Молекулы летают вокруг нас со скоростями от 1 100 до 4 800 километров в час. Траектории их полета так коротки, что их невозможно различить не вооруженным глазом. Пока вы это читаете, молекула криптона наверняка уже успела побывать у вас в носу.
Представьте себе, что сантиметр поделен на миллиард равных частей. Одна из этих частей примерно равна диаметру молекулы воздуха. Молекулы — это связки атомов, лучше даже сказать, что это гроздья из атомов. Чем больше атомов соединены вместе, тем крупнее молекула. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Но есть крупные молекулы, например молекулы ДНК, содержащиеся в животных и растительных клетках, которые состоят из десятков миллионов атомов.
Размер молекул газов атмосферы Земли
Большинство молекул воздуха очень малы. Например, молекула кислорода состоит из двух атомов кислорода, молекула азота — из двух атомов азота. Каждая из этих молекул измеряется стомиллионными и миллиардными долями сантиметра. Очень трудно представить себе дюйм, поделенный на столь мелкие части. Но мы можем получить некоторое представление о размерах молекул воздуха, если сравним их с кристаллами поваренной соли, как это предложили сделать ученые Джеральд Файнберг и Роберт Шапиро в своей книге «Жизнь за пределами Земли».
Сравнение размеров молекул воздуха с кристаллами соли
Итак, насыпьте перед собой на стол немного соли. Выберите из кучки самый мелкий кристаллик. А теперь вообразите себя Алисой в стране чудес. Сейчас вы начнете стремительно расти вниз, уменьшаясь в размерах. При этом кристаллик соли заметно вырастает. Вот он уже с детскую кроватку. Вот он стал размером с дом. Вот кристалл уже упирается в небо.
Но вы все еще не настолько малы, чтобы почувствовать, что такое молекула воздуха. Вы все еще не можете сопоставить размеры молекулы и крупинки соли. Постепенно вершина кристалла соли исчезает из виду. Теперь он для вас имеет высоту 100 небоскребов, поставленных один на другой. И вдруг вы замечаете пушинку и пытаетесь ее поймать. Так что, то, что лежит у вас в ладони, и есть средняя молекула воздуха. Сравнив эту величину с крупинкой соли высотой в 100 небоскребов, вы наглядно представите себе, что такое молекула.
Интересное видео о атмосфере Земли
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.