Порядок и молекулярность реакции
Реакции, подчиняющиеся
уравнениям типа:
принято
классифицировать по признаку кинетического
порядка.
Общим или суммарным
порядком реакции называют сумму всех
показателей степеней при концентрациях
в выражении закона действующих масс,
установленным опытным путем:
n
= a
+ b
+ c
…,
где a,
b,
с
частные порядки реакции, соответственно
по веществам A,
B
и C.
Наиболее просты
следующие случаи:
1) реакции нулевого
порядка:
,
n
= 0;
2) реакции первого
порядка:
,
n
= 1;
3
n
= 2;
) реакции второго порядка:,
4
n
= 3.
) реакции третьего порядка:,
,
С общим кинетическим
порядком выше третьего встречаться
практически не приходится.
Для элементарных
реакций (т. е. протекающих в один
элементарный акт) показатели степеней
a,
b
и c
обычно представляют собой положительные
целые числа. Для более сложных реакций
известны дробные и даже отрицательные
показатели.
Другой характеристикой
механизма протекания химических реакций
является молекулярность
реакции.
Молекулярностью
реакции называется число молекул,
участвующих в одном элементарном акте
реакции.
Следует отметить,
что понятие молекулярности можно
применять только для элементарных
реакций. К числу элементарных реакций
относится, например, разложение
1,2-диметилдиазена:
C
= NCH3
C2H6
+ N2.
Данная реакция
является мономолекулярной
в элементарном акте участвует одна
молекула. Если в одном акте в реакцию
вступают две молекулы, то реакция
является бимолекулярной.
Например:
H
+ I2
2HI.
Соответственно
при тримолекулярной
реакции в одном элементарном акте
участвуют три частицы (молекулы):
2
+ O2
2NO2
Интересно, что
большинство реакций, встречающихся на
практике, кажутся простыми. Однако
детальное изучение кинетики показывает,
что зачастую они протекают по более
сложным механизмам. Так, реакция
термического разложения паров дихлорэтана:
C
– CH2Cl
CHCl
= CH2
+ HCl
на первый взгляд
представляется элементарной.
Действительно,
кинетическое уравнение этой реакции
имеет вид:
,
что указывает на
первый порядок.
Однако данная
реакция не является мономолекулярной,
так как протекает в несколько стадий:
1
C2H4Cl2
C2H4Cl
+ Cl•
2
Cl•
+ C2H4Cl2
C2H3Cl2
+ HCl
3
C2H3Cl2
C2H3Cl
+ Cl•
4
C2H4Cl
+ Cl•
C2H4Cl2
В этом механизме
первая и третья стадии мономолекулярны,
а вторая и четвертая – бимолекулярны.
Очевидно, говорить о молекулярности
реакции разложения дихлорэтана в целом
нельзя. В то же время можно говорить о
ее первом кинетическом порядке.
Данный пример
наглядно иллюстрирует факт, что порядок
реакции далеко не всегда совпадает с
ее молекулярностью. В целом, моно-, би-
и тримолекулярные реакции являются,
соответственно, реакциями первого,
второго и третьего порядков; обратное
же заключение может оказаться ошибочным.
Реакции I порядка
Для реакций I
порядка убыль концентрации реагента
определяется уравнением:
|
|
(8) |
где С
– концентрация вещества в данный момент
времени;
С0
– начальная концентрация вещества;
kI
– константа скорости реакции первого
порядка;
– время.
В логарифмической
форме это выражение выглядит так:
|
|
(9) |
Из приведенных
формул можно сделать ряд важных
заключений:
1) константа
скорости реакции первого порядка имеет
размерность [время1]
и может быть выражена в обратных секундах,
минутах, часах и т. д.;
2) величина kI
не зависит от способа выражения
концентрации реагента;
3) в реакциях
первого порядка одинаковым промежуткам
времени отвечают одинаковые доли
прореагировавшего вещества.
Последнее утверждение
позволяет ввести понятие период
полупревращения.
Периодом
полупревращения (1/2)
называют
время, необходимое для превращения
половины первоначального количества
вещества.
Таким образом, в
момент времени
= 1/2
количество непрореагировавшего вещества
составляет
С0.
В этом случае:
|
|
(10) |
Из данной формулы
следует, что в реакциях первого порядка
период полупревращения не зависит от
начальной концентрации реагента.
В некоторых случаях
удобно использовать формулу:
|
|
(11) |
которая позволяет
определить время, за которое превращению
подвергнется определенное количество
исходного вещества.
В организме человека
процессы метаболизма лекарственных
препаратов протекают, в основном, в
соответствии с уравнением реакции
первого порядка. Период, за который
превращению подвергается половина
действующего начала препарата называется
периодом
полувыведения
или полуэлиминации.
Зная величины kI
и 1/2,
можно рассчитать оптимальные промежутки
времени между приемами лекарственного
средства.
Кинетические
уравнения реакций различного порядка
представлены в табл. 2.
Табл. 2. Кинетические
уравнения реакций различного порядка.
|
Порядок |
Кинетическое уравнение |
Решение |
Период |
|
0 |
|
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
* при равных исходных
концентрациях реагирующих веществ
Из приведенных
уравнений следует, что для реакций
различного порядка константы скорости
имеют неодинаковые размерности.
Действительно, константа скорости
реакции второго порядка имеет размерность
[л·моль1·время1)],
третьего порядка
[л2·моль2·время1].
Таким образом,
сравнивать значения констант скорости
реакций различного порядка нельзя.
Соседние файлы в папке часть 1
- #
- #
- #
- #
The order of a reaction and the Molecularity of the reaction is the basic properties of the reaction that helps to get the kinematics and rate of reaction. In this article, we will learn about the Order of Reaction and Molecularity, its types differences, and others in detail.
What is the Molecularity of a Reaction?
The number of reacting species (atoms, ions or molecules) taking part in an elementary reaction, which must collide simultaneously in order to bring about a chemical reaction is called the molecularity of a reaction.
Generally for a reaction aA + bB → cC + dD
Molecularity = a + b
Unimolecular Reactions: The reactions with molecularity 1 are called Unimolecular Reactions examples of which are,
- NH₄NO₂ → N₂ + 2H₂O
- Br₂ → 2Br
Bimolecular Reaction: The reactions with molecularity 2 are called Bimolecular Reactions examples of which are,
- 2HI → H₂ + I₂
Trimolecular Reaction: The reactions with molecularity 1 are called Trimolecular Reactions examples of which are,
- 2NO + O₂ → 2NO₂
The probability of three particles colliding and reacting simultaneously and reacting is very low. Therefore a molecularity higher than three is generally not observed.
An elementary reaction is defined as a reaction that occurs in a single step. Many reactions that follow single rate law actually take place in a series of steps. Such reactions are called complex reactions. Each step of a complex reaction is an elementary reaction.
The concept of molecularity is valid only for elementary reactions.
What is the Order of Reaction?
For any elementary or complex reaction, the order of a reaction is defined as,
“Sum of the coefficients of the reacting compounds that are involved in the rate equation for the reaction.”
The order of Reaction is an experimental value i.e. it is always calculated experimentally.
Determination of Order of Reactions
Consider a reaction aA + bB → cC + dD
The rate law for the above reaction is Rate α [A]ᵃ [B]ᵇ
The sum of the power a and b is called the overall order of the reaction.
i.e. a + b = overall order.
a and b represent the order with respect to reactants A and B individually.
The values of a and b indicate how sensitive the rate of the reaction is to the change in the concentration of A and B.
For Example:
Decomposition of Ammonium Nitrite (NH4NO2)
NH4NO2 → N2 + 2H2O
Rate = k [NH4NO2]
Order of reaction = 1
Dissociation Of HI
2HI → H2 + I2
Rate = k[HI]2
Order of reaction = 2
Characteristics of Order of Reaction
Various characteristics of the order of the reaction are discussed below in the article,
- The order of reaction gives the dependency of the rate of reaction on the concentration of reactants.
- It is an experimentally determined quantity.
- The order of reaction can be zero, fractional, or integral.
- it gives an idea about the rate of reaction.
- It gives information about the reaction mechanism.
- it depends on experimental conditions.
- The order of reaction of both complex and elementary reactions can be determined.
Difference Between Order of Reaction and Molecularity of Reaction
The difference between the Order of Reaction and Molecularity of Reaction is discussed in the table given below,
|
Order of Reaction |
Molecularity of Reaction |
|---|---|
| The sum of the powers of concentration terms involved in the rate equation is known as the order of the reaction. | The sum of the powers of concentration terms involved in the law of mass action is called as molecularity of a reaction. |
| it is a property of both, complex and reactions elementary reactions. | It is the property of only elementary reactions that have third-order no meaning for complex reactions. |
| It is an experimentally determined value. | It is a theoretical value. |
| It may be zero, fractional, or integral. | It can never be zero or fractional. It always has a positive integral value. |
| it depends on experimental conditions. | It is independent of experimental conditions. |
| It gives an idea about the rate of a reaction. | It does not give any idea about the unimolecular rate of the reaction. |
| According to their order, reactions are classified as first, second, and third-order reactions. | According to their molecularity, reactions are classified as unimolecular, bimolecular, and trimolecular reactions. |
Read, More
- Characteristics of Chemical Reactions
- Types of Chemical Reactions
- Rate of a Reaction
Solved Examples on Order of Reaction and Molecularity
Example 1: Find the Order and Molecularity of the reaction N2O5 → N2O3+O2
Solution:
For the above reaction,
Molecularity of reaction = 1
Rate = k[N2O5]
Order of Reaction = 1
Example 2: Find the Order and Molecularity of the reaction H2O2 → H2O + 1/2 O2
Solution:
For the above reaction,
Molecularity of reaction = 1
Rate = k[H2O2]
Order of Reaction = 1
Example 3: Find the Order and Molecularity of the reaction 2NO + O2 → 2NO2
Solution:
For the above reaction,
Molecularity of reaction = 3
Rate = k[NO]2[O2]
Order of reaction = 3
Example 4: Find the Order and Molecularity of the reaction 2HI → H2 + I2
Solution:
For the above reaction,
Molecularity of reaction = 2
Rate = k[HI]2
Order of reaction = 2
FAQs on Order and Molecularity of Reaction
Question 1: What is Rate Law?
Answer:
Rate Law is defined as an experimentally determined equation that express the rate of a chemical reaction in terms of molar concentrations of the reactants.
Question 2: What is the Molecularity of the Reaction?
Answer:
The sum of the powers of concentration terms involved in the law of mass action is called as molecularity of reaction.
Question 3: Why is molecularity never fractional?
Answer:
Molecularity of a reaction is the number of reacting species (atoms, ions or molecules) taking part in an elementary reaction. So, the molecularity of a reaction is always a positive integer, it cannot be fractional.
Question 4: What is the Order of reaction with examples?
Answer:
The sum of the powers of the concentration of the reactants in the rate law expression is called order of the chemical reaction.
e.g. A chemical reaction has the rate law
Rate α [A]²[B]¹
the overall order of reaction :
n = 2 + 1 = 3
Order with respect to A = 2.
Order with respect to B = 1.
Question 5: Find the molecularity of Br2 → 2Br
Answer:
As there is only one molecule which react in this reaction. Its, molecularity is 1 therefore, it is a unimolecular reaction.
Last Updated :
14 Feb, 2023
Like Article
Save Article
Молекулярность и порядок химической реакции.
Химические реакции разделяются по признаку их молекулярности или по признаку порядка химической реакции.
Молекулярность химической реакции равна числу молекул (или других частиц), одновременным воздействием между которыми осуществляется элементарный акт химического превращения.
В зависимости от числа таких частиц различают моно (одно-) молекулярные, би (двух-) молекулярные и три (трех-) молекулярные реакции.
Мономолекулярные реакции – реакции разложения молекул:
Для нее закон Гульдберга – Вааге дает:
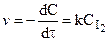
К бимолекулярным реакциям относятся взаимодействия двух одинаковых или различных молекул:
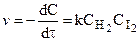
К тримолекулярным относятся реакции вида:
для которых справедливы соотношения:
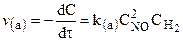
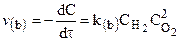
Молекулярность реакции – понятие теоретическое. Для того, чтобы знать молекулярность, нужно представлять, как именно протекает данная реакция, через взаимодействия каких молекул, через какие стадии.
В противоположность молекулярности порядок реакции – экспериментальная величина. Он связан с опытной зависимостью скорости данной реакции от концентрации исходных продуктов.
Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации и устанавливаемом экспериментально.
Для простых реакций, протекающих в полном соответствии с их стехиометрическим уравнением, порядок и молекулярность численно совпадают.
Причины несовпадения порядка реакции и ее молекулярности таковы.
А. Один из реагентов находится в большом избытке. Тогда в ходе реакции его концентрация изменяется незначительно и в уравнении закона Гульдберга – Вааге может быть принята постоянной.
В. Если данная реакция гетерогенная, то в зависимости от условий ее протекания порядок химической реакции изменяется.
С. Порядок каталитических реакций также может отличаться от молекулярности. Причина – сложный механизм таких реакций, не отражаемый стехиометрическим уравнением.
D. Наконец, для сложной реакции, протекающей в несколько стадий, характерно то, что основное влияние на скорость реакции может оказать какая-либо промежуточная стадия, которая и определит, в конечном итоге, порядок всей реакции.
Например, порядок реакции разложения пентаоксида азота
казалось бы, должен быть равен двум.
Исследования показали, что реакция протекает в несколько стадий (результаты анализа химического состава газовой фазы):
причем стадия (1) является наиболее медленной, а поэтому и определяющей скорость всего процесса. Поэтому и суммарная реакция – бимолекулярная реакция первого порядка.
По признаку “порядок химической реакции” различают реакции нулевого, первого, второго и третьего порядков.
Если реакция протекает по нулевому порядку, то

-dC = kd
и после интегрирования в интервале от С0 до С за время от 0 до 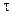
С – С0 = -k 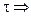
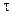
Следовательно, в реакциях нулевого порядка концентрация линейно уменьшается со временем. Уравнение (10.6) – кинетическое уравнение реакции нулевого порядка.
Период полураспада (полупревращения) 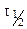
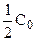
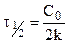
Константа скорости может быть найдена из (10.6):
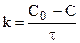
Выражение для скорости реакции первого порядка:
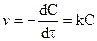
После разделения переменных и интегрирования от 0 до 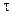
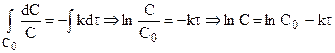
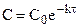
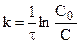
Подставляя 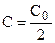
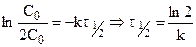
Таким образом, для реакции первого порядка выполняются следующие закономерности: зависимость концентрации от времени экспоненциальная; зависимость логарифма концентрации от времени линейная; период полураспада не зависит от начальной концентрации.
При равенстве концентраций исходных продуктов реакции кинетические уравнения реакций второго и третьего порядков соответственно запишутся:

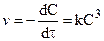
После разделения переменных:
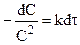
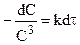
и после интегрирования:

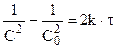
Из (10.13) для реакции второго порядка:
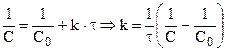
Полагая, что 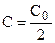
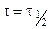

Для реакции третьего порядка:
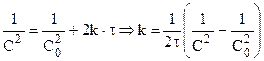
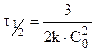
Таким образом для реакций второго порядка наблюдается линейная зависимость 
При интегрировании кинетических уравнений удобно обозначать концентрации реагентов с помощью изменения концентрации x одного из них в момент времени 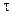
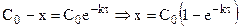
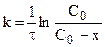
Эти уравнения можно получить, составив кинетическое уравнение вида:
и проинтегрировав его в интервале от 0 до 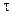
Для реакции второго порядка кинетическое уравнение выглядит:
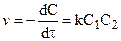
если 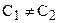
Тогда с учетом 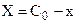
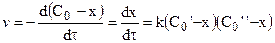
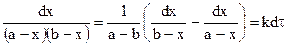
Далее после интегрирования:
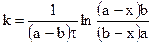
Для реакции третьего порядка, ограничиваясь случаем. когда две начальные концентрации одинаковы и равны а (С0’ = C0’’ = a), а третья начальная равна b (С0’’’ = b), уравнение для расчета константы скорости примет вид:
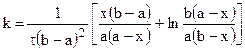
Дата добавления: 2015-05-21 ; просмотров: 16577 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Порядок и молекулярность реакции
Химическая кинетика (продолжение лекции)
Энергия активации зависит от природы реагирующих веществ и в некоторой степени от температуры.
Если энергия активации мала (меньше 40 кДж/моль), скорость реакции велика. Так, ионные реакции в растворах протекают практически мгновенно.
Если энергия активации реакции велика (больше 120 кДж/моль), скорость реакции мала. Например, синтез йодоводорода из I2 и H2 (Еа = 163 кДж/моль) при обычных условиях протекает за астрономический промежуток времени.
Реакции, энергия активации которых находится в пределах от 40 до 120 кДж/моль, протекают за время, которое можно зафиксировать в лабораторных условиях. Так, время протекания реакции разложения тиосульфата натрия серной кислотой, Еа = 86,5 кДж/моль:
составляет несколько минут.
Соотношение констант скоростей при разных температурах определяется уравнением:
где – константы скорости реакции при температурах T1 и T2;
R – универсальная газовая постоянная, равная 8,31×10 – 3 кДж/моль×К;
Ea– энергия активации данной реакции в кДж/моль.
Данное уравнение позволяет рассчитать энергию активации системы.
Пример.
Для прямой элементарной реакции I2 + H2 = 2HI опытным путем определены константы скорости: при 443°С – 0,0067; при 508°С – 0,1059. Определить энергию активации данной реакции.
| T1 = 443 + 273 = 716 K | T2 = 508 + 273 = 781 K |
Вывод: скорость реакции очень мала, так как Еа> 120 кДж/моль.
Порядок и молекулярность реакции
Реакции, подчиняющиеся уравнениям типа:
принято классифицировать по признаку кинетического порядка.
Общим или суммарным порядком реакции называют сумму всех показателей степеней при концентрациях в выражении закона действующих масс, установленным опытным путем:
где a, b, с– частные порядки реакции, соответственно по веществам A, B и C.
Наиболее просты следующие случаи:
1) реакции нулевого порядка: , n = 0;
2) реакции первого порядка: , n = 1;
3) реакции второго порядка: ,
4) реакции третьего порядка: ,
,
С общим кинетическим порядком выше третьего встречаться практически не приходится.
Для элементарных реакций (т. е. протекающих в один элементарный акт) показатели степеней a, b и c обычно представляют собой положительные целые числа. Для более сложных реакций известны дробные и даже отрицательные показатели.
Другой характеристикой механизма протекания химических реакций является молекулярность реакции.
Молекулярностью реакции называется число молекул, участвующих в одном элементарном акте реакции.
Следует отметить, что понятие молекулярности можно применять только для элементарных реакций. К числу элементарных реакций относится, например, разложение 1,2-диметилдиазена:
CH3N = NCH3C2H6 + N2.
Данная реакция является мономолекулярной– в элементарном акте участвует одна молекула. Если в одном акте в реакцию вступают две молекулы, то реакция является бимолекулярной.Например:
H2 + I2 2HI.
Соответственно при тримолекулярной реакции в одном элементарном акте участвуют три частицы (молекулы):
2NO + O2 2NO2
Интересно, что большинство реакций, встречающихся на практике, кажутся простыми. Однако детальное изучение кинетики показывает, что зачастую они протекают по более сложным механизмам. Так, реакция термического разложения паров дихлорэтана:
CH2Cl – CH2ClCHCl = CH2 + HCl
на первый взгляд представляется элементарной.
Действительно, кинетическое уравнение этой реакции имеет вид:
,
что указывает на первый порядок.
Однако данная реакция не является мономолекулярной, так как протекает в несколько стадий:
1) C2H4Cl2 C2H4Cl + Cl•
2) Cl• + C2H4Cl2 C2H3Cl2 + HCl
3) C2H3Cl2 C2H3Cl + Cl•
4) C2H4Cl + Cl• C2H4Cl2
В этом механизме первая и третья стадии мономолекулярны, а вторая и четвертая – бимолекулярны. Очевидно, говорить о молекулярности реакции разложения дихлорэтана в целом нельзя. В то же время можно говорить о ее первом кинетическом порядке.
Данный пример наглядно иллюстрирует факт, что порядок реакции далеко не всегда совпадает с ее молекулярностью. В целом, моно-, би- и тримолекулярные реакции являются, соответственно, реакциями первого, второго и третьего порядков; обратное же заключение может оказаться ошибочным.
Реакции I порядка
Для реакций I порядка убыль концентрации реагента определяется уравнением:
где С – концентрация вещества в данный момент времени;
С0 – начальная концентрация вещества;
kI – константа скорости реакции первого порядка;
В логарифмической форме это выражение выглядит так:
Из приведенных формул можно сделать ряд важных заключений:
1) константа скорости реакции первого порядка имеет размерность [время – 1 ] и может быть выражена в обратных секундах, минутах, часах и т. д.;
2) величина kI не зависит от способа выражения концентрации реагента;
3) в реакциях первого порядка одинаковым промежуткам времени отвечают одинаковые доли прореагировавшего вещества.
Последнее утверждение позволяет ввести понятие период полупревращения.
Периодом полупревращения (t1/2)называют время, необходимое для превращения половины первоначального количества вещества.
Таким образом, в момент времени t = t1/2 количество непрореагировавшего вещества составляет С0. В этом случае:
Из данной формулы следует, что в реакциях первого порядка период полупревращения не зависит от начальной концентрации реагента.
В некоторых случаях удобно использовать формулу:
которая позволяет определить время, за которое превращению подвергнется определенное количество исходного вещества.
В организме человека процессы метаболизма лекарственных препаратов протекают, в основном, в соответствии с уравнением реакции первого порядка. Период, за который превращению подвергается половина действующего начала препарата называется периодом полувыведения или полуэлиминации. Зная величины kI и t1/2, можно рассчитать оптимальные промежутки времени между приемами лекарственного средства.
Кинетические уравнения реакций различного порядка представлены в табл. 2.
Табл. 2. Кинетические уравнения реакций различного порядка.
| Порядок реакции | Кинетическое уравнение | Решение кинетического уравнения* | Период полупревращения |
* при равных исходных концентрациях реагирующих веществ
Из приведенных уравнений следует, что для реакций различного порядка константы скорости имеют неодинаковые размерности. Действительно, константа скорости реакции второго порядка имеет размерность [л·моль – 1 ·время – 1 )], третьего порядка – [л 2 ·моль – 2 ·время – 1 ].
Таким образом, сравнивать значения констант скорости реакций различного порядка нельзя.
Как определить молекулярность реакции по уравнению
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции .
Кинетическое уравнение реакции только для элементарных стадий совпадает с выражением ЗДМ. В этих случаях молекулярность и порядок реакции совпадают, хотя и не всегда. Так, при избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения концентрации вещества В (А = const), поэтому порядок бимолекулярной реакции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для реакции кинетические уравнения по веществу А и веществу В выглядят соответственно
а общее кинетическое уравнение –
|
|
(5.2) |
Здесь – общий порядок реакции. Запишем кинетическое уравнение в дифференциальной форме для разных исходных реагентов:
Разделение переменных и интегрирование в пределах от нуля до τ дает приведенные в таб. 5.1 уравнения для реакций первого, второго и третьего порядков.
|
||||||||||||
| Таблица 5.1
Решения кинетических уравнений 2-го и 3-го порядка, приведенные в таблице 5.1, справедливы только при равных начальных концентрациях веществ В каждом случае кинетическое уравнение линейно в соответствующих координатах , что позволяет графически определить порядок реакции (рис. 5.2).
|
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений[1].
Предметом химической кинетики является изучение всех факторов, влияющих на скорость как суммарного процесса, так и всех промежуточных стадий.
Основные понятия[править | править код]
Гомогенная реакция — реакция, в которой реагирующие вещества находятся в одной фазе.
Гетерогенная реакция — реакция, происходящая на границах раздела фаз — между газообразным веществом и раствором, между раствором и твёрдым веществом, между твёрдым и газообразным веществами.
Реакция называется простой, если продукт образуется в результате непосредственного взаимодействия молекул (частиц) реагентов.
Реакция называется сложной, если конечный продукт получается в результате осуществления двух и более простых реакций (элементарных актов) с образованием промежуточных продуктов[2].
Скорость химической реакции[править | править код]
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции скорость можно выразить так:
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Экспериментальные методы химической кинетики[править | править код]
Экспериментальные методы химической кинетики подразделяются на химические, физические, биохимические в зависимости от способа измерения количества вещества или его концентрации в ходе реакции.
К химическим относятся методы кинетики, основанные на традиционных способах количественного химического анализа — титриметрических, гравиметрических и др.
В современной экспериментальной кинетике к числу наиболее широко применяемых физических методов относятся различные спектральные методы. Эти методы основаны на измерениях, как правило спектров поглощения реагентов или продуктов в ультрафиолетовой, видимой и инфракрасной областях. Широко используют также спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР)[3][страница не указана 1298 дней].
Порядок химической реакции[править | править код]
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
График зависимости концентрации реагента A для первого порядка реакции
График зависимости концентрации реагента A для второго порядка реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка[править | править код]
Кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка[править | править код]
Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
Период полупревращения:
Реакция второго порядка[править | править код]
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
или
В первом случае скорость реакции определяется уравнением:
Линейная форма уравнения:
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
Во втором случае выражение для константы скорости реакции будет выглядеть так:
Период полупревращения (для случая равных начальных концентраций!):
Молекулярность реакции[править | править код]
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трёх частиц:
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определённой взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
Одновременное столкновение более трёх молекул практически невозможно. Большие стехиометрические коэффициенты в уравнении реакции (сумма коэффициентов более 3) указывают на сложный механизм реакции.
Катализ[править | править код]
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) — при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного — снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрит натрия, хромат и дихромат калия.
Многие важнейшие химические производства, такие, как получение серной кислоты, аммиака, азотной кислоты, синтетического каучука, ряда полимеров и др., проводятся в присутствии катализаторов.
Катализ в биохимии[править | править код]
Ферментативный катализ неразрывно связан с жизнедеятельностью организмов растительного и животного мира. Многие жизненно важные химические реакции, протекающие в клетке (что-то около десяти тысяч), управляются особыми органическими катализаторами, именуемыми ферментами или энзимами. Термину «особый» не следует уделять пристального внимания, так как уже известно, из чего построены эти ферменты. Природа избрала для этого один-единственный строительный материал — аминокислоты и соединила их в полипептидные цепи различной длины и в разной последовательности.
Это так называемая первичная структура фермента, где R — боковые остатки, или важнейшие функциональные группы белков, возможно, выступающие в качестве активных центров ферментов. На эти боковые группы и ложится основная нагрузка при работе фермента, пептидная же цепь играет роль опорного скелета. Согласно структурной модели Полинга — Кори, она свернута в спираль, которая в обычном состоянии стабилизирована водородными связями между кислотными и основными центрами:
Для некоторых ферментов установлены полный аминокислотный состав и последовательность расположения их в цепи, а также сложная пространственная структура. Но это всё же очень часто не может помочь нам ответить на два главных вопроса:
- почему ферменты так избирательны и ускоряют химические превращения молекул только вполне определённой структуры (которая нам тоже известна)?
- каким образом фермент снижает энергетический барьер, то есть выбирает энергетически более выгодный путь, благодаря чему реакции могут протекать при обычной температуре?
Строгая избирательность и высокая скорость — два основных признака ферментативного катализа, отличающие его от лабораторного и производственного катализа. Ни один из созданных руками человека катализаторов (за исключением, пожалуй, 2-оксипиридина) не может сравниться с ферментами по силе и избирательности воздействия на органические молекулы.
Активность фермента, как и любого другого катализатора, тоже зависит от температуры: с повышением температуры возрастает и скорость ферментативной реакции. При этом обращает на себя внимание резкое снижение энергии активации Е по сравнению с некаталитической реакцией. Правда, это происходит не всегда. Известно много случаев, когда скорость возрастает благодаря увеличению не зависящего от температуры предэкспоненциального множителя в уравнении Аррениуса.
Типы ферментативных реакций[править | править код]
- Тип «пинг-понг» — фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты: трансаминирование.
- Тип последовательных реакций — к ферменту последовательно присоединяются субстраты А и В, образуя «тройной комплекс», после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.
- Тип случайных взаимодействий — субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Равновесие[править | править код]
Константа химического равновесия
Примечания[править | править код]
- ↑ Кинетика химическая // Химическая энциклопедия : в 5 т. / Гл. ред.: И. Л. Кнунянц (Т. 1—3), Н. С. Зефиров (Т. 4—5). — М.: Советская энциклопедия (Т. 1—2); Большая Российская энциклопедия (Т. 3—5), 1988—1998. — ISBN 5-85270-008-8.
- ↑ Ершов Ю.А. Общая химия.Биофизическая химия.Химия биогенных элементов. — Москва: Высшая школа.
- ↑ Ю.А. Ершов, В.А. Попков, А.С. Берлянд, А.З. Книжник. Общая химия: биофизическая химия, химия биогенных элементов. — Издание 8, стереотипное. — Москва: “Высшая школа”, 2010.
Ссылки[править | править код]
- Химическая кинетика и катализ Лекции А. А. Кубасова, к. хим. н,, доцента кафедры физической химии Химического факультета МГУ.
- Кнорре Д. Г., Эмануэль Н. М. Курс химической кинетики. 4-е издание, М.: Высшая школа, 1984. — 463 с.
- В. И. Коробова, В. Ф. Очкова «Химическая кинетика: введение с Mathcad/Maple/MCS» М.: Горячая линия-Телеком, 2009.
- Г. С. Яблонский, В. И. Быков, А. Н. Горбань, Кинетические модели каталитических реакций, Новосибирск: Наука (Сиб. отделение), 1983.- 255 c.

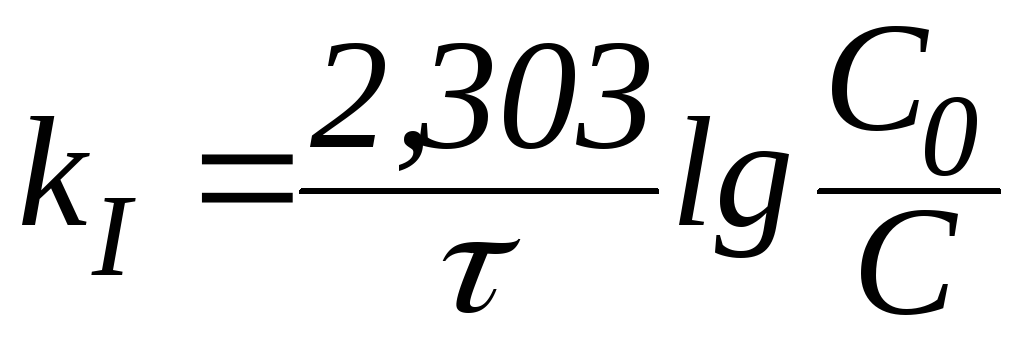
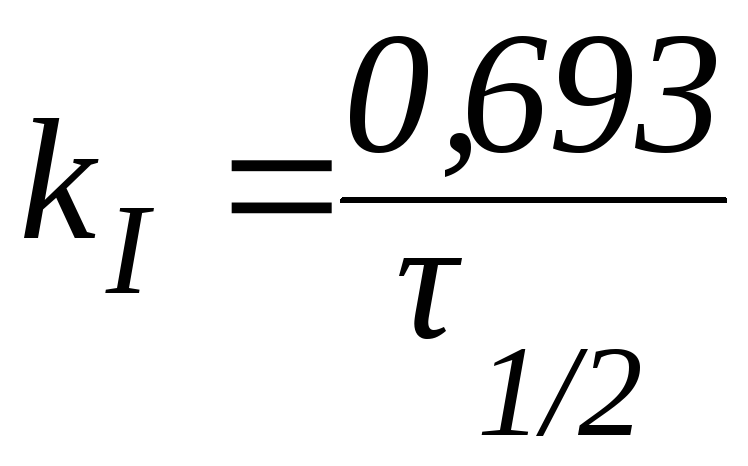 .
. ,
,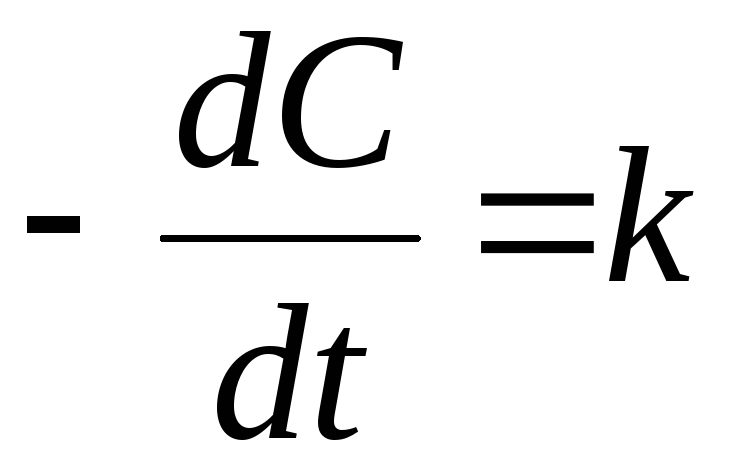
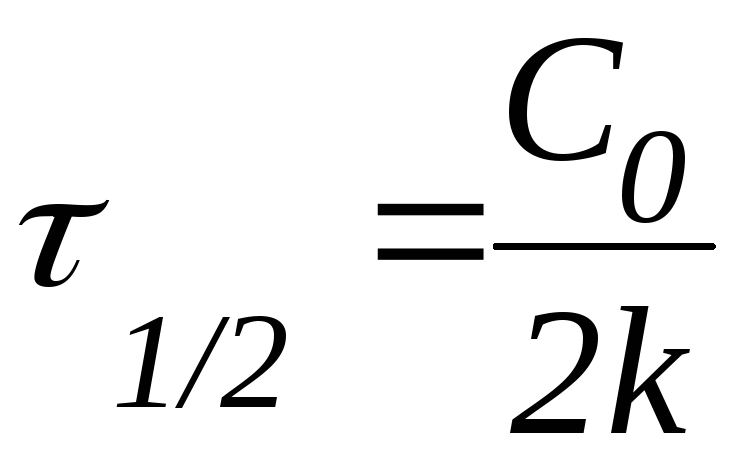
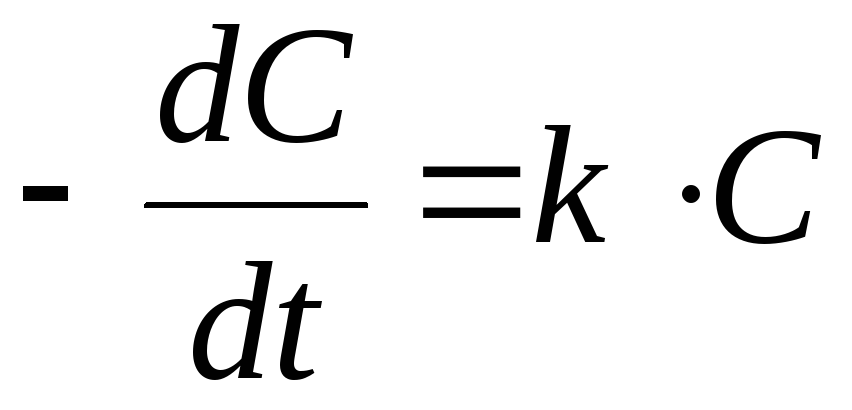

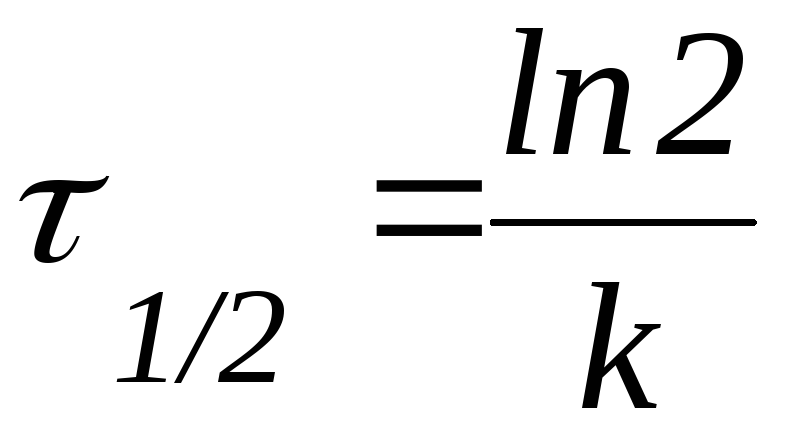
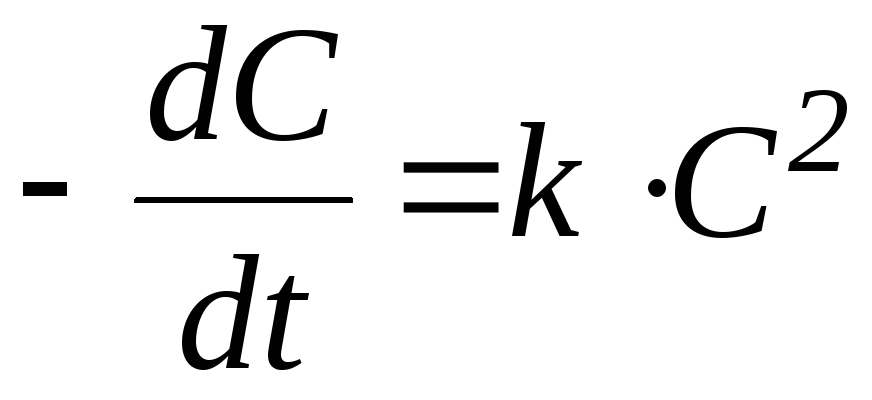


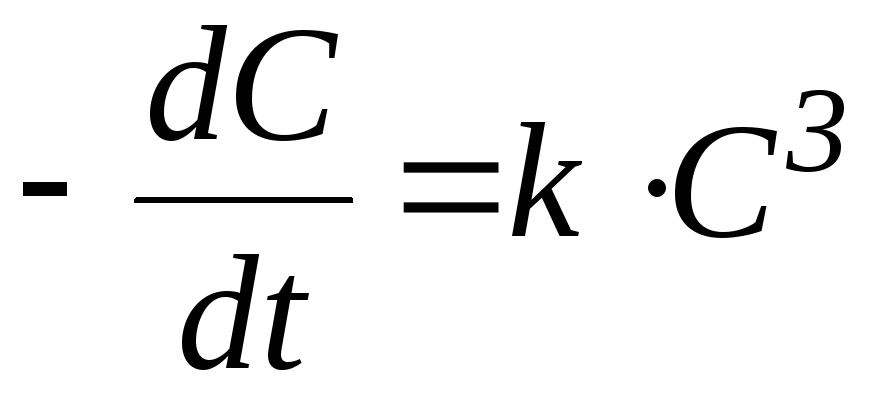
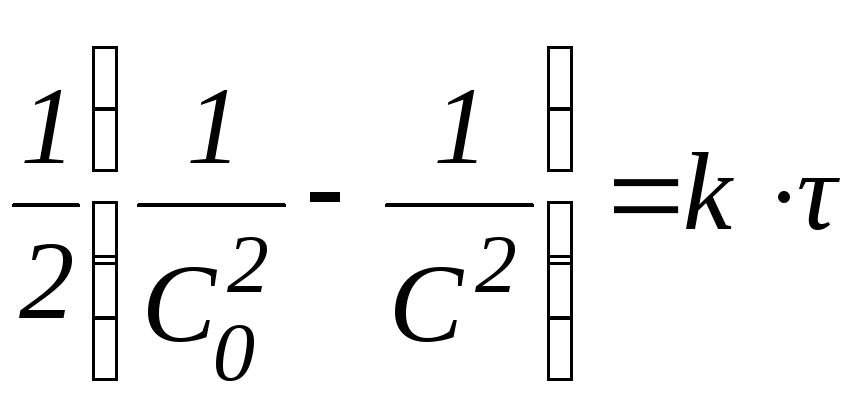
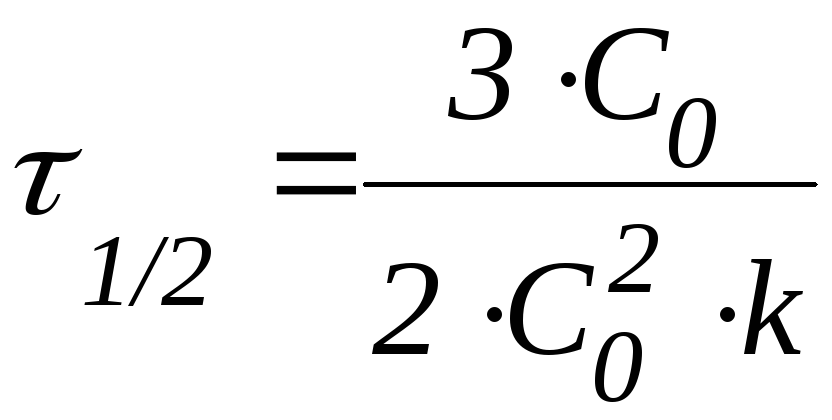
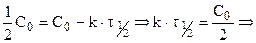











 1
1 в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку
в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку 
 скорость реакции будет соответствовать кинетическому уравнению первого порядка
скорость реакции будет соответствовать кинетическому уравнению первого порядка  При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.
При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.




















