Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
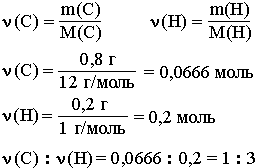
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
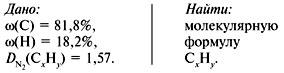
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
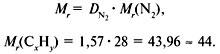
3. Найти индексы х и y по отношению ![]() :
:

4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.

2. Найти массовую долю водорода:
![]() (Н) = 100% – 83,3% = 16,7%.
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
![]()
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
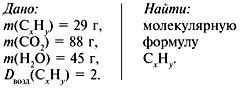
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
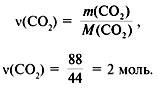
4. Найти количество вещества углерода в сожженном веществе:
![]() (C) =
(C) = ![]() (CO2) = 2 моль.
(CO2) = 2 моль.
5. Найти количество вещества воды:
![]() (H2O) = 45/18 = 2,5 моль.
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
![]() (H) = 2
(H) = 2![]() (H2O),
(H2O),
![]() (H) = 2,5•2 = 5 моль.
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
![]() (C) :
(C) : ![]() (Н) = 2 : 5,
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.

2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
![]() (CO2) = 16,8/22,4 = 0,75 моль,
(CO2) = 16,8/22,4 = 0,75 моль,
![]() (C) = 0,75 моль.
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
![]() (H2O) = 13,5/18 = 0,75 моль,
(H2O) = 13,5/18 = 0,75 моль,
![]() (H) = 0,75•2 = 1,5 моль.
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
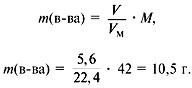
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
![]() (C) :
(C) : ![]() (H) = 0,75 : 1,5 = 1 : 2,
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Определите молекулярную формулу алкана, если его молярная масса 86 г/моль.
Решение задачи
Напомню, алканы – предельные углеводороды, углеродная цепь которых незамкнута и не содержит кратных (двойных или тройных) связей.
Общая формула алканов имеет вид:
![]() Исходя из условия задачи и зная, что молярная масса алканов вычисляется по формуле:
Исходя из условия задачи и зная, что молярная масса алканов вычисляется по формуле:
![]() Найдем молекулярную формулу алкана:
Найдем молекулярную формулу алкана:
14n + 2 = 86
14n = 84
n = 6
Получаем:
C6H14 – гексан.
Ответ:
гексан.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:

При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода



Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное

Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:

то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.

Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:

Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:

2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
![]()
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:

Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
![]()
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н

2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
![]()
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
![]()
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
![]()
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:![]()
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.

Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
![]()
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.

Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
![]()
Хлорэтан взаимодействует с натрием с образованием бутана:
![]()
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
![]()
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:

4. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
![]()
При гидрировании этилена образуется этан:
![]()
При полном гидрировании ацетилена также образуется этан:
![]()
При гидрировании циклопропана образуется пропан:

5. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
6. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Решение задач вызывают некоторые трудности, поэтому многие ученики и студенты считаю их сложными. На самом деле, зная некоторые закономерности и приемы, можно с легкостью щелкать любую проблему.
При решении задач на нахождение молекулярной формулы газообразного углеводорода полезно знать общие формулы основных гомологических рядов углеводородов:
| Название | Общая формула |
|---|---|
| Алканы | CnH2n+2 |
| Алкены и циклические алканы | CnH2n |
| Алкины и алкадиены | CnH2n-2 |
Относительная плотность
Часто в задачах встречается такая формулировка: «Относительная плотность газа равна х по газу Г». Под буквой х может быть любое значение, а под Г – название любого газа.
Относительная плотность (D) = (молярная масса газа)/(молярная масса данного газа)
Использование этих теоретических сведений покажем на таком примере.
Пример 1
Определите молекулярную формулу алкана, если относительная плотность газа по азоту равна 2,07.
Решение
Сначала определим молярную массу алкана:
Mr = (относительная плотность) ⋅cdot (молярная масса азота)=2,07 ⋅cdot 28=58 г/моль.
Далее воспользуемся общей формулой алканов CnH2n+2. Зная молярную массу, можем определить значение n в общей формуле:
Mr = (молярная масса карбона) ⋅cdot (количество) + (молярная масса водорода) ⋅cdot (количество)=12 ⋅cdot n+1 ⋅cdot (2n+2)=14n+2.
Приравнивая, получаем:
58=14n+2
n=4
Таким образом молекулярная формула газа C4H10 – бутан.
Массовая доля
Часто в задачах требуется найти молекулярную формулу углеводорода, зная массовую часть одного из элементов.
Массовая часть (W) = (молярная масса элемента) ⋅cdot (количество)/(молярная масса газа) ⋅cdot 100%
Также приведем способ, как быстро определить молекулярную формулу углеводорода, зная массовую часть одного из элементов. Способ позволяет определить соотношение между количеством атомов карбона и гидрогена в соединение. Пусть формула соединения CkHm. Тогда k:m=(W(С)/12):(W(H)/1)
Рассмотрим на примере
Пример 2
Массовая часть Гидрогена в молекуле углеводорода равна 16,67%. Определите молекулярную формулу простейшего углеводорода.
Решение
Пусть формула соединения CkHm.
Тогда k:m=(W(С)/12):(W(H)/1)=((100-16,67)/12):(16,67/1)=(83,33/12):16,67= 6,94:16,67=1:2,4=5:12
Таким образом формула соединения C5H12
Горение
Последняя большая группа задач предполагает определение молекулярной формулы по продуктам горения. Для решения таких задач сначала нужно написать уравнение горения соответствующего углеводорода. Стоит помнить, что при взаимодействии углеводорода и кислорода всегда образуется только два продукта – углекислый газ и вода.
Например, уравнение горения алканов:
CnH2n+2 + ((3n+1)/2)O2 →rightarrow nCO2 + (n+1)H2O
Пример 3
Для сгорания гомолога ацетилена, масса которого равна 30 г, нужно 320 л воздуха. Определите формулу углеводорода
Решение
Сперва напишем уравнения горения алкинов в общей форме:
CnH2n-2 + ((3n-1)/2)O2 →rightarrow nCO2 + (n-1)H2O
Далее найдем сколько литров кислорода ушло (поскольку воздух – не чистый кислород, а содержит 21% кислорода)
V=320 ⋅cdot 0,21=67,2 л
n=V/V0=67,2/22,4=3 моль (поскольку при н.у. 1 моль любого газа занимает 22,4 л)
Далее составим уравнение:
n(CnH2n-2) ⋅cdot ((3n-1)/2)=n(O2)
(30/(12n + 2n-2))⋅cdot((3n-1)/2)=3
(30/(14n-2))⋅cdot(3n-1)=6
Решая, получаем n=3
Таким образом формула углеводорода C3H4
Тест по теме «Формула газообразного углеводорода»
Формула алканов
ОПРЕДЕЛЕНИЕ
Алканы (парафины, предельные углеводороды, насыщенные алифатические углеводороды) – ациклические углеводороды линейного или разветвлённого строения, в которых атомы углерода связаны между собой только простыми (одинарными) связями.
Общая формула алканов: (
mathrm{C}_{mathrm{n}} mathrm{H}_{2 mathrm{n}+2}
)(
(n geq 1)
)
Молекулярные и структурные формулы алканов
Первые представители гомологического ряда алканов:
Молекулярные и структурные формулы алканов
Алканы называются насыщенными углеводородами, поскольку содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp {3} -гибридизации – 4 гибридные орбитали атома углерода равнозначны по форме и энергии и направлены к вершинам тетраэдра:
Тетраэдрическое расположение гибридных орбиталей одинаково для всех атомов углерода в алканах, поэтому молекулы алканов имеют зигзагообразное строение:
Тетраэдрическое расположение гибридных орбиталей одинаково для всех атомов углерода в алканах
При (
n > 3
) у алканов возможна изомерия углеродного скелета:
а при (
n > 6
) – оптическая изомерия.
Алканы химически малоактивны, поскольку одинарные связи (
mathrm{C}-mathrm{H}
) и (
mathrm{C}-mathrm{C}
) довольно прочные. Все связи в молекулах алканов являются (
sigma
) -связями, малополярны и слабо поляризуются, поэтому алканы, в основном, вступают в реакции по радикальному механизму (радикальное галогенирование, сульфохлорирование, нитрование, автоокисление).
Основным практически значимым химическим свойством алканов является реакция горения:
(
mathrm{CH}_{4}+2 mathrm{O}_{2} rightarrow mathrm{CO}_{2}+2 mathrm{H}_{2} mathrm{O}+Delta Q
)
Из-за большого теплового эффекта таких реакций алканы используются в качестве топлива.
Примеры решения задач по теме «формула алканов»
ПРИМЕР 1
Массовая доля углерода в алкане составляет 83,72%. Определите его молекулярную формулу.
Общая формула алканов (
mathrm{CnH} 2 mathrm{n}+2
)
Масса 1 моля алкана равна:
(
mleft(C_{n} H_{2 n+2}right)=(12 n+2 n+2)=14 n+2
)
Масса углерода в алкане равна:
(
m(C)=12 n
)
Массовая доля углерода в алкане равна:
(
omega(C)=frac{12 n cdot 100}{14 n+2}
)
(
frac{12 n cdot 100}{14 n+2}=83,72
)
(
27,92 n=167,44
)
(
n=6
)
Следовательно, молекулярная формула алкана (
mathrm{C} 6 mathrm{H} 14
).
Молекулярная формула алкана (
mathrm{C} 6 mathrm{H} 14
)
ПРИМЕР 2
Газ, который образовался при полном сгорании 0,1 моль неизвестного алкана, пропустили через избыток известковой воды, при этом выпал осадок массой 60 г. Определите молекулярную формулу и строение данного алкана, если известно, что в его составе есть один четвертичный атом углерода.
Запишем уравнение реакции горения алкана:
(
C_{n} H_{2 n+2}+(3 n+1) / 2 O_{2} rightarrow n C O_{2}+(n+1) H_{2} O
)
Из уравнения реакции следует, что при сгорании 1 моля алкана, образуется n моль (
mathrm{CO} 2
).
При пропускании углекислого газа через известковую воду выпадает осадок карбоната кальция:
(
C a(O H)_{2}+C O_{2}=C a C O_{3} downarrow+H_{2} O
)
Количество вещества карбоната кальция равно:
(
nleft(C a C O_{3}right)=m / M=60 / 100=0,6
)
По уравнению реакции
(
nleft(C O_{2}right)=nleft(C a C O_{3}right)=0,6
) моль
Поскольку при сгорании 0,1 моль алкана выделилось 0,6 моль (
mathrm{CO} 2
), то n = 6.
Следовательно, молекулярная формула алкана – (
mathrm{CGH} 14
)
Среди алканов, имеющих формулу (
mathrm{CGH} 14
), четвертичный атом углерода имеет 2,2-диметилбутан:
(
mathrm{C} 6 mathrm{H} 14
) — 2,2-диметилбутан.
