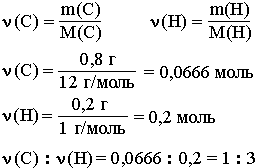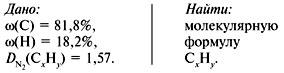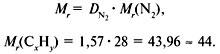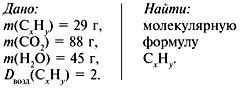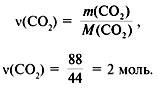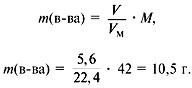Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D – относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород – CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
Решение задач вызывают некоторые трудности, поэтому многие ученики и студенты считаю их сложными. На самом деле, зная некоторые закономерности и приемы, можно с легкостью щелкать любую проблему.
При решении задач на нахождение молекулярной формулы газообразного углеводорода полезно знать общие формулы основных гомологических рядов углеводородов:
| Название | Общая формула |
|---|---|
| Алканы | CnH2n+2 |
| Алкены и циклические алканы | CnH2n |
| Алкины и алкадиены | CnH2n-2 |
Относительная плотность
Часто в задачах встречается такая формулировка: «Относительная плотность газа равна х по газу Г». Под буквой х может быть любое значение, а под Г – название любого газа.
Относительная плотность (D) = (молярная масса газа)/(молярная масса данного газа)
Использование этих теоретических сведений покажем на таком примере.
Пример 1
Определите молекулярную формулу алкана, если относительная плотность газа по азоту равна 2,07.
Решение
Сначала определим молярную массу алкана:
Mr = (относительная плотность) ⋅cdot (молярная масса азота)=2,07 ⋅cdot 28=58 г/моль.
Далее воспользуемся общей формулой алканов CnH2n+2. Зная молярную массу, можем определить значение n в общей формуле:
Mr = (молярная масса карбона) ⋅cdot (количество) + (молярная масса водорода) ⋅cdot (количество)=12 ⋅cdot n+1 ⋅cdot (2n+2)=14n+2.
Приравнивая, получаем:
58=14n+2
n=4
Таким образом молекулярная формула газа C4H10 – бутан.
Массовая доля
Часто в задачах требуется найти молекулярную формулу углеводорода, зная массовую часть одного из элементов.
Массовая часть (W) = (молярная масса элемента) ⋅cdot (количество)/(молярная масса газа) ⋅cdot 100%
Также приведем способ, как быстро определить молекулярную формулу углеводорода, зная массовую часть одного из элементов. Способ позволяет определить соотношение между количеством атомов карбона и гидрогена в соединение. Пусть формула соединения CkHm. Тогда k:m=(W(С)/12):(W(H)/1)
Рассмотрим на примере
Пример 2
Массовая часть Гидрогена в молекуле углеводорода равна 16,67%. Определите молекулярную формулу простейшего углеводорода.
Решение
Пусть формула соединения CkHm.
Тогда k:m=(W(С)/12):(W(H)/1)=((100-16,67)/12):(16,67/1)=(83,33/12):16,67= 6,94:16,67=1:2,4=5:12
Таким образом формула соединения C5H12
Горение
Последняя большая группа задач предполагает определение молекулярной формулы по продуктам горения. Для решения таких задач сначала нужно написать уравнение горения соответствующего углеводорода. Стоит помнить, что при взаимодействии углеводорода и кислорода всегда образуется только два продукта – углекислый газ и вода.
Например, уравнение горения алканов:
CnH2n+2 + ((3n+1)/2)O2 →rightarrow nCO2 + (n+1)H2O
Пример 3
Для сгорания гомолога ацетилена, масса которого равна 30 г, нужно 320 л воздуха. Определите формулу углеводорода
Решение
Сперва напишем уравнения горения алкинов в общей форме:
CnH2n-2 + ((3n-1)/2)O2 →rightarrow nCO2 + (n-1)H2O
Далее найдем сколько литров кислорода ушло (поскольку воздух – не чистый кислород, а содержит 21% кислорода)
V=320 ⋅cdot 0,21=67,2 л
n=V/V0=67,2/22,4=3 моль (поскольку при н.у. 1 моль любого газа занимает 22,4 л)
Далее составим уравнение:
n(CnH2n-2) ⋅cdot ((3n-1)/2)=n(O2)
(30/(12n + 2n-2))⋅cdot((3n-1)/2)=3
(30/(14n-2))⋅cdot(3n-1)=6
Решая, получаем n=3
Таким образом формула углеводорода C3H4
Тест по теме «Формула газообразного углеводорода»
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Вы будете долго плакать, но я не могу не поделиться с вами совершенно невыносимым горем. Карлсон со всей остальной развеселой компанией улетели далеко-далеко, то ли в Тридевятое Царство, то ли в Хогвартс, то ли, вообще, на Альфа Центавра. Проснувшись утром, я увидела записку, написанную очень аккуратным почерком Алисы на лепестке розы:
“Вот видишь, все куда-то движется и во что-то превращается, чем же ты недовольна? От уксуса куксятся, от горчицы огорчаются, от лука лукавят. Как жалко, что об этом никто не знает! Ели бы сдобу и добрели! Отсюда мораль: всякому овощу свое время. Или если сказать попроще… Никогда не думай, что ты иная, чем могла бы не быть иначе, чем будучи иной в тех случаях, когда иначе нельзя не быть. Ничего не поделаешь. Все мы здесь не в своем уме – и ты, и я”
Я сразу все поняла. Это они деликатно оставили нас в покое, чтобы дать возможность спокойно подготовиться к ЕГЭ по химии. Спасибо вам, друзья! Надеюсь, сразу после экзамена мы обязательно встретимся и продолжим наше незабываемое общение! А пока – химия зовет!
Сегодня мы поработаем с алгоритмом “Вывод формулы вещества по продуктам сжигания”. В общих чертах, этот алгоритм очень напоминает разобранный ранее – “Вывод формулы вещества по массовым долям”, но имеет свои особенности. Давайте, будем разбираться и раскладывать по полочкам весь необходимый нам учебный материал.
Что такое горение? Горение – это экзотермическая реакция окисления простых и сложных веществ кислородом (или озоном). Продукты сжигания, обычно, оксиды (есть исключение).
Как по качественному составу вещества определить продукты сжигания? На представленной внизу схеме хорошо видно, какие продукты образуются при сгорании атомов разных элементов вещества. Кстати, в некоторых случаях продукты горения могут реагировать между собой. Такие реакции также показаны на схеме
Как по продуктам сжигания определить качественный состав вещества? Посмотрите еще раз на представленную схему. Мы определили продукты горения по элементам сжигаемого вещества. Если перевернуть логическую цепочку, легко определить элементарный состав вещества по продуктам сжигания.
Как определить количественный состав атомов каждого химического элемента в сгоревшем веществе? Это можно сделать по соотношению количества вещества, как и в случае массовых долей. Только в этот раз количество вещества каждого атома рассчитывается по абсолютным значениям продуктов сжигания.
Все-все-все… Мне уже понятно, что вам ничего не понятно. Лучше один раз увидеть, чем много раз услышать. Поэтому переходим к анализу конкретных задач. Итак, встречайте задачи с алгоритмом “Вывод формулы вещества по продуктам сжигания”! Аплодисменты, пожалуйста!
Задача 1
При сжигании 1,84 г органического вещества образовалось 1,344 л диоксида углерода (н.у.) и 1,44 г воды. Определите молекулярную формулу вещества.
Выписываем данные в разделе Дано.
Записываем реакцию горения в общем виде. По продуктам сжигания определяем качественный состав исходного вещества. Наличие в формуле кислорода ничем не подтверждено и не опровергнуто, поэтому атомы кислорода должны присутствовать в предполагаемой (гипотетической) формуле до окончательного расчета и анализа.
Определяем логическую структуру алгоритма – соотношение количества вещества атомов каждого элемента. Определяем источник расчета количества вещества (атомы углерода – из молекул углекислого газа, атомы водорода – из молекул воды).
Наличие (или отсутствие) кислорода определяется по разнице между массой вещества и массами углерода и водорода. Если в результате получается 0, значит кислород в формуле отсутствует.
Рассчитываем углерод по углекислому газу
Рассчитываем водород по воде
Рассчитываем кислород по разнице масс исходного вещества и рассчитанных по продуктам сжигания углерода и водорода
Рассчитанные количества вещества записываем в таблицу и приводим их соотношения к целым значениям. Выводим простейшую формулу вещества, которая в представленных задачах является окончательной.
В качестве бонуса, можно предложить структурную формулу изомера.
Задача 2
При сжигании 1,44 г вещества образовалось 0,53 г кальцинированной соды, 1,456 л углекислого газа и 0,45 г воды. Определить молекулярную формулу вещества.
Последовательность действий:
1) Выписать данные в разделе Дано
2) Написать реакцию сжигания в общем виде
3) По продуктам сжигания определить качественный состав вещества
4) Составить логическую структуру алгоритма
5) Выяснить источник для расчета количества вещества атомов элемента
6) Определить количество вещества углерода
7) Определить количество вещества водорода
8) Определить наличие и количество вещества кислорода
9) Составить таблицу (количество вещества атомов каждого элемента)
10) Рассчитать целые значения соотношений количества вещества
11) Вывести простейшую формулу вещества
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Углеводород содержит 92,3 процента углерода (C). Вывести молекулярную формулу углеводорода (CxHy), если плотность его паров по гелию (He) равна 6,5?
Решение задачи
I способ решения (II способ, III способ)
Пусть, масса углеводорода (CxHy) равна 100 грамм. Тогда:
m (Cx) = 92,3 (г),
m (Hy) = 100 — 92,3 = 7,7 (г).
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
Число атомов углерода (C) и водорода (H) относятся 1 : 1, следовательно простейшая формула углеводорода – CH.
Молярная масса (CH) равна:
M (CH) = 13 (г/моль).
Найдем относительную молярную массу углеводорода (CxHy), зная, плотность его паров по гелию (He), по формуле:
Учитывая, что молярная масса гелия (He) равна 4 г/моль, получаем:
M (CxHy) = 6,5 ∙ 4 = 26 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) »вмещает» молярную массу (CH):
M (CxHy)/ M (CH) = 26/13 = 2.
Следовательно, молекулярная формула углеводорода C2H2 (ацетилен).
Ответ:
молекулярная формула углеводорода C2H2.