В реальности, химики редко работают с чистыми веществами. В большинстве своем для работы, при проведении химических реакций, расчетов по ним используются различные растворы.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
Подробнее о процессе растворения мы поговорим в следующих статьях.
При решении расчетных задач нам нудно уметь находить количество чистого вещества, находящегося в растворе. Это необходимо затем, что, как правило, в химическое взаимодействие вступает вещество, а не дополнительные продукты, которое оно содержит: примеси, если это не чистое вещество, компоненты растворителя, или инертные для данного химического процесса компоненты смеси (если это смесь веществ).
Если мы работаем с 500 граммами раствора, в котором всего 10 грамм чистого вещества, то в расчеты мы берем 10 грамм, а не 500! – пример, почему необходимо уметь вычислять количественные характеристики чистого вещества.
Способы выражения концентрации растворов
Существуют различные способы выражения концентраций растворов. В задачах могут встретиться любые из них. Рассмотрим основные из них более подробно.
I. Массовая доля вещества
Массовая доля – отношение массы чистого вещества к массе всего раствора. Данная величина безразмерная (говорят доля от единицы, всегда меньше 1, или равна единице для чистого вещества), или выражается в %.
Очень часто можно встретить запись запись, например NaOH, 15% – это значит, что из всей массы раствора на долю гидроксида натрия (NaOH) приходится только 15 %.
Следует не забывать, что масса раствора = масса растворителя + масса чистого вещества.
Зная массовую долю вещества, нетрудно выразить формулу для расчета массы чистого вещества:
В некоторых задачах масса раствора может быть не дана в условии. В этом случае мы сами можем её задать. Как правило в таких случаях, мы задаём массу раствора как 100 г. Дальнейший расчет ведется уже исходя из заданной массы (если требуется перевести одну концентрацию в другую).
Приведем примеры задач:
Мы специально делаем подробное решение, чтобы отследить ход мыслей.
Решим аналогичную задачу:
Более часто встречаются задачи, в которых требуется приготовить раствор из другого раствора путем добавления чистого вещества (в этом случае концентрация увеличится), растворителя (концентрация уменьшится) или другого раствора (концентрация займёт промежуточное значение).
Рассчитайте массу соли, которую необходимо добавить к 150 г 10% -го раствора, чтобы концентрация полученного раствора стала 15%?
Данную задачу можно решать различными способами. В настоящий момент приведем только один (более длинный, но более понятный). Для решения таких задач другим способом мы подготовим видео.
Задачи, в которых добавляется растворитель – решаются проще.
Какое количество воды необходимо добавить к 200 г 15%-го раствора, чтобы его концентрация стала 10%?
Для решения задач, в которых смешиваются два раствора, имеющих различные концентрации, можно использовать следующий алгоритм:
1. Рассчитать количество чистого вещества в обоих растворах и сложить их.
2. Поделить полученное число на сумму масс растворов. Домножить на 100 %.
Решим для примера следующую задачу
Смешали 200 г 10%-го раствора серной кислоты и 100 г 20-% го. Какая массовая доля стала у получившегося раствора?
II. Молярная концентрация вещества
Молярная концентрация вещества – отношение количества вещества к объему раствора. Данная величина показывает нам, сколько (моль) вещества растворено в 1 литре раствора. Единица измерения – моль/л.
Обозначается молярная концентрация заглавной буквой C
В химической лаборатории очень часто для обозначения концентрации используется именно данная величина.
Очень часто, на химических склянках можно увидеть следующие обозначения:
Таким способом также обозначается молярная концентрация. Число перед буквой М обозначает концентрацию: 1 моль/л; 0,1 моль/л; 0,02 моль/л; 3 моль/л; 0,5 моль/л.
Можно также встретить в задачах такое обозначение, связанное с данной формой записи: молярный раствор (1 М) – раствор, концентрация которого составляет 1 моль/л. Децимолярный раствор (0,1 М) – 0,1 моль/л; сантимолярный раствор (0,01 М) – 0,01 моль/л.
Решим некоторые задачи, в которых используется молярная концентрация:
Для приготовления раствора сульфата натрия навеску, содержащую 14,2 г соли растворили в 500 мл воды и довели до метки.
Доведение до метки обозначает, что объем приготовленного раствора составляет (в данном случае) 500 мл.
Часто требуется рассчитать количество вещества:
Прежде чем проводить расчет по уравнению химических реакций, необходимо найти количество вещества.
III. Моляльная концентрация
Моляльная концентрация – отношение количества (моль) растворенного вещества к массе растворителя. Данная концентрация показывает нам, сколько моль вещества необходимо добавить к 1 кг растворителя (воды, например), чтобы получить нужную концентрации. Обозначается данная концентрация См, а измеряется в моль/кг(растворителя).
IV. Мольная доля
Мольная доля – отношение количества вещества к сумме количеств всех компонентов раствора. Данная физическая величина не имеет размерности.
Сумма всех мольных долей раствора равна “1”.
Данная физическая величина нашла широкое применение в химической химии для описания равновесных термодинамических процессов.
V. Титр
Титр – отношение массы вещества к единице объема (выраженного в миллилитрах). Титр показывает, сколько грамм вещества находится в каждом миллилитре раствора. обозначается как “Т” и измеряется в г/мл.
Титр – очень маленькая величина, так как в в 1 миллилитре раствора может находиться незначительное количество вещества.
Титр нашел широкое применение в аналитической химии.
В заключении
По данной теме существует огромное количество расчетных задач. Многие из них мы рассмотрим в следующих статьях. О пока…
Проверьте, как Вы усвоили материал.
Задание №1. Перейдите к гугл-форме и ответьте на вопросы (базовый уровень):
https://forms.gle/7u32uLfxRk1Yug7a8
Задание №2. Решите расчетные задачи: https://vk.com/page-205267346_56951920 (повышенный уровень)
Задание №3. Решите следующую задачу:
Какова молярная концентрация 12%-ного раствора серной кислоты (H2S04) с плотностью р = 1,08 г/см3. Рассчитайте титр данного вещества, моляльную концентрацию, мольную долю.
Отчет о решении задач пришли в беседу “Учебный класс”:
https://vk.me/join/DKsyQe2p0hJ2Wdoch1XOTwi_qZEJow1udOM=
Концентрация растворов
Концентрация
— величина, выражающая относительное
содержание данного компонента (составная
часть) в системе (смеси, растворе).
Различные способы выражения концентраций
можно разделить на две группы в зависимости
от того, выражается ли характеристика
компонента и остальной части системы
или всей системы в целом одной и той же
величиной (например, массой, г/г) или
разными (например, кг/м3,
моль/л). В первом случае концентрация
оценивается безразмерными величинами
(доли, отношения, которые выражаются
в долях единицы или в процентах).
Из концентраций,
которые выражаются размерными величинами,
наибольшее применение находят следующие.
1.
Массовая
доля (процентная концентрация)
компонента — отношение массы растворенного
вещества к массе раствора:
![]() .
.
2.
Молярная
концентрация
(концентрация количества вещества) —
отношение количества вещества,
содержащегося в системе, к объему
системы:
![]()
Единица
СИ — моль/м3,
обычно применяют моль/л.
3.
Молярная
концентрация эквивалента (нормальная
концентрация) —
отношение количества вещества эквивалента
к объему раствора:
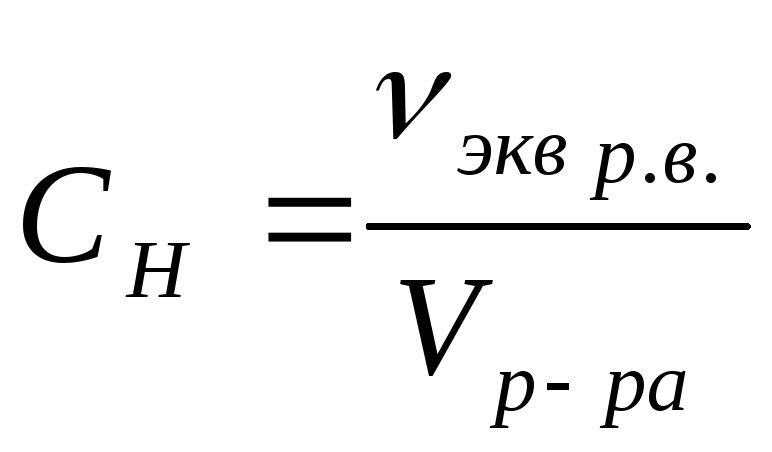 .
.
Единица СИ — моль/м3,
обычно применяется моль/л.
Например,
если КМnO4
массой 15,8 г находится в растворе
объемом 5 л,
то
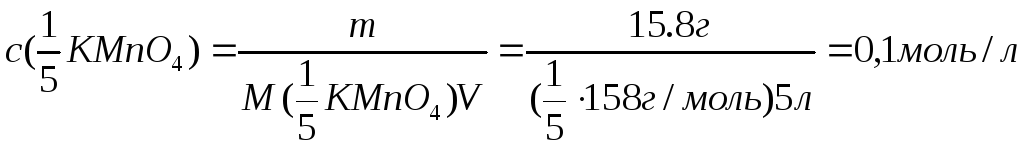
4.
Моляльность
раствора — отношение количества
растворенного вещества к массе
растворителя:
![]() .
.
Единица СИ—моль/кг.
5.
Молярная
доля –
отношение количества растворенного
вещества к сумме количеств всех веществ,
составляющих раствор:
![]() .
.
6.
Титр раствора
– число
граммов растворенного вещества в 1 см3
(мл) раствора:
![]() .
.
Единица СИ — г/см3.
Например,
если в 1 л раствора содержится 61,86 г
кислоты, то
![]() .
.
Пример
1. Какой массы
кристаллогидрат BaCl2·2H2O
надо взять для приготовления раствора
объемом 0,5 л, в котором массовая доля
BaCl2
составляет 0,1 (10%-ный раствор)?
Решение:
а) Если ω(ВаС12)=0,1,
или 10%, то плотность раствора ρ= 1,090 г/мл
(из справочных таблиц). Тогда масса
раствора BaCl2
заданного объема равна 500·1,090=545,0 г. Масса
BaCl2
в этом растворе находится из пропорции:
m(BaCl2)
– m(р-ра
BaCl2)
10
г 100 г
x
» 545 » x=54,5
г,
Масса кристаллогидрата:
m(ВаС12·2Н2O)
— m
(BaCl2)
244,2
г 208,4
х
» 54,5 » х=64,0 г.
При определении
нужного объема воды учитывается масса
введенной в раствор кристаллизационной
воды.
Пример
2. Вычислите
молярную, эквивалентную молярную
концентрации и моляльность раствора
серной кислоты с ω
(H2SО4)=10%
и ρ= 1,066 г/см3.
Решение 1. Определяем
молярную и эквивалентную молярную
концентрации раствора серной кислоты.
Определим массу
1 л раствора серной кислоты по известной
плотности:
т
(р-ра)
= 1,066 г/см3·1000
см3
=1066 г.
Определим массу
кислоты по известной массовой доле:
![]()
Разделив
найденную массу кислоты на ее молярную
массу, найдем молярную концентрацию
раствора; при делении массы кислоты на
ее эквивалентную массу определим
эквивалентную молярную концентрацию
раствора:
![]() ;
;
![]() .
.
2. Определим
моляльность раствора:
![]()
Пример
3. Определите
объем раствора щелочи с эквивалентной
молярной концентрацией СН(Щ.)
=0,1 моль/л, необходимый для полной
нейтрализации раствора фосфорной
кислоты объемом 20 мл и CН=0,05
моль/л.
Решение.
Эквивалентные количества прореагировавших
кислоты (К.) и щелочи (Щ.) должны быть
одинаковыми, т. е. νэкв(К.)
= νэкв(Щ.).
Из соотношения
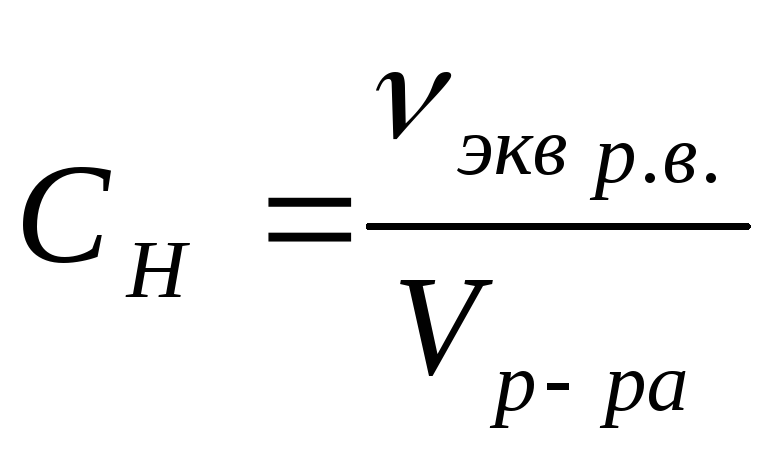
следует νэкв(К.)·V(K.)
= νэкв(Щ.)
·V(Щ.).
Пользуясь
отношением, определим объем раствора
щелочи, необходимый для нейтрализации
раствора Н3РО4:
![]()
Задачи
1.
Водный раствор содержит 577 г H2SO4
в 1 л. Плотность раствора 1335 кг/м3.
Вычислите процентную концентрацию
раствора, а также его нормальность,
молярность, моляльность и мольные доли
H2SO4
и H2O.
2.
Определите нормальность, моляльность,
процентную концентрацию и титр 0,8 М
Fe2(SO4)3,
если плотность раствора равна 1000 кг/м3.
3.
Вычислите процентную концентрацию и
моляльность 8 н. НNО3,
плотность равна 1246 кг/м3.
Каковы мольные доли НNО3
и H2O
в этом растворе?
4.
Вычислите грамм-эквивалент двуосновной
кислоты, 37%-ный раствор которой 12,5 н. и
имеет плотность 1664 кг/м3.
Какая это кислота? Чему равны молярная,
моляльная концентрации и титр раствора
этой кислоты?
5.
Сколько литров 0,1 н. HNO3
можно приготовить из 0,07 л 30%-ного раствора
HNO3
(ρ = 1180 кг/м3)?
6.
Сколько 50-литровых бутылей аккумуляторной
30%-ной серной кислоты (ρ = 1219 кг/м3)
можно приготовить из 12 т 60%-ной серной
кислоты?
7.
Из 5 л 50%-ного раствора гидроксида калия
плотностью 1538 кг/м3
надо приготовить 18%-ный раствор. Сколько
литров воды надо взять?
8.
Какой объем 35%-ного раствора Н3РО4
(ρ = 1216 кг/м3)
требуется для приготовления 13 л 0,15 н.
Н3РО4?
9.
Сколько литров 5 н. NaOH
можно приготовить из 4 л 50%-ного раствора
NaOH (ρ = 1525 кг/м3)?
10.
Сколько литров 24%-ного раствора КОН (ρ
=1218 кг/м3),
необходимого для заливки щелочных
аккумуляторов, можно приготовить из
125 л 48%-ного раствора КОН (ρ =1510 кг/м3)?
11.
Какой объем 96%-ной серной кислоты нужно
взять для приготовления 5л 0,5 М H2SO4?
Плотность 96%-ной H2SO4
равна 1835 кг/м3.
12.
К 0,5 л 98%-ного раствора серной кислоты,
плотность которой 1837 кг/м3,
прибавлено 3 л воды. Какова процентная
концентрация полученного раствора?
13.
Сколько воды нужно прибавить к 0,1 л
40%-ного раствора гидроксида калия,
плотность которого 1411 кг/м3,
чтобы получить 18%-ный раствор?
14.
Какой объем 4%-ного раствора НСl
(ρ = 1018 кг/м3)
необходимо прибавить к 0,5 л 0,02 н. AgNO3
для полного осаждения иона Ag+
в виде AgCl?
15.
В каких соотношениях надо взять 90%-ный
и 8%-ный растворы серной кислоты для
приготовления 48%-ного раствора?
16.
В каких объемных соотношениях надо
смешивать соляную кислоту (ρ =1189 кг/м3)
и воду для приготовления раствора,
имеющего плотность 1098 кг/м3?
17.
К 0,80 л 30%-ного раствора гидроксида
натрия (ρ = 1328 кг/м3)
прибавлено 0,40 л 14%-ного раствора NaOH (ρ =
1153 кг/м3).
Определите процентную концентрацию
полученного раствора и его плотность.
18.
Определите, в каких объемных соотношениях
необходимо взять растворы КОН плотностью
1100 кг/м3
и 1411 кг/м3
для приготовления раствора КОН
плотностью 1240 кг/м3.
19.
Плотность раствора Na2CO3
равна 1102 кг/м3.
Из 4 л этого раствора при действии соляной
кислоты получено 66,6 л CO2
при н. у. Вычислите процентное содержание
Na2CO3
в растворе.
20.
Каким объемом 4 н. H2SO4
можно полностью разложить, 0,65 л 20%-ного
раствора К2СО3
(ρ = 1189 кг/м3)?
Какой объем займет выделившийся газ
при н. у.?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить молярную концентрацию
Для определения молярной концентрации раствора определите количество вещества в молях, которое находится в единице объема раствора. Для этого найдите массу и химическую формулу растворенного вещества, найдите его количество в молях и поделите на объем раствора.

Вам понадобится
- мерный цилиндр, весы, таблица Менделеева.
Инструкция
С помощью точных весов найдите массу растворяемого вещества в граммах. Определите его химическую формулу. Затем с помощью таблицы Менделеева найдите атомные массы всех частиц, входящих в молекулу исходного вещества и сложите их. Если в молекуле присутствует несколько одинаковых частиц, атомную массу одной частицы умножайте на их количество. Полученное число будет равно молярной массе данного вещества в граммах на моль. Найдите количество растворяемого вещества в молях, для чего массу вещества поделите на его молярную массу.
Растворите вещество в растворителе. Это может быть вода, спирт, эфир или другая жидкость. Проследите, чтобы в растворе не осталось твердых частиц вещества. Залейте раствор в мерный цилиндр и найдите его объем по количеству делений на шкале. Объем измеряйте в см³ или миллилитрах. Для определения непосредственно молярной концентрации поделите количество растворенного вещества в молях, на объем раствора в см³. Результат получится в молях на см³.
Если раствор уже готов, то в большинстве случаев его концентрация определяется в массовых долях. Для определения молярной концентрации рассчитайте массу растворенного вещества. На весах определите массу раствора. Умножьте известный процент растворенного вещества на массу раствора и поделите на 100%. Например, если известно, что имеется 10% раствор поваренной соли, нужно массу раствора умножить на 10 и поделить на 100.
Определите химическую форму растворенного вещества и с помощью уже описанной методики найдите его молярную массу. Затем найдите количество растворенного вещества в молях, поделив рассчитанную массу на молярную. С помощью мерного цилиндра найдите объем всего раствора и количество вещества в молях поделите на этот объем. Результатом будет молярная концентрация вещества в данном растворе.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение молярности раствора
Молярность (molarity) – способ выражения концентрации, показывающей количество растворенного вещества (n, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
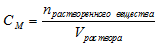
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
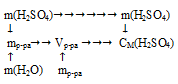
1. Определим количество вещества серной кислоты:
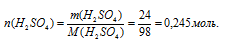
2. Определим объем раствора:
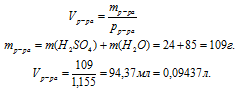
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
CМ = n(H2SO4)/V(p-pa) = 0,245/0,09437 = 2,6 моль/л.
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.
Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
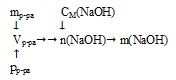
1. Определим объем 700 г раствора
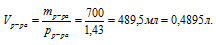
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
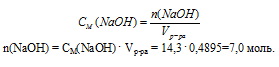
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 . 40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
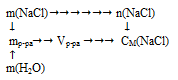
1 . Определяем количество вещества NаС1:
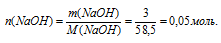
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН2О) = 3 + 200 = 203 г.
3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
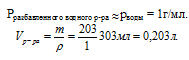
Определим молярную концентрацию NаС1 в растворе:
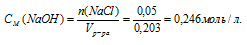
Ответ: 0,24моль/л.
Комментарии:
1Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2Справочное значение плотности данного раствора равно 1,009 г/мл.
Раствор – однородная система, состоящая из растворителя и растворенного в нем вещества (или нескольких). Количественная характеристика определяется концентрацией веществ, входящих в их состав.
Массовая доля
Массовая доля – это отношение массы растворённого вещества к массе всего раствора.
ω(%)=mxmX×100%omega left(% right)= frac{m_{x}}{m_{X}} times 100%
Сколько калия хлорида (в граммах) содержится в 100г 10% раствора?
Решение:
Масса калия хлорида (молярная масса MM для KClKCl 75г/моль):
mKCl=ω×M100%=10%×75100%=7,5m_{KCl}=frac{omega times M}{100%}=frac{10% times 75}{100%}=7,5г
Ответ: 7,5г.
Сколько необходимо добавить натрия гидроксида к 120г 3% раствора этой же соли, что бы концентрация увеличилась в три раза?
Решение:
Масса натрия гироксида исходная (MNaOH=40M_{NaOH}=40 г/моль:
m1NaOH=ω×M100%=3%×40100%=1,2m_{1NaOH}=frac{omega times M}{100%}=frac{3%times 40}{100%}=1,2г
Массовая доля натрия гидроксида в необходимом растворе:
ω2%=ω%×3=3%×3=9%omega _{2}%=omega%times3=3%times3=9%
Масса NaOH в необходимом растворе:
m2NaOH=9%×40100%=3,6m_{2NaOH}=frac{9%times 40}{100%}=3,6г
Необходимое количество рассчитываем как разность:
mNaOH=m2NaOH−m1NaOH=3,6−1,2=2,4m_{NaOH}=m_{2NaOH}-m_{1NaOH}=3,6-1,2=2,4г
Ответ: 2,4г.
Молярная концентрация
Молярная концентрация – количество вещества (в молях) в объеме раствора.
Количество растворенного вещества (в молях) выражается как масса вещества (в граммах), деленная на молярную массу (г/моль).
η=mxMeta =frac{m_{x}}{M}
Молярная концентрация выражается в формуле:
Cx=ηV=η=mxM×VC_{x} = frac{eta }{V} = eta =frac{m_{x}}{M}times V
Определите молярную концентрацию калия иодида. В 120мл воды содержится 15г KI.
Решение:
Выражаем молярную концентрацию (моль/л) KI по формуле ($M_(KI)=$166г/моль):
CKI=mKIMKI×VC_{KI} =frac{m_{KI}}{M_{KI}}times V=15166×0,12=0,01=frac{15}{166}times 0,12=0,01моль/л
Т.к. молярная концентрация выражается в моль/л миллилитры переводим в литры.
Ответ: 3,61 моль/л.
Какая масса лития хлорида содержится в 200мл 3М раствора?
Решение:
Находим количество растворенного лития хлорида (моль):
η=CLiCl×V=3×0,2=0,6eta =C_{LiCl}times V=3times 0,2=0,6г
Выражаем массу M(LiCl)=M_ (LiCl)= 42,3г/моль):
mLiCl=ηLiCl×MLiCl=0,6×42.3=25,4m_{LiCl}=eta_{LiCl} times M_{LiCl}=0,6times 42.3=25,4г
Ответ: 25,4г.
Молярная (мольная) доля
Молярная (мольная) доля – отношения количества вещества в растворе к количеству всех веществ, образующих раствор.
Nx%=nx∑n×100%N_{x}%=frac{n_{x}}{sum{n}}times 100%
Концентрация бария хлорида в 100мл водного раствора равна 20%. Определите его мольную долю.
MBaCl2=208M_{BaCl_{2}}=208моль/л, MH2O=18M_{H_{2}O}=18моль/л.
Решение:
Находим содержание воды:
ωH2O=100%−ωBaCl2=100%−20%=80%omega _{H_{2}O}=100%-omega BaCl_{2}=100%-20%=80%
Т.к. объем раствора равен 100мл, то массы каждого компонента равны значениям массовой доли. Следовательно:
mBaCl2=20m_{BaCl_{2}}=20г
mH2O=80m_{H_{2}O}=80г
Определим количество ηeta для бария хлорида и воды:
ηBaCl2=mBaCl2MBaCl2=20208=0,01eta_{BaCl_{2}}=frac{m_{BaCl_{2}}}{M_{BaCl_{2}}}=frac{20}{208}=0,01моль
ηH2O=mH2OMH2O=2018=1,1eta_{H_{2}O}=frac{m_{H_{2}O}}{M_{H_{2}O}}=frac{20}{18}=1,1моль
Определяем мольную долю NBaCl2N_{BaCl_{2}}:
NBaCl2=ηBaCl2ηBaCl2+ηH2O×100%=0,010,01+0,1×100%=9%N_{BaCl_{2}}=frac{eta BaCl_{2}}{eta BaCl_{2}+eta H_{2}O}times 100%=frac{0,01}{0,01+0,1}times 100%=9%
Ответ: 9%
Молярная концентрация эквивалента
Молярная концентрация эквивалента (нормальность) – число моль эквивалентов в объеме раствора.
C1/z=mxM1/z×VC_{1/z} = frac{m_{x}}{M_{1/z}times V}моль*экв/литр
Фактор эквивалентности f1/zf_{1/z} – показывает часть реальной частицы, составляющую эквивалент.
Молярная масса эквивалента M1/zM_{1/z} – произведение молярной массы и фактора эквивалентности:
M1/z=M×f1/zM_{1/z} = M times f_{1/z}г/моль
Определите молярную концентрацию эквивалента 4.6г серной кислоты, нейтрализованной раствором гидроксида натрия. В результате реакции общий объём составил 100мл.
Решение:
MH2SO4=98M_{H_{2}SO_{4}}=98г/моль, f1/z=1/2f_{1/z=1/2}.
Находим молярную массу эквивалента для серной кислоты:
M1/zH2SO4=MH2SO4×f1/zM_{1/z H_{2}SO_{4}} = M _{H_{2}SO_{4}}times f_{1/z} = 98times 1/2=49$г/моль
Находим нормальность:
C1/zH2SO4=mH2SO4M1/zH2SO4×V=4,649×0,1=0,94C_{1/z H_{2}SO_{4}} = frac{m_{H_{2}SO_{4}}}{M_{1/z H_{2}SO_{4}}times V}=frac{4,6}{49times
0,1}=0,94моль*экв/л
Ответ: 0,94моль*экв/л.
Моляльность
Моляльность – количество вещества в килограмме растворителя.
Сm=ηxmС_{m}=frac{eta _{x}}{m}моль/кг
В 300г воды растворили 20г калия гидроксида. Определите моляльную концентрацию раствора.
Решение:
MKOH=98M_{KOH}=98г/моль.
Находим количество калия гидроксида:
ηKOH=mKOHM=2056=0,36eta _{KOH} = frac{m_{KOH}}{M}=frac{20}{56}=0,36моль
Находим моляльность (граммы переводим в килограммы):
CKOH=ηKOHm=0,360,3=1,2C_{KOH}=frac{eta _{KOH}}{m}=frac{0,36}{0,3}=1,2моль/кг
Ответ: 1,2 моль/кг.
