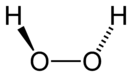Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Molar mass of 2H2O = 20.01528 g/mol
Convert grams 2H2O to moles
or
moles 2H2O to grams
Molecular weight calculation:
2 + 1.00794*2 + 15.9994
Percent composition by element
Element: Hydrogen
Symbol: H
Atomic Mass: 1.00794
# of Atoms: 4
Mass Percent: 20.064%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 1
Mass Percent: 89.928%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
36.0306 g/mol
The molar mass and molecular weight of 2(H)2(O) is 36.031.
| Element | Symbol | Atomic Mass | # of Atoms | Mass Percent |
|---|---|---|---|---|
| Hydrogen | H | 4.0318 g/mol | 4 | 11.1898% |
| Oxygen | O | 31.9988 g/mol | 2 | 88.8102% |
2(H)2(O) Element Mass PercentOxygen31.9988gOxygen31.9988gHydrogen4.0318gHydrogen4.0318g
2(H)2(O) # of AtomsHydrogen4Hydrogen4Oxygen2Oxygen2
Finding Molar Mass
Read our article on how to calculate molar mass.
You can also ask for help in our chat or forums.
Find the Molar Mass of 2(H)2(O) Step-by-Step
There are 4 easy steps to find the molar mass of 2(H)2(O) based on its chemical formula.
1. Count The Number of Each Atom
The first step to finding the molar mass is to count the number of each atom present in a single molecule using the chemical formula, 2(H)2(O):
| Element | Number of Atoms |
|---|---|
| H (Hydrogen) | 4 |
| O (Oxygen) | 2 |
2. Find Atomic Mass of Each Element
Next, using the periodic table, find the atomic mass in g/mol of each element (the molar mass of an element is equal to its atomic mass):
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 1.00794 |
| O (Oxygen) | 15.9994 |
3. Compute Mass of Each Element
Multiply the number of atoms by the atomic weight of each element found in steps 1 and 2 to get the mass of each element in 2(H)2(O):
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 4 × 1.00794 = 4.03176 |
| O (Oxygen) | 2 × 15.9994 = 31.9988 |
4. Sum Each Element’s Mass
Finally, add together the total mass of each element to get the molar mass of 2(H)2(O):
4.03176 g/mol + 31.9988 g/mol = 36.03056 g/mol
| Пероксид водорода | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Пероксид водорода | |
| Традиционные названия | Перекись водорода | |
| Хим. формула | H2O2 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 34,01 г/моль | |
| Плотность | 1.4 г/см³ | |
| Кинематическая вязкость |
1,245 см²/с (при 20 °C) |
|
| Энергия ионизации | 10,54 ± 0,01 эВ[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −0,432 °C | |
| • кипения | 150,2 °C | |
| Энтальпия | ||
| • образования | -136.11 кДж/моль | |
| Давление пара | 5 ± 1 мм рт.ст.[1] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
11.65 | |
| Растворимость | ||
| • в воде | Неограниченная | |
| Классификация | ||
| Рег. номер CAS | 7722-84-1 | |
| PubChem | 784 | |
| Рег. номер EINECS | 231-765-0 | |
| SMILES |
OO |
|
| InChI |
InChI=1S/H2O2/c1-2/h1-2H MHAJPDPJQMAIIY-UHFFFAOYSA-N |
|
| RTECS | MX0900000 | |
| ChEBI | 16240 | |
| ChemSpider | 763 | |
| Безопасность | ||
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 3 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Перокси́д водоро́да (пе́рекись водоро́да, химическая формула — H2O2) — неорганическое химическое соединение водорода и кислорода, являющееся простейшим представителем класса пероксидов.
Физические свойства[править | править код]
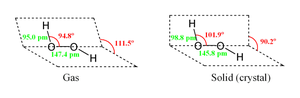
Структура молекулы пероксида водорода
Вследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Водородный показатель — 4,75. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
При стандартных условиях пероксид водорода — это бесцветная сиропообразная[2] тяжёлая полярная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и диэтиловом эфире.
Также он является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H2O2∙2H2O.
Концентрированные водные растворы пероксида водорода взрывоопасны.
Химические свойства[править | править код]
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соединение, легко разлагается. Также этому может поспособствовать присутствие ионов переходных металлов. Чистое вещество крайне неустойчиво и разлагается с выделением теплоты, поэтому в высококонцентрированных его растворах и в пергидроле присутствуют стабилизирующие добавки. Однако в разбавленных водных растворах пероксид водорода сравнительно устойчив[2]. Реакция диспропорционирования катализируется ионами переходных металлов, некоторыми белками:
В присутствии катализаторов разложения в среде кислорода может появляться озон:
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12) и поэтому диссоциирует по двум ступеням:
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства[править | править код]
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганца при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
например:
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Биологические свойства[править | править код]
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Получение[править | править код]
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[3]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:

Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[4].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта
[5]:
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию разбавленной серной кислоты с пероксидом бария:
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
При растворении гидроперита в воде образуется пероксид водорода и мочевина.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H[6].
Является одним из промежуточных продуктов сгорания водорода, однако сразу же разлагается на воду и кислород. Но при направлении пламени на лёд можно увидеть следы перекиси водорода[2].
Методы определения концентрации[править | править код]
В разбавленных водных растворах с концентрацией пероксида водорода порядка 10-20 мМ точные значения концентрации могут быть определены спектрофотометрически в ультрафиолетовом диапазоне длин волн. При 240 нм водный раствор пероксида водорода с концентрацией 20 мМ имеет величину поглощения 0,872 при измерении против дистиллированной воды.[7]
Применение[править | править код]

3%-й раствор перекиси водорода
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[8] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
В медицине и гигиене[править | править код]
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также увеличивает время заживления[9][10]. Обладая хорошими очищающими и определёнными кровоостанавливающими свойствами, пероксид водорода на самом деле не ускоряет заживления ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также увеличивать время заживления из-за повреждения прилегающих к ране клеток[11]. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи[12].
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
В косметических целях[править | править код]
Пероксид водорода применяется также для обесцвечивания волос[13].
В пищевой промышленности[править | править код]
Растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»).
В технических целях пероксид водорода применяют в производстве электронной техники.
В быту[править | править код]
Применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств), удаления пятен крови с одежды и др.
3%-й раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме[14].
Для демонстрации химической реакции[править | править код]
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[15].
Формы выпуска[править | править код]
Выпускается в виде водных растворов, стандартная концентрация 1—6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 1376 дней]. 30%-й водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
Опасность применения[править | править код]
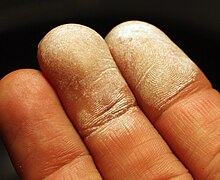
Кожа после попадания на неё концентрированного раствора перекиси водорода
Концентрированные растворы пероксида водорода при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл[16].
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ 1 2 3 Общая химия: учебное пособие/Н. Л. Глинка. — Изд. стер. — М.: КНОРУС, 2012. — 752 с. — ISBN 978-5-406-02149-1
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑
Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962—6984. — doi:10.1002/anie.200503779. — PMID 17039551. - ↑
Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society (англ.) (рус. : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884—1893. — ISSN 0368-1769. — doi:10.1039/JR9610001884. - ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Разыграев А.В. Гомоцистеинпероксидазная активность плазмы крови крыс. Стехиометрия и ферментативный характер реакции (рус.) // Биомедицинская химия. — 2013-11-12. — Т. 59, вып. 6. — С. 636–643. — doi:10.18097/pbmc20135906636. Архивировано 11 декабря 2021 года.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd. Really? The Claim: Hydrogen Peroxide Is a Good Treatment for Small Wounds, New York Times (19 июня 2007). Архивировано 10 ноября 2011 года. Дата обращения: 13 июля 2011.
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don’t die easily, CNN (12 июля 2011). Архивировано 10 ноября 2012 года. Дата обращения: 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513—519. — doi:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос. Дата обращения: 4 января 2011. Архивировано 9 февраля 2011 года.
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant’s Toothpaste. University of Utah Chemistry Demonstrations. University of Utah. Дата обращения: 21 марта 2014. Архивировано из оригинала 23 декабря 2014 года.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник]
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки[править | править код]
- NIST Chemistry WebBook
- Относительная молекулярная масса H2O: 18.01528
- Молярная масса H2O: 18.01528 г/моль (0.01802 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 2 | 1.00794 | 2.01588 |
| O (кислород) | 1 | 15.9994 | 15.9994 |
| 18.01528 |
Расчёт молярной и относительной молекулярной массы H2O
- Mr[H2O] = Ar[H] * 2 + Ar[O] = 1.00794 * 2 + 15.9994 = 18.01528
- Молярная масса (в кг/моль) = Mr[H2O] : 1000 = 18.01528 : 1000 = 0.01802 кг/моль
Расчёт массовых долей элементов в H2O
- Массовая доля водорода (H) = 2.01588 : 18.01528 * 100 = 11.19 %
- Массовая доля кислорода (O) = 15.9994 : 18.01528 * 100 = 88.81 %