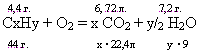-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
-
Химия
Предыдущий вопрос
Следующий вопрос
RONI20
3 года назад
Ответ
Проверено экспертом
Ответ дан
DranikDotCom
Ответ:
30г/моль
Объяснение:
DH2=15=M(R-COH)/M(H2)
M(R-COH)=DH2*M(H2)=(15*2*1)г/моль=30г/моль
Ответы и объяснения
- RONI20
Не тот ответ, который тебе нужен?
Найди нужный
- Формула: CH3CHO или C2H4O
- Относительная молекулярная масса CH3CHO: 44.05256
- Молярная масса CH3CHO: 44.05256 г/моль (0.04405 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| C (углерод) | 2 | 12.0107 | 24.0214 |
| H (водород) | 4 | 1.00794 | 4.03176 |
| O (кислород) | 1 | 15.9994 | 15.9994 |
| 44.05256 |
Расчёт молярной и относительной молекулярной массы CH3CHO
- Mr[CH3CHO] = Ar[C] * 2 + Ar[H] * 4 + Ar[O] = 12.0107 * 2 + 1.00794 * 4 + 15.9994 = 44.05256
- Молярная масса (в кг/моль) = Mr[CH3CHO] : 1000 = 44.05256 : 1000 = 0.04405 кг/моль
Расчёт массовых долей элементов в CH3CHO
- Массовая доля углерода (C) = 24.0214 : 44.05256 * 100 = 54.529 %
- Массовая доля водорода (H) = 4.03176 : 44.05256 * 100 = 9.152 %
- Массовая доля кислорода (O) = 15.9994 : 44.05256 * 100 = 36.319 %
Калькулятор массы
С задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
|
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества |
Задачи для самостоятельного решения |
|
– на основании массовых долей (%) атомов элементов |
1 |
M |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
|
– на основании массовых долей (%) атомов элементов и плотности соединения |
2 |
М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О |
|
– по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
|
– на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Масса 1 л. этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу углеводорода. |
|
– по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества.Ответ: C6H14О |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
|
Дано: |
Решение: M кислоты |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
|
Дано: |
Решение:
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
|
Дано: |
Решение: |
|
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
|
Дано: |
Решение: |
|
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
|
Дано: |
Решение: Составляем пропорции: |
|
Вывести формулу |
Вернуться к табл.1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
|
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
|
Вывести формулу соединения |
Вернуться к табл.1
Кто не видел белого медведя? В зоопарках он – обычный гость. Нет нужды описывать, каков он на вид. Напомним лишь, что у него только нос черный, сам медведь белый и зимой, и летом (а не как, скажем, песец или заяц-беляк – те лишь зимой белые). Подошвы лап у белого медведя густой шерстью поросли, а пальцы примерно на половину своей длины соединены плавательными перепонками.
Плавают и ныряют белые медведи отлично. Две минуты могут пробыть под водой, но погружаются в нее редко глубже двух метров. Далеко в открытом море не раз видели белых медведей, даже медведиц с медвежатами. Плывут со скоростью 5 километров в час, не беспокоясь, что ни земли, ни льдов нигде вблизи не видно.
Белый медведь и тюленей ловит не только на льду, украдкой к ним подползая. Обычный его прием, так сказать, атаки с моря такой: поблизости от лежбищ тюленей медведь осторожно, без плеска и шума, сползает в воду, плывет туда, где заметил тюленей. Затем он бесшумно ныряет и выныривает уже у самого лежбища, быстро карабкается на лед, отрезая тем самым тюленям путь к спасительной воде. По отвесным ледяным стенам медведь может прямо из воды выпрыгнуть на льдину, даже если высота ее над водой два метра.
Тюлени – главная охотничья добыча белого медведя весной. За год ловит и съедает он примерно 50 тюленей. Летом меню его более разнообразно. Ловит он рыбу на мелкой воде, на берегу – леммингов, песцов, лакомится яйцами птиц. Когда голоден, ест ягоды, водоросли, мхи, лишайник, грибы.
Белый медведь – самый могучий из сухопутных хищных зверей. Лев и тигр в сравнении с ним легковесы: средний вес медведиц 310 килограммов, медведей-самцов – 420 килограммов. Если медведь матерый и хорошо упитанный, то он может весить целую тонну!
Акимушкин И.И. Мир животных: Млекопитающие, или звери. – М., 1988 г
IV. Тест по русскому языку
1. В тексте про белых медведей больше всего предложений:
а) повествовательных; б) вопросительных
2. Восклицательное предложение находится:
а) в начале текста; б) в конце текста
3. Вопросительное предложение находится
а) в начале текста; б) в конце текста
4. Выпиши из второй части текста (из второго абзаца) первое предложение. Разбери его по членам предложения. Что ты можешь сказать о сказуемых? Они являются
а) родственными словами; б) однородными членами предложения
5. Что можно сказать о глаголах, которыми выражены сказуемые? Эти глаголы:
а) I спряжения; б) II спряжения
6. Эти глаголы стоят в форме:
а) настоящего времени; б) будущего времени; в) прошедшего времени
7. Эти глаголы стоят в форме:
а) единственного числа; б) множественного числа
8. Эти глаголы стоят в форме:
а) 1-го лица; б) 2-го лица; в) 3-го лица; г)нельзя определить лицо
9. Эти глаголы стоят в форме:
а) ж.р.; б) м.р.; в) ср.р.; г) нельзя определить род
10. Найди во второй части текста (во втором абзаце) все слова, которые являются родственными существительному, являющемуся подлежащим в первом предложении. Запиши их столбиком, поставив в начальную форму. У тебя получилось:
а) два слова; б) три слова
11. Найди во второй части текста (во втором абзаце) другую форму слова, которое является подлежащим в первом предложении. Выпиши такое словосочетание с формой этого слова, из которого можно определить его падеж. Этот падеж:
а) Р.п.; б) В.п.