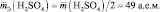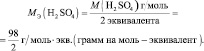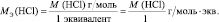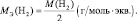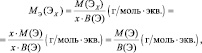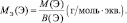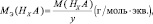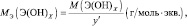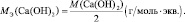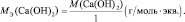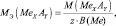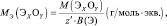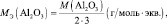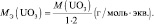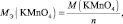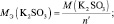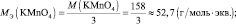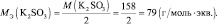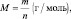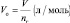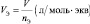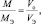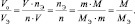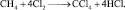Эквивале́нт вещества́ или просто эквивале́нт — безразмерная величина, равная количеству одного вещества, реагирующему в конкретной реакции с произвольным (часто – равным 1 моль) количеством другого вещества; общее формальное определение выглядит так:
-
- для реакции аА + bВ –> …
- эквивалент вещества В по веществу А есть отношение а/b (читается: “одна частица В эквивалентна а/b частиц А” или (что то же самое, см. ниже) “одна порция вещества В эквивалентна а/b порций вещества А”)
- (где а и b – коэффициенты перед этими веществами в уравнении реакции, а их отношение – называется также “мольное соотношение” или “мольное отношение”, или “число эквивалентности”;
- отношение b/а (то есть обратное) называется “фактор эквивалентности вещества В по веществу А”, см. ниже; также, b/а – является коэффициентом перед веществом В в приведённом по веществу А уравнении той же самой реакции). Иногда эквивалентном вещества называют непосредственно фактор эквивалентности этого вещества, не проводя между ними различий. [1]
Эквивалент – архаичная величина, которая использовалась в химии и биологии с начала ХIХ до середины ХХ веков (см. ниже раздел “история”). Говорить об эквиваленте вещества имеет смысл только относительно конкретной реакции. Само по себе понятие эквивалента используется редко; чаще встречаются обороты речи “эквивалентное соотношение веществ” и величины: “фактор эквивалентности”, “молярная масса эквивалента”, “эквивалентная масса”, “эквивалентная концентрация” (синоним: “нормальная концентрация”, устаревший синоним: “нормальность”), “количество вещества эквивалентна”.
Более частными определениями являются такие:
1) в окислительно-восстановительной реакции (по определению: в реакции, в которой происходит изменение степеней окисления атомов, то есть происходит обмен электронами) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции электронов (если рассматривать атомы окислителя или восстановителя – то величина изменения степени окисления такого атома в данной реакции); то есть в определении выше, А = 
2) в кислотно-основной реакции (по определению: в реакции, в которой не происходит изменения степеней окисления атомов, то есть обмениваются частицы, отличные от электронов) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции протонам, или гидроксил-ионам; то есть в определении выше, А = 
Фактор эквивалентности был определён выше[1]:
для реакции аА + bВ –> …
-
- фактор эквивалентности f(вещества В по веществу А) = b/а
- f = 1/Z, где Z – число эквивалентности (то есть эквивалент; число, обратное f), изменение степени окисления (количество отданных или принятых электронов), количество протонов или гидроксил-ионов в данной реакции.
Все остальные перечисленные выше “эквивалентные” величины получаются[1] умножением соответствующих не-эквивалентных величин на фактор эквивалентности f:
-
- молярная масса эквивалента вещества = молярная масса вещества * f = молярная масса вещества / Z
-
- нормальная концентрация = молярная концентрация * f
-
- количество вещества эквивалента = количество вещества * f
Кроме указанных выше, встречаются также определения фактора эквивалентности, основанные на отношении молярных масс (и до 1870 года – основанные на “эквивалентных весах элементов”), например:
“Эквивалентный вес кислоты или основания для реакций нейтрализации или любого другого соединения, которое действует путем двойного разложения, представляет собой массу соединения, которое будет давать или вступать в реакцию с 1,008 г иона водорода или 17,0074 г иона гидроксида, например, соляная кислота (HCl), 36,461 г; серная кислота (H2SO4), 98,078 г; гидроксид натрия (NaOH), 40 г; или карбонат натрия (Na2CO3), 105,9892 г.”
Также встречаются устаревшие определения фактора эквивалентности на основе понятия валентности (которое фактически не используется в химии примерно с середина ХХ века).
Также встречаются определения эквивалента с использованием понятия “мнимых” частиц и с использованием (принципиально ложной, физически противоречивой) предпосылки, что уравнение химической реакции описывает поведение неких отдельных частиц вещества, а не порций порядка молей веществ[1]:
“Эквивалентном называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равносильна) в данной реакции одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях)”
Примеры использования:
В реакции 
-
- вещество
эквивалентно 1
-иону (число эквивалентности Z = 1), фактор эквивалентности фосфорной кислоты = 1/1; f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 2
-ионам (Z = 2), фактор эквивалентности фосфорной кислоты = 1/2: f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 3
-ионам (Z = 3), фактор эквивалентности фосфорной кислоты = 1/3; f(NaOH) = 1.
- вещество
В реакции 
-
- 1 условная единица вещества
эквивалентна 5 электронам (Z = 5, f(перманганата) = 0,2) и 8 порциям HCl (f(перманганата) = 1/8)
- 1 условная единица вещества
В реакции 
-
- f(перманганата по электронам) = 1; f(перманганата по гидроксиду бария) = 0,25.
В реакции 
-
- f(перманганата по электронам) = 1/3; f(перманганата по сероводороду) = 2/3; f(сероводорода по электронам) = 0,5; f(сероводорода по перманганату) = 1,5
История понятия “эквивалентов”[править | править код]
История предпосылок, понятия эквивалентов, эквивалентных масс и смены этих понятий на последующие, более обоснованные физически, сводиться к попыткам химиков ответить на вопрос: “в каком соотношении реагируют вещества?” (актуальный ответ, который мы знаем теперь, но который разработчики понятий эквивалентна не знали: в мольном соотношении; то есть в соотношении количеств частиц (атомов, молекул, электронов, ионов; количество выражается в молях), равным отношению коэффициентов перед веществами в уравнении реакции, так называемый “основной закон химической стехиометрии”[2]) и установить строение веществ, которые реагировали.
Первые эквивалентные массы кислот и оснований были опубликованы Карлом Фридрихом Венцелем в 1777 году [3][4], он же ввёл понятие “эквивалентных количеств веществ” и “эквивалента вещества” (трактат “Учение о химическом сродстве тел”). В результате экспериментов в обменными реакциями солей, Карл Венцель пришёл к выводу, что для нейтрализации одного и того же количества кислоты или основания требуются различные количества других кислот или оснований. Он предложил “закон нейтральности”:
- “Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты”
Более крупный набор таблиц был подготовлен, с опорой на работу Венцеля, немецким химиком Иеремией Бенджамином Рихтером. Основные выводы и эксперименты он опубликовал в своей книге 1972 г “Стехиометрия, или искусство измерения химических элементов”, и его “закон эквивалентов” является развитием “закона нейтральности” Венцеля.
Рихтер сформилировал закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
Под Э подразумевается элемент или вещество; под m – масса.
Оба автора – Венцель и Рихтер – не признавали атомную теорию, и не смогли развить концепцию стехиометрии дальше. Их концепции для современников прошли незамеченными и далее не были развиты во что-либо; хотя их таблицы соотношений нейтрализации были перепечатаны несколькими известными химиками того времени.
Тем не менее, многие химики сочли эквивалентные веса полезным инструментом, независимо от того, придерживались ли эти химики атомной теории. Эквивалентные веса были полезным обобщением “закона определенных пропорций” (он же – “закон постоянства состава”) Джозефа Пруста (1794 г.), который позволил химии стать количественной наукой. Он развил идею о постоянстве состава веществ и о постоянстве количественных отношений, в которых вещества могут соединяться. Французский химик Жан-Батист Дюма (1800–1884 гг.) стал одним из наиболее влиятельных противников атомной теории после того, как принял ее в начале своей карьеры, но был стойким сторонником эквивалентных весов. Далее Дальтон развил идею, сформулировав”закон кратных отношений”. Дальше понятие о постоянных соотношениях реагентов получило в работах Луи Гей-Люссака и в молекулярной теории А.Авогадро.
Последним смертельным ударом по использованию эквивалентных весов элементов стало представление Дмитрием Менделеевым его периодической таблицы в 1869 году, в которой он связал химические свойства элементов с приблизительным порядком их атомных весов. Однако эквивалентные веса продолжали использоваться для многих соединений еще сто лет, особенно в аналитической химии. Эквивалентные массы обычных реагентов можно было заносить в таблицы, что упрощало аналитические расчеты до того, как электронные калькуляторы стали широко доступны: такие таблицы были обычным явлением в учебниках аналитической химии. После разработки теории строения атомов и молекул, в химии окончательно утвердилось понятие о мольном соотношении.
По состоянию на 2023 год, понятие “фактор эквивалентности” всё ещё печатается в учебниках по общей химии для ВУЗов, а также используется в аналитической химии (в титриметрическом анализе).
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ 1 2 3 4 Васильев В.П. – “Аналитическая химия”, в 2 томах. – том 1, стр 181-182. – М.: Высшая школа, 1989
- ↑ В.В.Ерёмин, А.Я.Борщевский – “Основы общей и физической химии”. – Долгопрудный: Интеллект, 2012. – стр.28
- ↑ Фигуровский Н.А. “История химии: учебное пособие для студентов пед. ин-тов по хим. и биол. специальностям”. – М.: Просвещение, 1979. – стр. 70-76
- ↑ М.Джуа – “История химии”. – М.: МИР, 1975. – стр.163-218
Закон эквивалентов
Количественный подход к
изучению химических явлений и установление
закона постоянства состава показали,
что вещества вступают во взаимодействие
в определенных соотношениях масс, что
привело к введению такого важного
понятия, как “эквивалент”,
и установлению закона
эквивалентов.
Эквивалент
–
это
частица или часть частицы, которая
соединяется (взаимодействует) с одним
атомом водорода или с одним электроном.
Из
этого определения видно, что понятие
“эквивалент” относится к конкретной
химической реакции; если его относят к
атому в химическом соединении, то имеют
в виду реакцию образования этого
соединения из соответствующего простого
вещества и называют эквивалентом
элемента в соединении.
В
одной формульной единице вещества (В)
может содержаться Zв
эквивалентов этого вещества. Число Zв
называют показателем
эквивалентности.
Фактор
эквивалентности (f)
–
доля частицы, составляющая эквивалент;
f
£
1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ
=
. (1.7)
Масса
1 моль эквивалентов, выраженная в граммах,
называется молярной
эквивалентной массой (Мэк)
(г/моль); численно она равна относительной
молекулярной массе эквивалента (кратко
ее называют эквивалентной массой).
Мэк
=
fВ·М. (1.8)
Закон
эквивалентов: массы
взаимодействующих без остатка веществ
соотносятся как их эквивалентные массы.
Математическое выражение закона
эквивалентов:
, (1.9)
где Мэк,1
и Мэк,2
–
эквивалентные массы.
Пример
8. Определить эквивалент
и эквивалентную массу кислорода в Н2О.
Решение.
Такая формулировка вопроса предполагает
реакцию образования молекулы воды из
кислорода и водорода:
H2
+ ½O2
= Н2О,
то есть с 1 атомом водорода
соединяется ½
атомов кислорода.
Следовательно, Z(О)
= 2. Масса 1 моль атомов кислорода равна
16 г, отсюда
Мэк(O)
= М (О)·
=
= 8 г/ моль.
Эквиваленты
одних и тех же элементов в различных
химических соединениях могут различаться,
так как величина эквивалента зависит
от характера превращения, претерпеваемого
им. Так, в соединении SO2
эквивалентная масса серы равна 8 г/моль,
что составляет 1/4 от атомной массы, а в
соединении SO3
–
5,3 г/моль, что составляет 1/6 от атомной
массы серы (ZS
= 4 и 6, соответственно). Практический
расчет эквивалентной массы элемента в
соединении ведут по формуле
Мэк
(элемента) = Аэк
=
, (1.10)
где
А –
атомная масса, ω –
степень окисления элемента в данном
соединении. (Ниже будет показано, что
для реакции образования соединения из
простых веществ ZВ
= |ω|).
Например,
ZВ
(Mn) в соединении KMnO4
(ω = +7) составляет 7, а
Мэк
(Mn)
=
=
= 7,85 г/моль; в соединении Mn2O3
(ω = +3) – ZВ
= 3 и
Мэк
(Mn)
=
=
= 18,3 г/моль. (55-
масса 1-го моля атомов марганца или
атомная масса).
Эквивалентная
масса вещества в химических реакциях
имеет различные значения в зависимости
от того, в каком взаимодействии это
вещество участвует. Если во взаимодействии
сложного вещества участвует его известное
количество или известно количество
реагирующих групп, то для расчета
эквивалентных масс можно пользоваться
следующими правилами и формулами.
а)
Вещества друг с другом реагируют
одинаковыми количествами эквивалентов.
Например,
в реакции
2Al
+ 3/2O2
= Al2O3
6
моль эквивалентов Al
реагируют с таким же количеством
кислорода
(ZВ
(Al)
= 3, ZВ
(O)
= 2).
б)
Эквивалентная масса кислоты в реакциях
замещения ионов водорода равна:
М
эк.
кислоты
=
(1.11)
Пример
9. Определить эквивалент
и эквивалентную массу H2SO4
в реакциях:
-
H2SO4
+ KOH
= KHSO4
+ H2O
;
-
H2SO4
+ 2KOH
= K2SO4
+ 2H2O
.
Решение.
В первой реакции
заместился один ион водорода, следовательно,
эквивалент серной кислоты равен 1, ZВ
(H2SO4)
= 1, Мэк(H2SO4)
= М1
= 98 г/моль. Во второй реакции заместились
оба иона водорода, следовательно,
эквивалент серной кислоты равен двум
молям, ZВ
(H2SO4)
= 2, а Mэк
(H2SO4)
= 98·½
= 49 г/моль.
в)
Эквивалентная масса основания в реакции
замещения ионов гидроксила равна:
Мэк.
основания
=
.(1.12)
Пример
10. Определить эквивалент и эквивалентные
массы гидроксида висмута в реакциях:
1)
Bi(OH)3
+ HCl = Bi(OH)2Cl
+ H2O;
2)
Bi(OH)3
+ 3HCl = BiCl3
+ H2O.
Решение.
1)
ZВ
Bi(OH)3
= 1, Mэк Bi(OH)3
= 260 г/моль (т. к. из трех ионов гидроксила
заместился один);
2) ZВ
Bi(OH)3
= 3, a Mэк Bi(OH)3
= 260·= 86,3 г/моль (т. к. из трех ионов ОН–
заместились все три).
г)
Эквивалентная
масса соли в реакциях полного замещения
катиона или аниона равна:
Мэк.
соли
=
или
(1.13)
Мэк
соли
=
.
Так,
ZВ
Al2(SO4)3
= 3∙2 = 6. Однако в реакции эта величина
может быть больше (неполное замещение)
или меньше (комплексообразование). Если,
например, это соединение участвует во
взаимодействии по реакции
Al2(SO4)3
+ 12KOH
= 2K3[Al(OH)6]
+ 3K2SO4
,
то
при этом три аниона с суммарным зарядом
6 замещаются 12 ОН–
ионами, следовательно, 12 эквивалентов
этого вещества должно вступать в реакцию.
Таким образом, ZВ
Al2(SO4)3
=
12, а
Мэк
= М·fВ
= 342/12 = 28,5 г/моль.
д)
Эквивалентная
масса оксида в реакциях полного замещения
равна:
Мэк
оксида
=
.(1.14)
Например,
ZВ
(Fe2O3)
= 3·2 = 6. Мэк
= М(Fe2O3)·fВ
= 160×1/6
= 26,6 г/моль. Однако в реакции
Fe2O3
+ 4HCl
= 2FeOHCl2
+ H2O
ZВ
(Fe2O3)
= 4, Мэк
= М(Fe2O3)∙fВ
= 160×1/4
= 40 г/моль, так как Fe2O3
взаимодействует с четырьмя эквивалентами
HCl (fВ
= 1).
При
решении задач, связанных с газообразными
веществами, целесообразно пользоваться
значением эквивалентного
объема.
Это объем, занимаемый одним молем
эквивалентов газообразного вещества.
Пример
11. Рассчитайте эквивалентные объемы
газообразных водорода и кислорода при
н.у.
Решение.
Для водорода при н.у. этот объем равен
11,2 литров (молярный объем Н2составляет 22,4 л, а так как Мэк(Н)
= 1г (т.е. в 2 раза меньше, чем молярная
масса), то эквивалентный объем будет в
2 раза меньше молярного, т. е. 11,2 л),для
кислорода – 5,6л (молярный объем О2составляет 22,4 л, а так как Мэк(О)
= 8г (т.е. в 4 раза меньше, чем молярная
масса О2), то эквивалентный
объем будет в 4 раза меньше, чем молярный.
Пример
12.На
восстановление 1,80 г оксида металла
израсходовано 883 мл водорода (н.у.).
Вычислить эквивалентные массы оксида
и металла.
Решение.
Согласно закону эквивалентов (1.9) массы
(объемы) реагирующих веществ пропорциональны
их эквивалентным массам (объемам):
. Отсюда
(г/моль);
+
,
тогда
г/моль.
Пример
13. Вычислить эквивалентную
массу цинка, если 1,168 г Zn вытеснили из
кислоты 438 мл Н2
(t = 17 оС
и Р = 750 мм рт. ст.).
Решение.
Согласно закону эквивалентов (1.9):
;
Из
уравнения Менделеева-Клапейрона
(1.4):
г,
=
32,6 г/моль.
д)
Эквивалентная масса окислителя и
восстановителя определяются
делением молярной массы на изменение
степени окисления в соответствующей
реакции на 1моль.
Пример
14. Определить эквивалентные массы
окислителя и восстановителя в реакции:
+6
+4
+3
+6
K2Cr2O7
+ 3Na2SO3
+ 4H2SO4
= Cr2(SO4)3
+ 3Na2SO4
+ K2SO4
+ 4H2O.
Решение.
Окислителем в этой реакции являетсяK2Cr2O7,
а восстановителем –Na2SO3.
Суммарное изменение степени окисления
хрома вK2Cr2O7Dw(2Cr)
= 2.(+3) – 2.(+6) = – 6;
Поэтому
г/моль.
Суммарное
изменение степени окисления серы в
Na2SO3:Dw(S)
= +6 – (+4) = +2;
Поэтому
г/моль.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 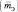
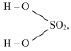
Например, если серная кислота (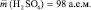
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
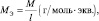
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
Определение молярной массы эквивалента металла
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Определение 1
Эквивалент – это частица вещества (реальная/условная), которая способна замещать/присоединять один ион водорода в кислотно-основных реакциях, а также присоединять/высвобождать один электрон в ходе окислительно-восстановительных реакций.
Молярная масса эквивалента металла
Молярная масса эквивалента ($mathrm {M_э}$ – это масса одного моля эквивалента.
Замечание 1
Моль – это количество вещества, которое содержит столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода.
Рассчитывается молярная масса эквивалента следующим образом:
$mathrm {M_э = f_э cdot M_{в-ва} = frac {M_{в-ва}}{В_{в-ва}}}$
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Где:
- $mathrm {M_э}$ – молярная масса эквивалента (г/моль),
- $mathrm {f_э}$ – фактор эквивалентности (число, которое показывает, какая часть молекулы соответствует эквиваленту),
- $mathrm {M_{в-ва}}$ – молярная масса вещества,
- $mathrm {В_{в-ва}}$ – валентность вещества .
В качестве примера возьмем двухвалентное железо, тогда молярная масса эквивалента будет рассчитываться следующим образом:
$mathrm {M_{Э_{Fe}} = frac {56}{2} = 28 г/моль}$
Закон эквивалентов
Закон эквивалентов гласит, что вещества взаимодействуют в количествах, пропорциональных их эквивалентам.
Из этого следует:
$mathrm {frac{m_1}{m_2} = frac {M_Э1}{M_Э2}}$
Рассмотрим пример решения задачи:
В результате сгорания 5г Ме образовалось 9,44 г оксида этого металла. Необходимо рассчитать молярную массу эквивалента Ме.
- Составим уравнение: $mathrm {2Ме + О_2 to MeO}$.
- Найдем массу кислорода в оксида $mathrm {m_{O_2} = 9,44 – 5 = 4,44 г}$.
- Применим закон эквивалента $mathrm {frac{m_{Me}}{m_{O_2}} = frac{M_{Э_{Me}}}{M_{Э_{O_2}}}}$
Молярная масса эквивалента кислорода равна 8 г/моль ($mathrm {frac {16}{2} = 8}$)
Из этого следует, что молярная масса эквивалента Ме равна: $mathrm {frac {m_{Me}} cdot M_{Э_{О_2}}{m_{O_2}}= frac {40}{4,44} = 9г/моль}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 21.12.2022