Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2021 года; проверки требуют 38 правок.
| Угольная кислота | |
|---|---|
  |
|
| Систематическое название | Угольная кислота |
| Химическая формула | H2CO3 |
| Внешний вид | Бесцветный раствор |
| Свойства | |
| Молярная масса | 62,025 г/моль |
| Температура плавления | -80°C |
| Температура кипения | 333,6°C |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa |
реальные: 1) 3,60; 2) 10,33 кажущаяся[1]: 6,37 |
| Растворимость в воде | 0,21[1] г/100 мл |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 463-79-6 |
| PubChem | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Безопасность | |
| Пиктограммы опасности СГС |
|
| NFPA 704 |
0 0 1 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
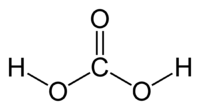
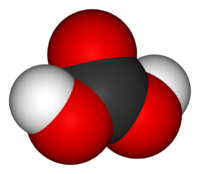
У́гольная кислота́ (химическая формула — H2CO3) — слабая химическая неорганическая кислота. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха.
При нормальных условиях, угольная кислота неустойчива и разлагается на углекислый газ и воду. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства[править | править код]
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём при нормальных условиях равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp2-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Химические свойства[править | править код]
Равновесие в водных растворах и кислотность[править | править код]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
, константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
, константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
, константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
, где C₀ = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править | править код]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями[править | править код]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
(конц.)
(разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение[править | править код]
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение[править | править код]
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. «Газированная вода»).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные[править | править код]
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Примечания[править | править код]
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература[править | править код]
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
Molar mass of H2CO3 = 62.02478 g/mol
This compound is also known as Carbonic Acid.
Convert grams H2CO3 to moles
or
moles H2CO3 to grams
Molecular weight calculation:
1.00794*2 + 12.0107 + 15.9994*3
Percent composition by element
Element: Hydrogen
Symbol: H
Atomic Mass: 1.00794
# of Atoms: 2
Mass Percent: 3.250%
Element: Carbon
Symbol: C
Atomic Mass: 12.0107
# of Atoms: 1
Mass Percent: 19.364%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 3
Mass Percent: 77.386%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
H2CO3
H2Co3
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
👋 Привет Лёва
Середнячок
40/250
Задать вопрос

kkhabibulaeva
+10
Решено
7 лет назад
Химия
5 – 9 классы
Найдите молекулярную массу H2CO3
Смотреть ответ
2
Комментарии

kkhabibulaeva
Подробнее

Ответ проверен экспертом
5
(1 оценка)
6
тайная
7 лет назад
Светило науки – 13909 ответов – 129213 раз оказано помощи
Mr(H₂CO₃) = 1·2 +12 +16·3 = 62
(1 оценка)
Ответ
3
(2 оценки)
5
Сашуька2002
7 лет назад
Светило науки – 3 ответа – 0 раз оказано помощи
M(H2CO3)=2+12+48=62 молекулярна маса
(2 оценки)
https://vashotvet.com/task/8355467
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
62.0248 g/mol
The molar mass and molecular weight of H2CO3 is 62.025.
| Element | Symbol | Atomic Mass | # of Atoms | Mass Percent |
|---|---|---|---|---|
| Hydrogen | H | 2.0159 g/mol | 2 | 3.2501% |
| Carbon | C | 12.0107 g/mol | 1 | 19.3644% |
| Oxygen | O | 47.9982 g/mol | 3 | 77.3855% |
Carbonic Acid Element Mass PercentOxygen47.9982gOxygen47.9982gCarbon12.0107gCarbon12.0107gHydrogen2.0159gHydrogen2.0159g
H2CO3 # of AtomsOxygen3Oxygen3Hydrogen2Hydrogen2Carbon1Carbon1
Finding Molar Mass
Read our article on how to calculate molar mass.
You can also ask for help in our chat or forums.
Find the Molar Mass of Carbonic Acid, H2CO3 Step-by-Step
There are 4 easy steps to find the molar mass of H2CO3 based on its chemical formula.
1. Count The Number of Each Atom
The first step to finding the molar mass of Carbonic Acid is to count the number of each atom present in a single molecule using the chemical formula, H2CO3:
| Element | Number of Atoms |
|---|---|
| H (Hydrogen) | 2 |
| C (Carbon) | 1 |
| O (Oxygen) | 3 |
2. Find Atomic Mass of Each Element
Next, using the periodic table, find the atomic mass in g/mol of each element (the molar mass of an element is equal to its atomic mass):
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 1.00794 |
| C (Carbon) | 12.0107 |
| O (Oxygen) | 15.9994 |
3. Compute Mass of Each Element
Multiply the number of atoms by the atomic weight of each element found in steps 1 and 2 to get the mass of each element in H2CO3:
| Molar Mass (g/mol) | |
|---|---|
| H (Hydrogen) | 2 × 1.00794 = 2.01588 |
| C (Carbon) | 1 × 12.0107 = 12.0107 |
| O (Oxygen) | 3 × 15.9994 = 47.9982 |
4. Sum Each Element’s Mass
Finally, add together the total mass of each element to get the molar mass of H2CO3:
2.01588 g/mol + 12.0107 g/mol + 47.9982 g/mol = 62.02478 g/mol


![{displaystyle K_{p}={frac {mathsf {[H_{2}CO_{3}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=1{,}70cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d37e7cded585ef31bd6c1e0bffe2059cb4c31301)


![{displaystyle K_{a1}={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[H_{2}CO_{3}]}}}=2{,}5cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60b755cc59015e8c81c7ef9c5ae032be5d82f54d)
![{displaystyle K_{a}'={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=4{,}27cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a59a9846bcab31633f769c9446951defde2b6250)

![{displaystyle K_{a2}={frac {mathsf {[CO_{3}^{2-}]cdot [H_{3}O^{+}]}}{mathsf {[HCO_{3}^{-}]}}}=4{,}68cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92eeeb8da9932abda580009c8475b23d9108b697)
















