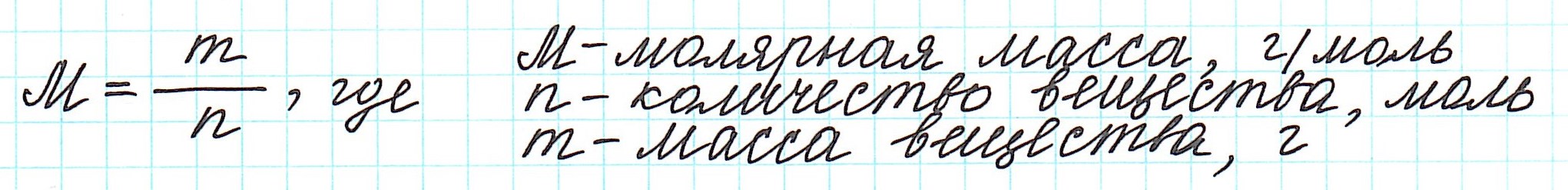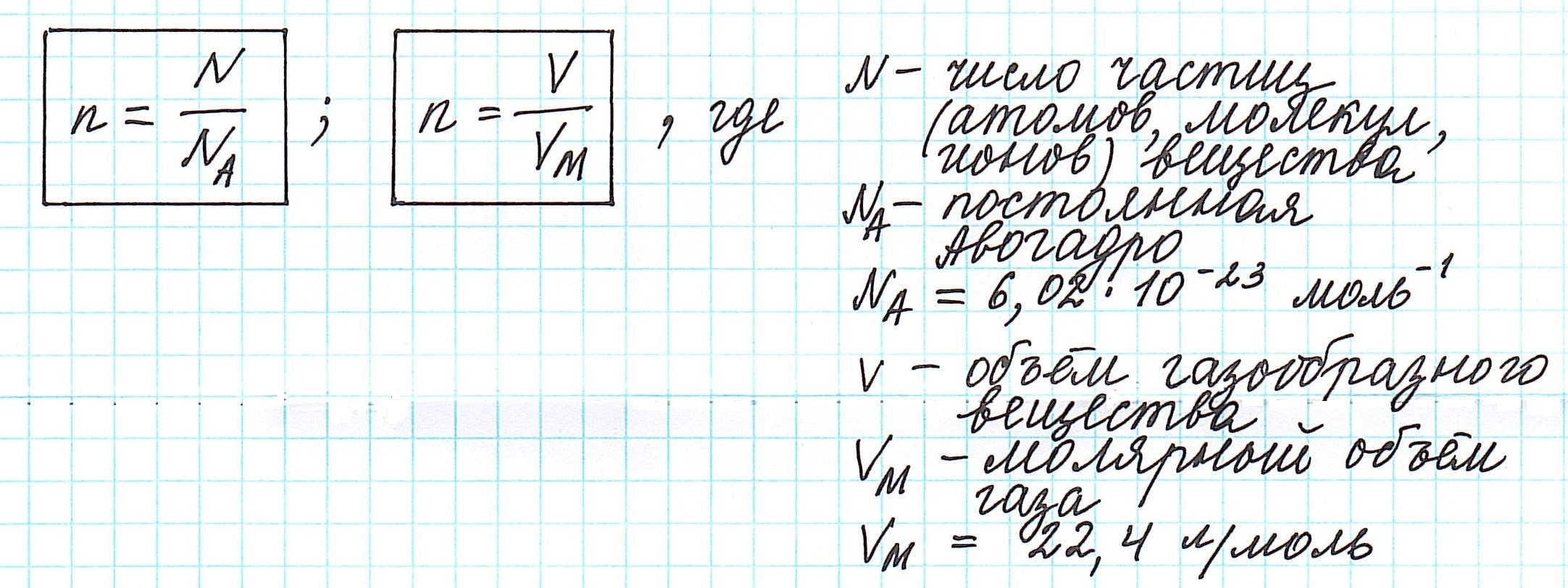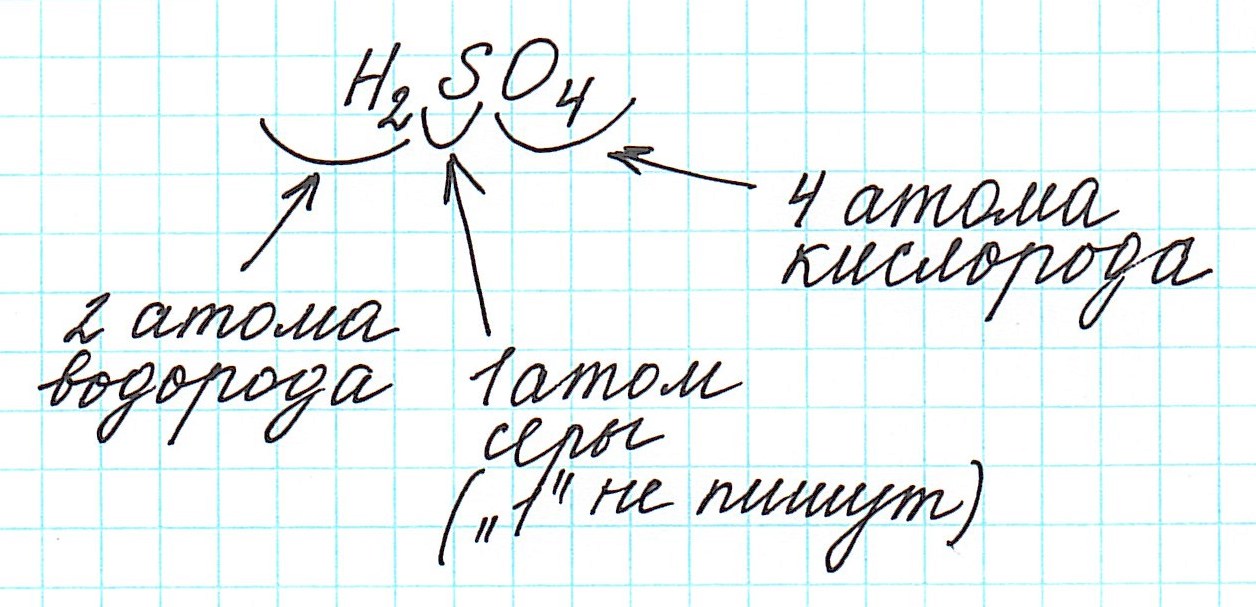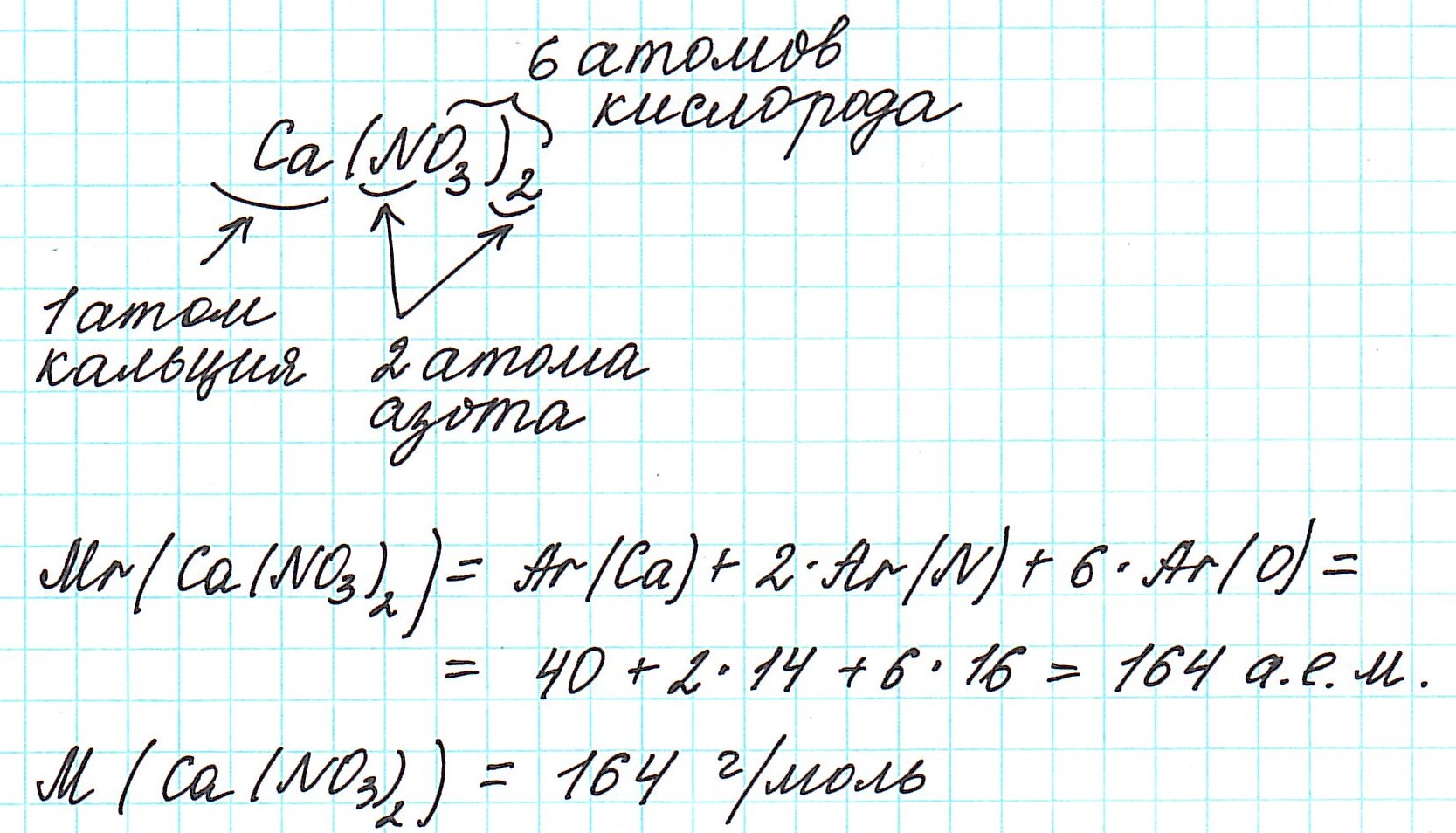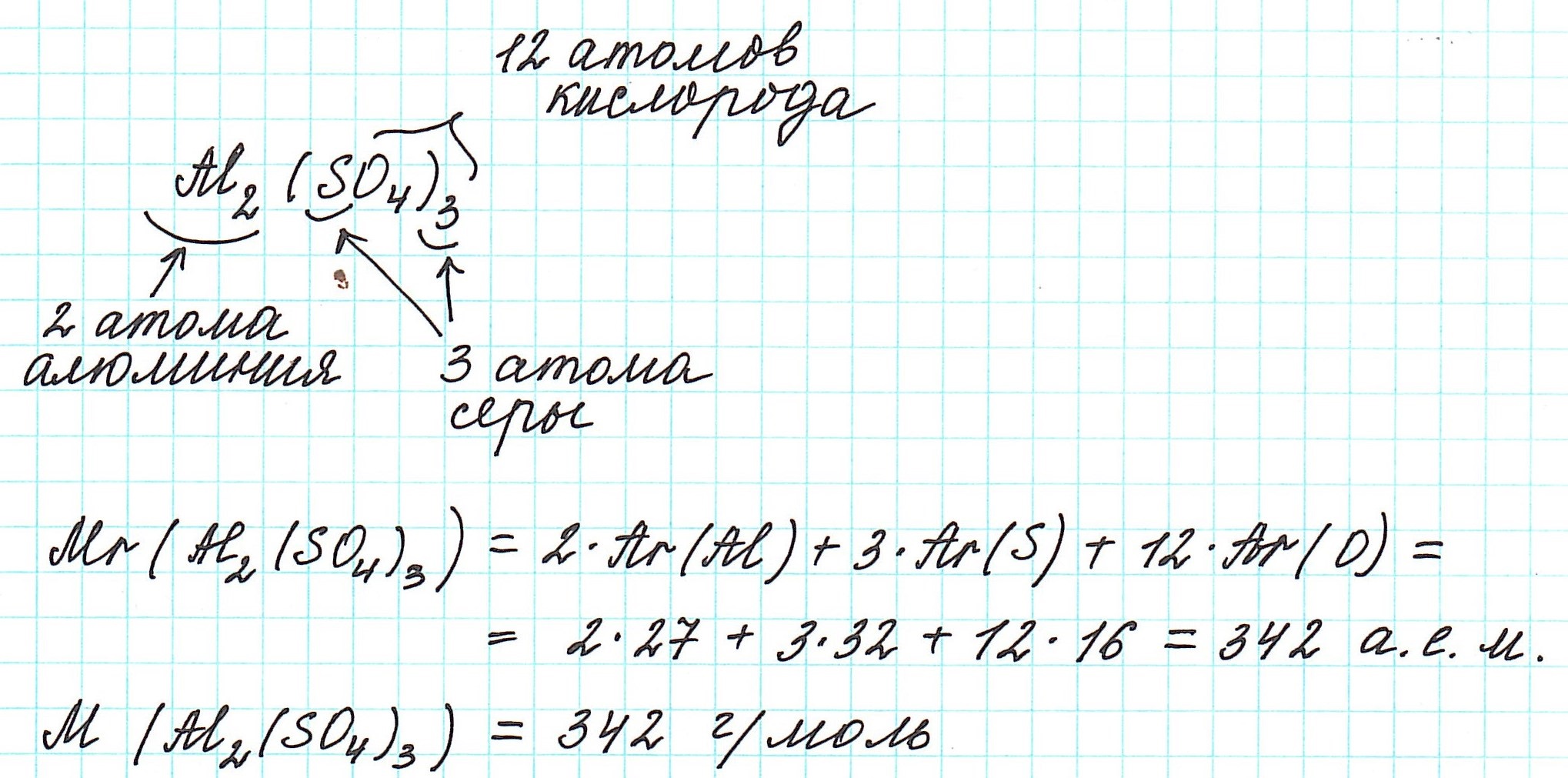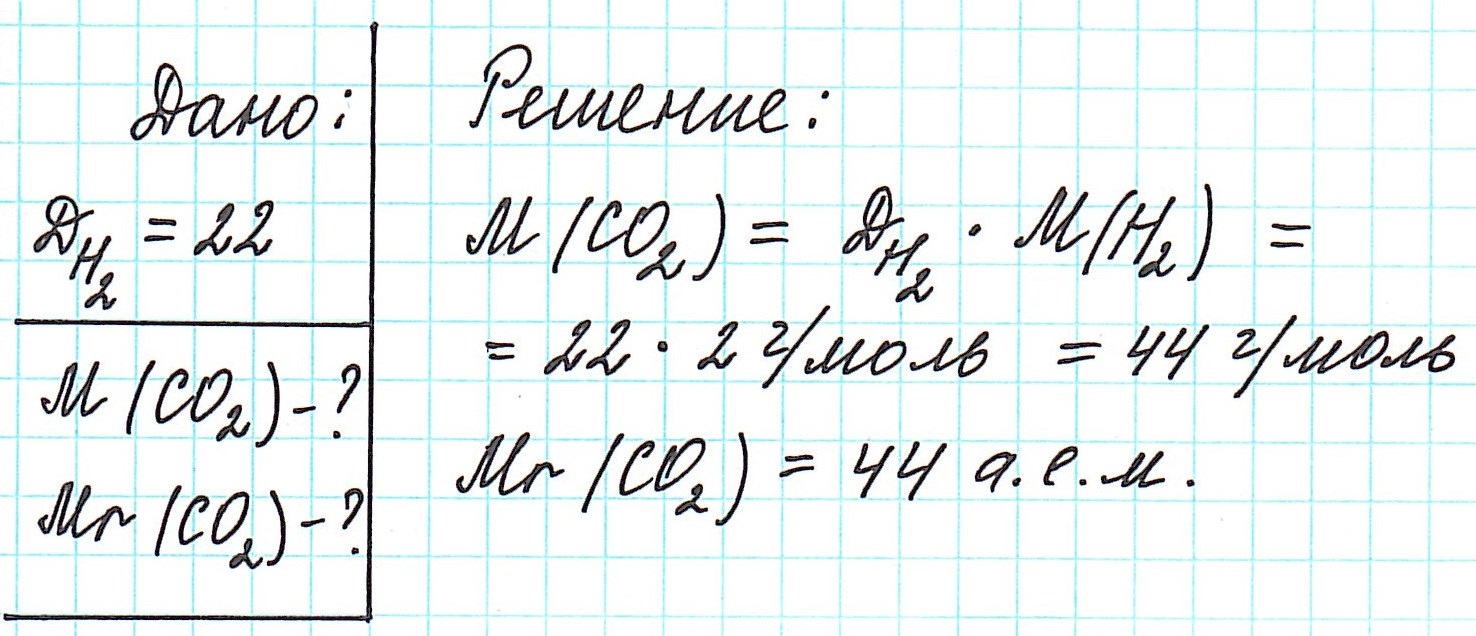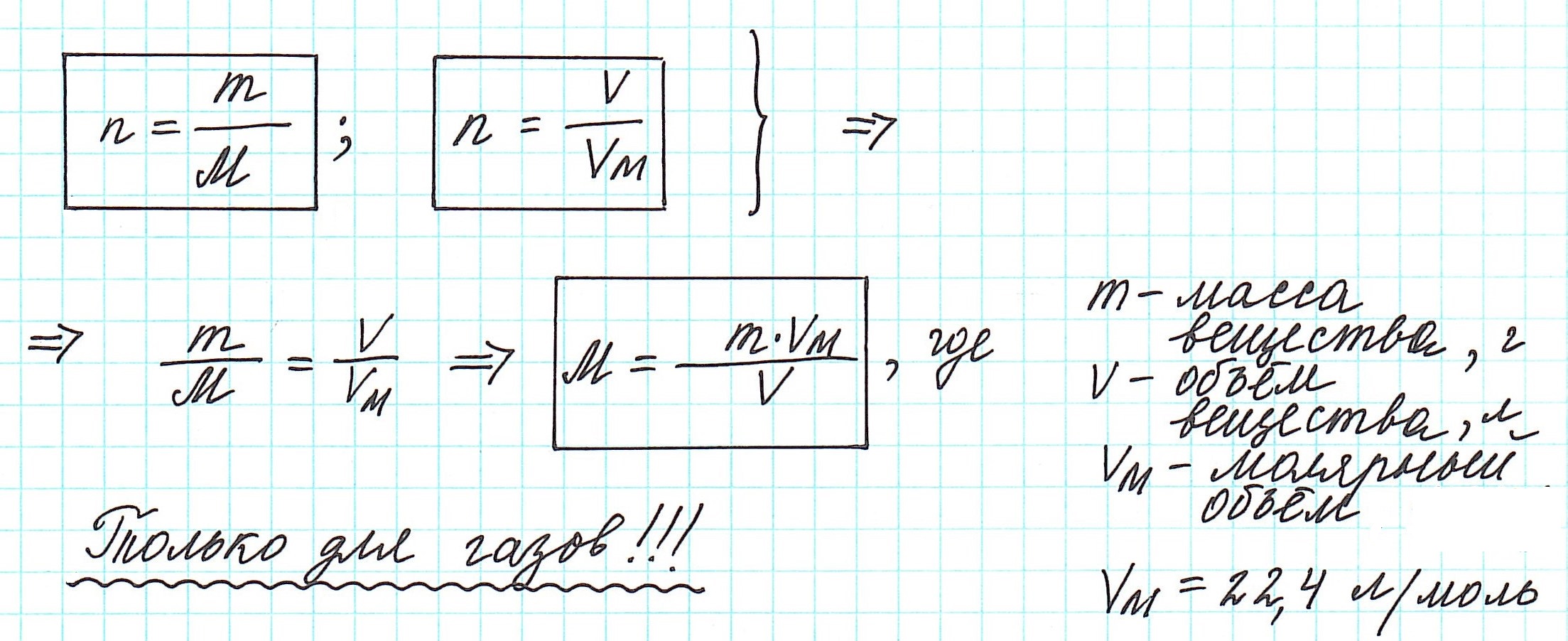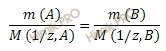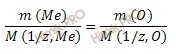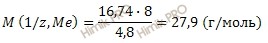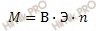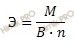Содержание
- МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
- Относительная атомная масса
- Величина, с которой сравнивают массу атома
- Почему атомная масса дробная?
- Относительная молекулярная масса
- Количество вещества и молярная масса
- Почему же относительная молекулярная и молярная массы равны?
- Как вычислить молярную массу вещества
- Как вычислить молярную массу вещества, находящегося в газообразном состоянии
- Химик.ПРО – решение задач по химии бесплатно
- Ответ:
- ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА
МОЛЯРНАЯ МАССА И ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА: В ЧЕМ ОТЛИЧИЕ И ПОЧЕМУ ОНИ ЧИСЛЕННО РАВНЫ
Как вычислить молярную массу вещества? В каких единицах она измеряется?
А еще есть относительная молекулярная масса. Почему она относительная и численно равна молярной массе? Может быть это одно и то же?
Вот сколько вопросов возникает сразу в отношении такого простого на первый взгляд понятия, как молярная масса.
Разберемся по порядку и научимся ее определять.
Относительная атомная масса
Огромнейший вклад в развитие и обоснование понятия относительная атомная масса внесли в разное время французский ученый Гей-Люссак, итальянский ученый А.Авогадро и шведский ученый Й.Я. Берцелиус.
Не углубляясь в историю вопроса, вспомним, что любой химический элемент представляет собой определенную разновидность атомов. Сегодня мы знаем, что атомы химических элементов имеют свои особые характеристики.
И самая главная из них, определяющая практически все остальные, это заряд ядра. А так как заряд ядра обусловлен присутствием в нем протонов, а заряд одного протона равен +1, то и количество протонов, соответственно, также является важнейшей характеристикой атомов химических элементов.
Основную массу атома составляет ядро, которое кроме протонов содержит еще и нейтроны. Масса последних сопоставима с массой первых. Оболочку атома составляют электроны.
По числу частиц в атоме, а точнее, по их суммарной массе, атомы химических элементов можно условно разделить на тяжелые и легкие. Например, легким элементом является водород, так как его атомы имеют самую маленькую массу. А свинец — это уже тяжелый элемент. Масса его атома в 302 раза тяжелее массы атома водорода.
Но тем не менее, как бы мы не делили все атомы на тяжелые или легкие, абсолютная масса (mA) каждого из них ничтожно мала, как мала и масса составляющих их частиц. Например,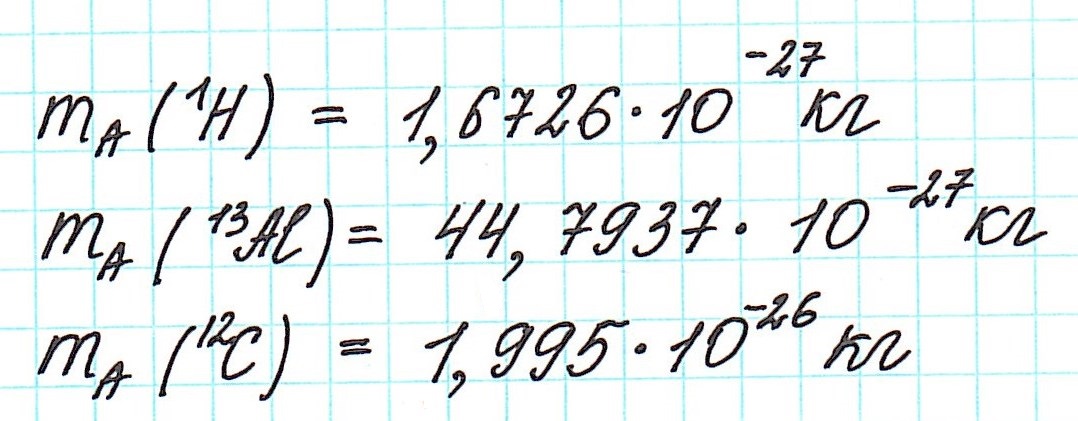
Величина, с которой сравнивают массу атома
Первоначально еще Дальтон сравнивал массы атомов с массой атома водорода, как самого легкого. Позднее появилась так называемая кислородная единица, равная 1/16 части массы атома кислорода. К ней перешли потому, что большинство атомов химических элементов образуют соединения с кислородом.
Однако, с развитием атомной физики и эта единица стала крайне неудобной. Все потому, что кислород в природе имеет несколько изотопов (а именно 3 устойчивых, всего же их 16). А изотопы, как известно, отличаются своей атомной массой. Из-за большого разнообразия изотопов и их различной устойчивости кислородная единица утратила свою актуальность.
В настоящее время (с 1961 года) общепринятой является углеродная единица , так называемая атомная единица массы (сокращенно а.е.м.). Она равна 1/12 части массы атома углерода (изотопа 12 С).
Почему именно углерод? Да потому, что:
— у углерода всего 2 изотопа: 12 С и 13 С; причем первого 98,9%;
— количество органических веществ (их основу составляет, как известно, именно углерод) в сотни раз больше, чем неорганических;
— при переходе от кислородной единицы к углеродной уже посчитанные относительные атомные массы всех элементов изменились не существенно, что оказалось очень удобным.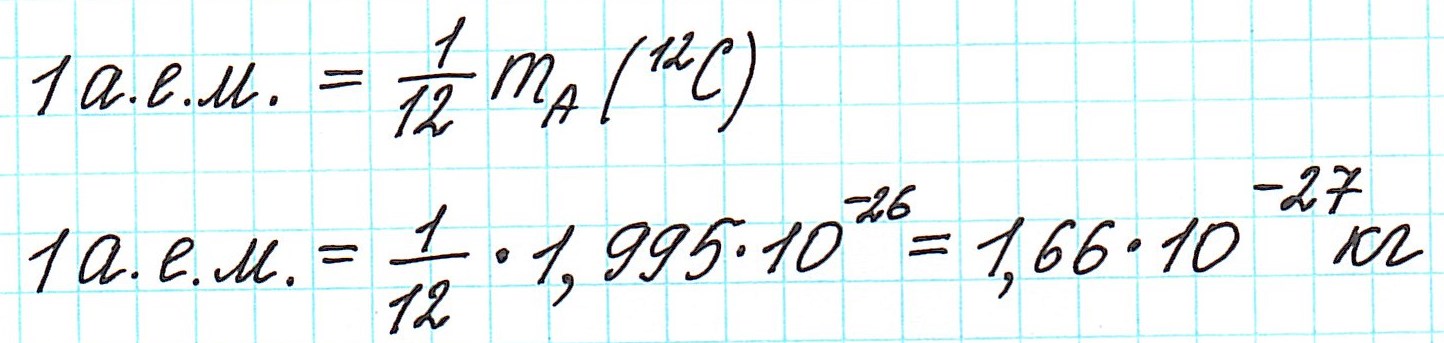
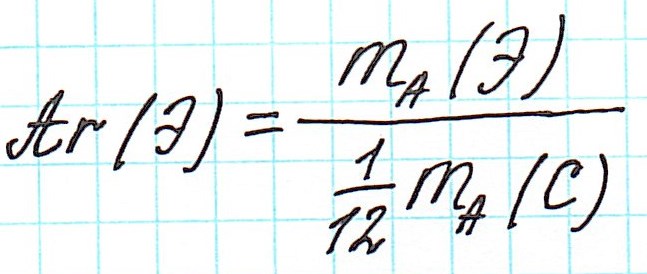
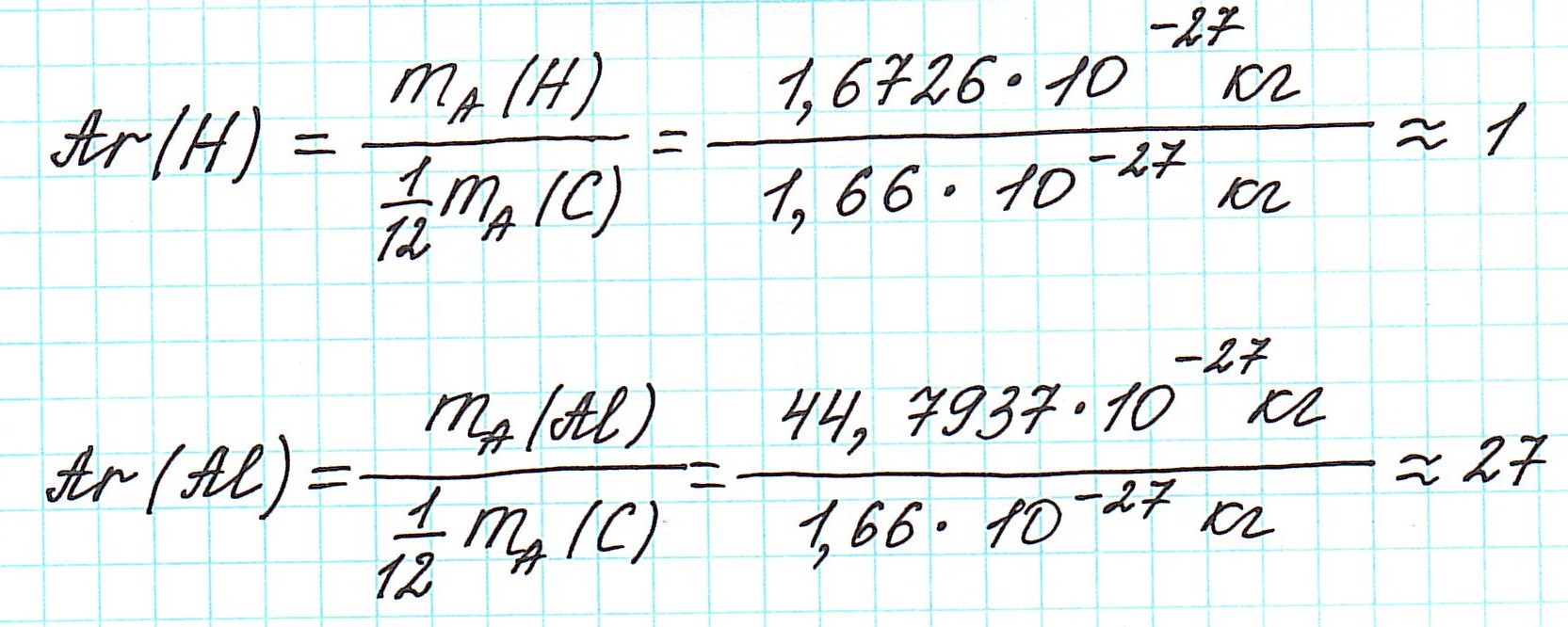
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16 О, на 0,04% из изотопа 17 О и на 0,20% из изотопа 18 О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Относительная молекулярная масса
А как же найти относительную молекулярную массу?
Здесь не все так просто. Понятие «относительная молекулярная масса» не всегда применяется корректно. Правильнее было бы говорить о «формульной массе» .
Дело в том, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2SO4, глюкоза C6H12O6 и т.д. И к ним в полной мере можно применить термин «относительная молекулярная масса».
Так как молекулы состоят из атомов, то относительная молекулярная масса (Mr) будет складываться из их относительных атомных масс. Например: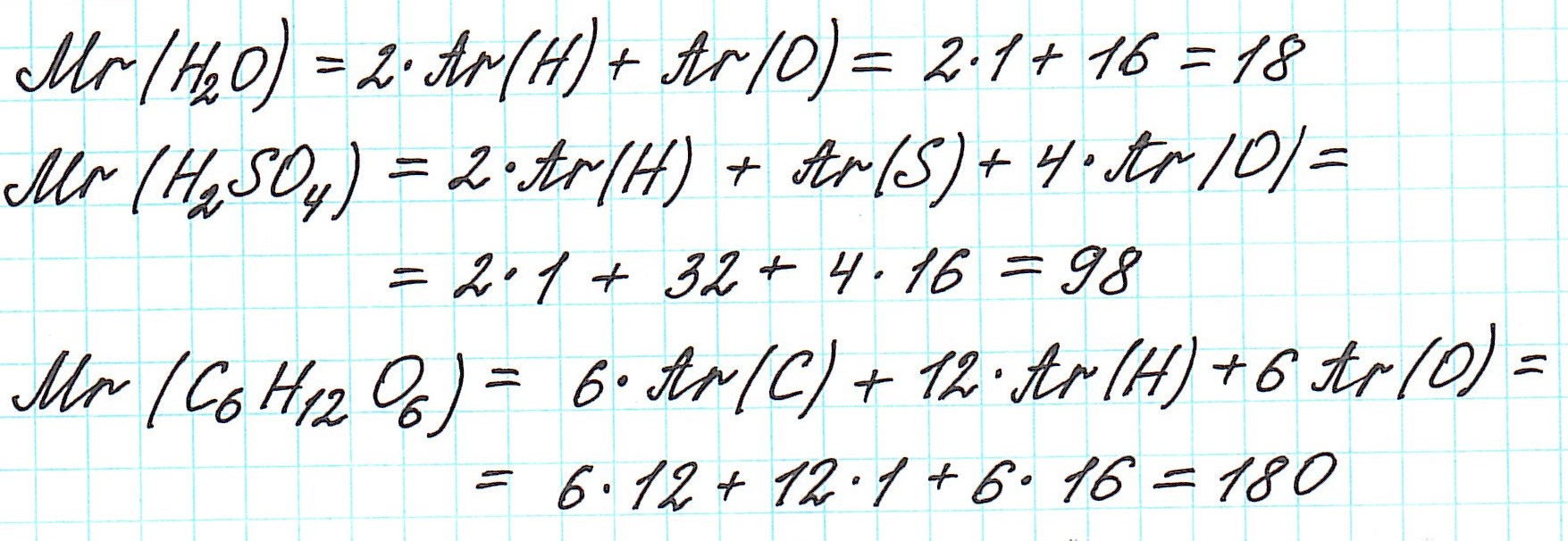
Например, формула NaCl показывает, что в кристалле хлорида натрия на один ион натрия Na + приходится один ион хлора Cl — . На самом деле формула хлорида натрия должна выглядеть так: Na∞Cl∞. Поэтому запомним, что к ионным соединениям термины «молекула» и «молекулярная масса» не применимы.
В связи с этим для подобных веществ вычисляется формульная масса . А вычисляется она все по тому же принципу, что и молекулярная масса. Обозначается так же — Mr. Например, для хлорида натрия:
Точно так же, как относительную атомную массу (Ar), относительную молекулярную массу (Mr) будем сопоставлять с 1/12 частью атома изотопа углерода 12 С.
В последующем говорим о Mr.
Количество вещества и молярная масса
В практических расчетах все-таки требуется вычислять массы, взятые в граммах, килограммах ато и в тоннах (если речь идет о каком-то производстве, например).
Как же поступают тогда?
Введена новая и тоже относительная величина – моль .
Точно было посчитано, что определенное количество атомов изотопа углерода 12 С, а именно 6,02·10 23 , имеют массу ровно 12 г. Обратите внимание, что относительная молекулярная масса для этого же изотопа равна 12, но не грамм!
Количество вещества, которое содержит столько же частиц (атомов, ионов, молекул – в зависимости от строения), что и 12 г изотопа углерода 12 С, назвали молем.
Один моль вещества (любого!) всегда содержит 6,02·10 23 его частиц ( постоянная Авогадро ).
Ну, а так как атомы элементов отличаются по своей массе, то и 1 моль вещества тоже будет отличаться по массе.
Массу одного моля вещества называют молярной массой (М) и вычисляют в г/моль.
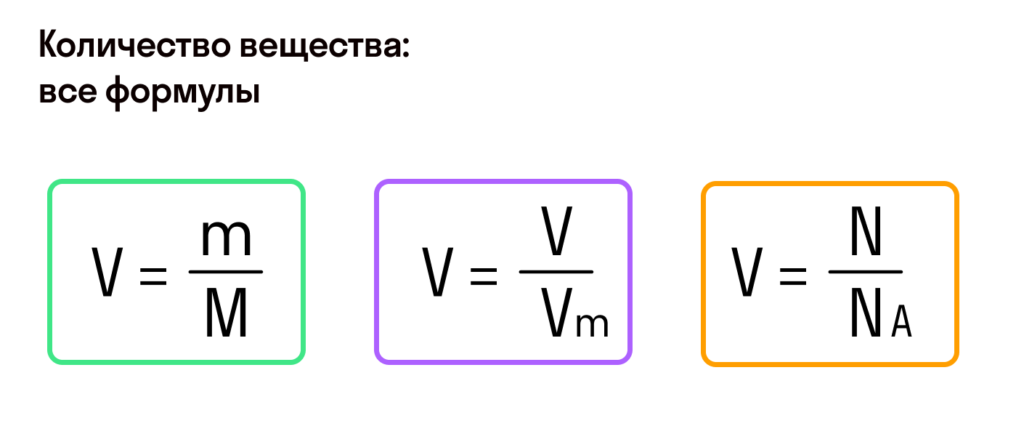
Таким образом, молярная масса и количество вещества связаны соотношением:
Можно также определить и такие отношения, связанные с количеством вещества:
Почему же относительная молекулярная и молярная массы равны?
Итак, относительная молекулярная и молярная массы, как следует из их определений – это не одно и то же.
Докажем, каким образом обе массы численно могут быть равны:
Как вычислить молярную массу вещества
Мы уже знаем, что относительная молекулярная масса складывается из относительных атомных масс.
При нахождении относительной молекулярной массы (Mr), а значит и молярной (М), выполняем следующие действия :
1) правильно записываем формулу вещества;
2) анализируем качественный состав (атомы каких элементов составляют вещество) и количественный состав (в каких количествах находятся эти атомы – смотрим по индексам, которые стоят справа внизу от знака химического элемента);
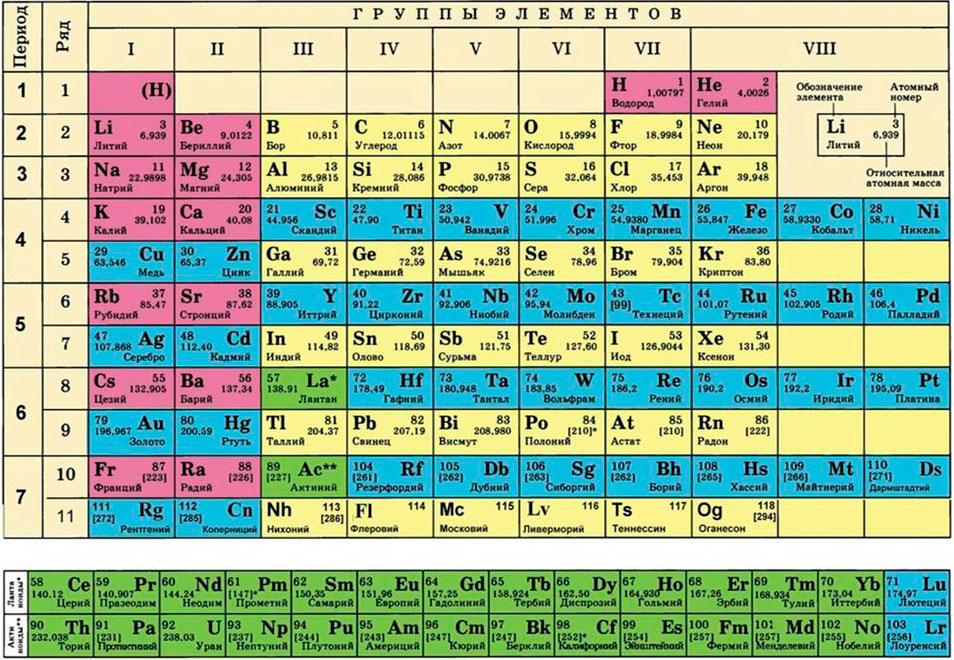
3) в периодической системе химических элементов находим элементы, атомы которых составляют вещество, и округляем относительную атомную массу, стоящую рядом со знаком элемента, до целого числа (! у хлора – до 35,5);
4) складываем относительные атомные массы всех элементов с учетом количества атомов.
Рассмотрим еще примеры:
Как вычислить молярную массу вещества, находящегося в газообразном состоянии
Определить молекулярную (а значит и молярную) массу газообразного вещества можно, используя закон Авогадро . Он гласит, что в равных объемах газов, взятых при одинаковой температуре, а также одинаковом давлении, содержится равное число молекул.
Это означает, что в данных условиях отношение масс газов друг к другу является отношением их молярных масс:


Запомните, что средняя молярная масса воздуха равна 29 г/моль .
Вычислить молярную массу вещества (а, значит, и относительную молекулярную), находящегося в газообразном состоянии, можно, используя молярный объем газа (VM):
Итак, подведем итог:
- Относительная молекулярная масса (Mr) показывает отношение массы молекулы к 1/12 части массы атома изотопа углерода 12 С.
- Молярная масса (М) – масса одного моля вещества, равная отношению массы вещества к его количеству и выраженная в г/моль.
- Относительная молекулярная и молярная массы численно равны.
- Вычислить молярную массу вещества (и относительную молекулярную также) можно, используя значения относительных атомных масс, записанных в периодической системе.
Без вычисления молярной массы не обходится решение практически ни одной задачи. Если вы поняли, что такое молярная и относительная молекулярная массы и как их вычислять, но еще не умеете решать задачи с их применением, то самое время научиться.
Разбор простых типовых задач по химии в книге, которую вы можете совершенно БЕСПЛАТНО скачать здесь.
Источник
Химик.ПРО – решение задач по химии бесплатно
При окислении 16,74 грамм двухвалентного металла образовалась 21,54 грамма оксида. Вычислите молярную массу эквивалента металла и его оксида. Чему равна атомная масса металла?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
По условию задачи оксид образован двухвалентным металлом, следовательно, формулу запишем так MeO.
Исходя из массы оксида металла и массы металла, определим массу кислорода по формуле:
m (O) = m (MeO) – m (Me)
m (O) = 21,54 – 16,74 = 4,8 (г).
Закон эквивалентов в данном случае имеет вид:
Из уравнения находим молярную массу эквивалента металла:
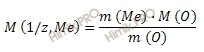
Рассчитаем молярную массу металла по формуле:
М – молярная масса,
Э – эквивалентная масса
n – число атомов элемента в соединении.
M (Мe) = 2 ∙ 27,9 = 55,8 (г/моль).
Напомню, что молярная масса вещества, имеющего атомную или металлическую структуру, численно равна относительной атомной массе.
Следовательно, атомная масса металла равна 55,8 г/моль. А металл – железо (Fe).
Учитывая, что молярная масса оксида железа (FeO) равна 71,8 г/моль, найдем молярную массу эквивалента оксида железа (FeO) рассчитаем по формуле:
Э (FeO) = 71,8/2 = 35,9 (г/моль).
Ответ:
молярная масса эквивалента металла равна 27,9 г/моль;
атомная масса металла равна 55,8 г/моль;
молярная масса эквивалента оксида равна 35,9 г/моль.
Источник
Цель работы: усвоить понятия химического эквивалента, молярной массы эквивалента, закона эквивалентов; ознакомиться с экспериментальным определением молярной массы эквивалента металла методом вытеснения водорода из кислоты.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Известно, что количество вещества определяется числом структурных единиц (атомов, молекул, ионов) этого вещества и выражается в молях.
Моль (n) – это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 0,012 кг углерода, состоящего только из изотопа 12 С.
Молярная масса (М) вещества представляет собой отношение массы вещества (m) к его количеству (n), а значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента, но измеряется в г/моль.
Эквивалентом вещества (nэ),вступающего в какую-либо реакцию, называют такое его количество, которое приходится на единицу валентности соответствующего элемента при образовании им соединения.
Химический эквивалент и молярная масса эквивалента представляют собой важнейшие характеристики элементов, простых и сложных веществ, учитывая то, что согласно закону эквивалентов все вещества взаимодействуют между собой в эквивалентных количествах.
Единицей химического эквивалента (nэ), так же как и количества вещества является моль, а молярная масса эквивалента (Мэ), соответственно измеряется в г/моль.
Так, водород в своих соединениях, как правило, одновалентен, и его эквивалент равен 1 моль Н или 1/2 моль Н2, а молярная масса его эквивалента Мэ(Н) = 1 г/моль.
Кислород в своих соединениях двухвалентен, тогда его эквивалент равен 1/2 моль О или 1/4 моль О2, а молярная масса его эквивалента Мэ(О) = 8 г/моль.
Железо в своих соединениях может быть и двух-, и трехвалентным, тогда его эквивалент в первом случае будет равен 1/2 моль Fe, а молярная масса эквивалента Мэ(Fe) = 28 г/моль. Эквивалент железа во втором случае будет равен 1/3 моль Fe, а молярная масса эквивалента Мэ(Fe) = 18,6 г/моль. Следовательно, молярную массу эквивалента простого вещества можно рассчитать по формуле:

где М(эл-та) – молярная масса элемента;
В(эл-та) – валентность элемента.
Молярные массы эквивалентов сложных веществ (оксидов, кислот, оснований, солей) рассчитываются несколько иначе.
Молярная масса эквивалента оксида рассчитывается отношением молярной массы оксида к произведению числа атомов элемента на его валентность.

где М(оксида) – молярная масса оксида;
n(эл-та) – число атомов элемента;
В(эл-та) – валентность элемента.
Для оксида железа (Ш), например, молярная масса его будет равна:
Молярная масса эквивалента кислоты рассчитывается отношением молярной массы кислоты к числу атомов водорода в кислоте, способных замещаться в химических реакциях.

где М (кислоты) – молярная масса кислоты;
n (H) – число замещающихся в химической реакции атомов водорода.
Для серной кислоты (H2SO4), например, молярная масса эквивалента будет равна:
Молярная масса эквивалента основания рассчитывается отношением молярной массы основания к числу гидроксогрупп.

где М (основания) – молярная масса основания;
n (OH) – число гидроксогрупп.
Для гидроксида кальция (Ca(OH)2), например, молярная масса эквивалента будет равна:
Молярная масса эквивалента соли рассчитывается отношением молярной массы соли к произведению числа атомов металла на их валентность.

где М (соли) – молярная масса соли;
n (Ме) – число атомов металла;
В (Ме) – валентность металла.
Для сульфата натрия (Na2SO4), например, молярная масса эквивалента будет равна:
Из закона эквивалентов следует, что массы вступающих и образующихся в результате реакции веществ прямопропорциональны молярным массам их эквивалентов:

где m(1) и Мэ(1) – масса и молярная масса эквивалента первого вещества;
m(2) и Мэ(2) – масса и молярная масса эквивалента второго вещества.
Из следствия из закона Авогадро вытекает понятие молярный объем — объем, который занимает 1 моль любого газа при нормальных условиях, т.е. при р = 10 5 Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0 о С). Значение этого объема равно 22,4 л/моль (22400 мл/моль). Отсюда можно вывести понятие и молярного объема эквивалента газа (или эквивалентного объема) – объема, занимаемого при нормальных условиях одним эквивалентом (одной молярной массой эквивалента) газа.
Известно, что эквивалент водорода равен 1/2 моль Н2, тогда молярный объем эквивалента водорода Vэ(Н2) = 11,2 л/моль; соответственно Vэ(О2) = 5,6 л/моль, т.к. эквивалент кислорода равен 1/4 моль О2.
Если же в реакции участвуют газы и известны их объемы, то соотношение (2) можно представить следующим образом:

где m(1) и Мэ(1) – масса и молярная масса эквивалента первого вещества;
V(2) и Vэ(2) – объем и молярный объем эквивалента второго вещества.
Следует иметь ввиду, что объемы, входящие в соотношение (3), нужно приводить к нормальным условиям по формуле объединенного закона Гей-Люссака – Бойля –Мариотта:


где р, V, Т – давление, объем и температура газа при условиях опыта;
ро, Vо, То – давление, объем и температура газа при нормальных условиях.
Известны методы экспериментального определения молярных масс эквивалентов: 1) метод прямого определения – молярную массу эквивалента определяют по данным прямого синтеза кислородного или водородного соединения данного элемента; 2) аналитический метод – производится точный анализ соединения данного элемента с любым другим, молярная масса эквивалента которого известна; 3) метод вытеснения водорода — используется для определения молярной массы эквивалента тех металлов, которые способны вытеснить водород из разбавленных кислот и щелочей; 4) электрохимический метод – определяется масса металла, осаждающегося на электроде при электролизе раствора соли этого металла. Молярная масса эквивалента рассчитывается по закону Фарадея: при прохождении через раствор или расплав электролита 965000 Кулонов электричества на электродах выделяется по одному эквиваленту вещества.
Сущность экспериментального определения молярной массы эквивалента металла заключается в определении объема водорода (приведенного к нормальным условиям), вытесняемого из кислоты навеской металла, взятой на аналитических весах.
Произведением молярной массы эквивалента металла на его валентность определяют молярную массу атома металла.
По молярной массе атома металла и его валентности находят местоположение металла в периодической системе элементов Д.И.Менделеева, т.е. его название.
По указанию преподавателя студент взвешивает на аналитических весах навеску металла известной валентности.
Прибор для определения молярной массы эквивалента изображен на рисунке.

Убедившись в герметичности прибора, отсоединяют пробирку А от прибора и, записав начальный уровень воды в бюретке В, наливают в пробирку А 1/4 ее объема соляной кислоты, приготовленной для определения молярной массы эквивалента металла соответствующей валентности.
Держа пробирку А в положении, близком к горизонтальному, помещают на сухое место у отверстия пробирки взвешенный металл и в таком положении соединяют пробирку А с бюреткой В, следя за тем, чтобы металл не упал в кислоту.
Убедившись вторично в герметичности прибора путем поднятия воронки С вверх, стряхивают металл в кислоту и наблюдают за ходом реакции.
По окончании реакции (прекращение выделения пузырьков водорода), устанавливают уровень воды в бюретке В и воронке С на одной высоте, перемещая кольцо К с воронкой С вниз по штативу, и записывают уровень воды в бюретке В после окончания опыта. Шкала бюретки В проградуирована в миллилитрах (мл).
С помощью барометра определяют величину атмосферного давления ( ратм ), термометра – температуру ( t ) воздуха в помещении (соответственно и температуру воды в приборе) в момент проведения опыта.
С помощью таблицы 1 определяют давление водяного пара ( рН2Опар ), соответствующего измеренной температуре опыта, в мм рт.ст.
Зависимость давления водяного пара от температуры
| t , о С | |||||||||||
| рН2Опар | 12,8 | 13,6 | 14,5 | 15,5 | 16,5 | 17,5 | 18,7 | 19,8 | 21,1 | 22,4 | 23,8 |
1. Определите объем выделившегося водорода в результате опыта. Для этого от значения уровня воды в бюретке В после окончания опыта ( V2 ) следует вычесть значение уровня воды в бюретке В в начале опыта ( V1 ).
Переведите значение объема выделившегося в результате опыта водорода в кубические дециметры, учитывая, что 1 см 3 = 10 –3 дм 3 .
2. Приведите экспериментальный объем выделившегося водорода к нормальным условиям, воспользовавшись формулой 4. Следует учесть, что давление внутри бюретки В складывается из давления водорода и давления водяного пара внутри объема бюретки при данной температуре:
где ратм – измеренное атмосферное давление во время проведения опыта;
рН2Опар – давление водяного пара при температуре опыта;
V (Н2) – экспериментальный объем водорода;
Т – температура проведения опыта (К), равная (273+t);
ро, То – давление и температура при нормальных условиях.
3. Вычислите молярную массу эквивалента металла, с точностью до 0,1 г/моль, воспользовавшись формулой 3:
4. Воспользовавшись формулой 1, рассчитайте молярную массу металла и укажите какой это металл.
Результаты эксперимента представьте в виде таблицы 2.
| масса металла, г и (В) | pатм, мм рт.ст. | t, 0 C | V1,, мл | V2, мл | V(H2), л | pH2Oпар, мм рт.ст. | V(H2), л | Мэ (Ме), г/моль | М (Ме), г/моль |
5. Вычислите величины абсолютной и относительной ошибок (DХ).
DХабс. = М (Ме) табличное – М (Ме) экпериментальное
Вопросы для самоконтроля
1. Что называется эквивалентом вещества?
2. Что является единицей эквивалента вещества?
3. Какую размерность имеет молярная масса эквивалента вещества?
4. Какие значения имеют молярные массы эквивалентов водорода и кислорода?
5. Как можно рассчитать молярную массу эквивалента элемента?
6. Что такое молярный объем и молярный объем эквивалента?
7. Какие значения имеют молярные объемы эквивалентов водорода и кислорода?
8. Как формулируется закон эквивалентов?
9. Почему при выполнении расчетов в экспериментальной части работы нужно знать давление водяного пара?
10. Какие Вы знаете методы экспериментального определения молярной массы эквивалента металлов?
1. Медь с кислородом образует два соединения, в которых содержится 79,9 % меди и 20,1 % кислорода, и 88,8 % меди и 11,2 % кислорода. Определите молярные массы эквивалентов меди в этих соединениях и составьте формулы этих соединений.
2. При сгорании 3 г магния образовалось 5 г оксида магния. Рассчитайте молярную массу эквивалента магния.
3. При взаимодействии 2,4 г углерода с кислородом образовалось 5,6 г оксида. Определите молярную массу эквивалента углерода в этом соединении и напишите уравнение реакции.
4. При взаимодействии 4 г двухвалентного металла с кислородом образовалось 5,6 г оксида. Определите, какой это металл и напишите уравнение реакции.
5. При растворении в соляной кислоте 5,4 г трехвалентного металла выделилось 6,72 л водорода, измеренного при н.у. Определите, какой это металл и напишите уравнение реакции.
6. При взаимодействии одновалентного металла с 0,2 г водорода образовалось 4,8 г гидрида металла. Определите, какой это металл и напишите уравнение этой реакции.
7. При окислении 8 г металла, проявляющего валентность, равную I, получено 9 г оксида. Определите, какой это металл и напишите уравнение данной реакции.
8. Рассчитайте объем водорода, выделившегося при растворении в соляной кислоте 18 г металла, молярная масса эквивалента которого равна 9 г/моль.
9. При взаимодействии 0,9 г трехвалентного металла с серой образовалось 2,5 г сульфида металла. Определите, какой это металл, учитывая, что молярная масса эквивалента серы в этом соединении 16 г/моль. Напишите уравнение соответствующей реакции.
10. При окислении 6,4 г серы образовалось 16 г оксида. Определите молярную массу эквивалента серы в этом соединении и напишите уравнение соответствующей реакции.
Источник
Определение молярной массы эквивалента металла
Цель работы: усвоить
понятия химического эквивалента,
молярной массы эквивалента, закона
эквивалентов; ознакомиться с
экспериментальным определением молярной
массы эквивалента металла методом
вытеснения водорода из кислоты.
Теоретическая часть
Известно,
что количество вещества определяется
числом структурных единиц (атомов,
молекул, ионов) этого вещества и выражается
в молях.
Моль ()– это единица количества вещества,
содержащая столько же структурных
единиц данного вещества, сколько атомов
содержится в 0,012 кг углерода, состоящего
только из изотопа12С.
Молярная
масса (М) вещества
представляет собой отношение массы
вещества (m) к его количеству (),
а значение молярной массы численно
совпадает с относительной молекулярной
массой вещества или относительной
атомной массой элемента, но измеряется
в г/моль.
Эквивалентом
вещества (э),
вступающего в какую-либо реакцию,
называют такое его количество, которое
приходится на единицу валентности
соответствующего элемента при образовании
им соединения.
Химический
эквивалент и молярная масса эквивалента
представляют собой важнейшие характеристики
элементов, простых и сложных веществ,
учитывая то, что согласно закону
эквивалентов
все вещества взаимодействуют между
собой в эквивалентных количествах.
Единицей
химического эквивалента (э),
так же как и количества вещества является
моль,
а молярная
масса эквивалента (Мэ),
соответственно измеряется в г/моль.
Так,
водород в своих соединениях, как правило,
одновалентен, и его эквивалент равен 1
моль Н или 1/2 моль Н2,
а молярная масса его эквивалента Мэ(Н)
= 1 г/моль.
Кислород
в своих соединениях двухвалентен, тогда
его эквивалент равен 1/2 моль О или 1/4
моль О2,
а молярная масса его эквивалента Мэ(О)
= 8 г/моль.
Железо
в своих соединениях может быть и двух-,
и трехвалентным, тогда его эквивалент
в первом случае будет равен 1/2 моль Fe, а
молярная масса эквивалента Мэ(Fe) = 28
г/моль. Эквивалент железа во втором
случае будет равен 1/3 моль Fe, а молярная
масса эквивалента Мэ(Fe) = 18,6 г/моль.
Следовательно, молярную массу эквивалента
простого вещества можно рассчитать по
формуле:
, (1)
где М(эл-та)
– молярная масса элемента;
В(эл-та)
– валентность элемента.
Молярные
массы эквивалентов сложных веществ
(оксидов, кислот, оснований, солей)
рассчитываются несколько иначе.
Молярная
масса эквивалента оксида
рассчитывается отношением молярной
массы оксида к произведению числа атомов
элемента на его валентность.
,
где М(оксида)
– молярная масса оксида;
n(эл-та) –
число атомов элемента;
В(эл-та) –
валентность элемента.
Для
оксида железа (Ш), например, молярная
масса его будет равна:
Молярная масса
эквивалента кислотырассчитывается
отношением молярной массы кислоты к
числу атомов водорода в кислоте, способных
замещаться в химических реакциях.
,
где М
(кислоты) – молярная масса кислоты;
n
(H) – число замещающихся в химической
реакции атомов водорода.
Для серной
кислоты (H2SO4),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента основания
рассчитывается отношением молярной
массы основания к числу гидроксогрупп.
,
где
М (основания) – молярная масса основания;
n
(OH) – число гидроксогрупп.
Для
гидроксида кальция (Ca(OH)2),
например, молярная масса эквивалента
будет равна:
Молярная
масса эквивалента соли
рассчитывается отношением молярной
массы соли к произведению числа атомов
металла на их валентность.
,
где М
(соли) – молярная масса соли;
n (Ме) –
число атомов металла;
В (Ме) – валентность
металла.
Для
сульфата натрия (Na2SO4),
например, молярная масса эквивалента
будет равна:
Из
закона
эквивалентов
следует, что массы вступающих и
образующихся в результате реакции
веществ прямопропорциональны молярным
массам их эквивалентов:
, (2)
где
m(1)
и Мэ(1)
– масса и молярная масса эквивалента
первого вещества;
m(2)
и Мэ(2)
– масса и молярная масса эквивалента
второго вещества.
Из
следствия из закона Авогадро вытекает
понятие молярный
объем – объем,
который занимает 1 моль любого газа при
нормальных условиях, т.е. при р = 105
Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0о
С). Значение
этого объема равно 22,4 л/моль (22400 мл/моль).
Отсюда можно вывести понятие и молярного
объема эквивалента
газа (или эквивалентного объема) –
объема, занимаемого при нормальных
условиях одним эквивалентом (одной
молярной массой эквивалента) газа.
Известно,
что эквивалент водорода равен 1/2 моль
Н2,
тогда молярный объем эквивалента
водорода Vэ(Н2)
= 11,2 л/моль; соответственно Vэ(О2)
= 5,6 л/моль, т.к. эквивалент кислорода
равен 1/4 моль О2.
Если
же в реакции участвуют газы и известны
их объемы, то соотношение (2) можно
представить следующим образом:
(3)
где m(1)
и Мэ(1) –
масса и молярная масса эквивалента
первого вещества;
V(2)
и Vэ(2) –
объем и молярный объем эквивалента
второго вещества.
Следует
иметь ввиду, что объемы, входящие в
соотношение (3), нужно приводить
к нормальным условиям
по формуле объединенного закона
Гей-Люссака – Бойля –Мариотта:
,
откуда(4)
где р,
V, Т –
давление, объем и температура газа при
условиях опыта;
ро,
Vо,
То
– давление, объем и температура газа
при нормальных условиях.
Известны
методы экспериментального определения
молярных масс эквивалентов: 1) метод
прямого определения – молярную массу
эквивалента определяют по данным прямого
синтеза кислородного или водородного
соединения данного элемента; 2)
аналитический метод – производится
точный анализ соединения данного
элемента с любым другим, молярная масса
эквивалента которого известна; 3) метод
вытеснения водорода – используется для
определения молярной массы эквивалента
тех металлов, которые способны вытеснить
водород из разбавленных кислот и щелочей;
4) электрохимический метод – определяется
масса металла, осаждающегося на электроде
при электролизе раствора соли этого
металла. Молярная масса эквивалента
рассчитывается по закону Фарадея: при
прохождении через раствор или расплав
электролита 965000 Кулонов электричества
на электродах выделяется по одному
эквиваленту вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
Сущность
экспериментального определения молярной
массы эквивалента металла заключается
в определении объема водорода (приведенного
к нормальным условиям), вытесняемого
из кислоты навеской металла, взятой на
аналитических весах.
Произведением
молярной массы эквивалента металла на
его валентность определяют молярную
массу атома металла.
По
молярной массе атома металла и его
валентности находят местоположение
металла в периодической системе элементов
Д.И.Менделеева, т.е. его название.
По
указанию преподавателя студент взвешивает
на аналитических весах навеску металла
известной валентности.
Прибор
для определения молярной массы эквивалента
изображен на рисунке.
П
еред началом работы прибор следует
проверить на герметичность. Для этого
отсоединяют пробирку А от прибора, через
воронку С заливают водой таким образом,
чтобы уровень воды в бюретке В установился
на нулевом делении или несколько ниже;
избыток воды удалить. Присоединяют
пробирку А на место. Затем поднимают
воронку C вверх и следят за уровнем воды
в бюретке В. Если уровень в последней
непрерывно повышается, то это означает,
что прибор негерметичен и следует
проверить все резиновые соединения.
Если же прибор герметичен, то повышение
уровня воды в бюретке В произойдет
незначительно только в первый момент,
а потом он будет оставаться неизменным.
Убедившись
в герметичности прибора, отсоединяют
пробирку А от прибора и, записав начальный
уровень воды в бюретке В, наливают в
пробирку А 1/4 ее объема соляной кислоты,
приготовленной для определения молярной
массы эквивалента металла соответствующей
валентности.
Держа
пробирку А в положении, близком к
горизонтальному, помещают на сухое
место у отверстия пробирки взвешенный
металл и в таком положении соединяют
пробирку А с бюреткой В, следя за тем,
чтобы металл не упал в кислоту.
Убедившись
вторично
в герметичности прибора путем поднятия
воронки С вверх, стряхивают металл в
кислоту и наблюдают за ходом реакции.
По
окончании реакции (прекращение выделения
пузырьков водорода), устанавливают
уровень воды в бюретке В и воронке С на
одной высоте, перемещая кольцо К с
воронкой С вниз по штативу, и записывают
уровень воды в бюретке В после окончания
опыта. Шкала бюретки В проградуирована
в миллилитрах (мл).
С
помощью барометра определяют величину
атмосферного давления ( ратм ),
термометра – температуру ( t ) воздуха
в помещении (соответственно и температуру
воды в приборе) в момент проведения
опыта.
С
помощью таблицы 1 определяют давление
водяного пара ( рН2Опар ),
соответствующего измеренной температуре
опыта, в мм рт.ст.
Таблица
1
Зависимость
давления водяного пара от температуры
|
t |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
рН2Опар |
12,8 |
13,6 |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,8 |
Порядок расчета
-
Определите
объем выделившегося водорода в результате
опыта. Для этого от значения уровня
воды в бюретке В после окончания опыта
( V2
) следует вычесть значение уровня воды
в бюретке В в начале опыта ( V1
).
V(Н2)
= V2
– V1.
Переведите
значение объема выделившегося в
результате опыта водорода в кубические
дециметры, учитывая, что 1 см3
= 10 –3
дм3.
-
Приведите
экспериментальный объем выделившегося
водорода к нормальным условиям,
воспользовавшись формулой 4. Следует
учесть, что давление внутри бюретки В
складывается из давления водорода и
давления водяного пара внутри объема
бюретки при данной температуре:
ратм
= рН2
+ рН2Опар
, тогда
где ратм
– измеренное атмосферное давление во
время проведения опыта;
рН2Опар –
давление водяного пара при температуре
опыта;
V
(Н2) –
экспериментальный объем водорода;
Т
– температура проведения опыта (К),
равная (273+t);
ро,
То
– давление и температура при нормальных
условиях.
-
Вычислите
молярную массу эквивалента металла, с
точностью до 0,1 г/моль, воспользовавшись
формулой 3:
4. Воспользовавшись
формулой 1, рассчитайте молярную массу
металла и укажите какой это металл.
Результаты
эксперимента представьте в виде таблицы
2.
Таблица
2
|
масса |
pатм, мм |
t, |
V1,, |
V2, |
V(H2), |
pH2Oпар, мм |
V0(H2), |
Мэ |
М |
5. Вычислите
величины абсолютной и относительной
ошибок (Х).
Абсолютная
ошибка:
Хабс.
= М (Ме)
табличное – М
(Ме)
экпериментальное
Относительная
ошибка:
Вопросы для
самоконтроля
1. Что
называется эквивалентом вещества?
-
Что
является единицей эквивалента вещества? -
Какую
размерность имеет молярная масса
эквивалента вещества? -
Какие
значения имеют молярные массы эквивалентов
водорода и кислорода? -
Как
можно рассчитать молярную массу
эквивалента элемента? -
Что
такое молярный объем и молярный объем
эквивалента? -
Какие
значения имеют молярные объемы
эквивалентов водорода и кислорода? -
Как
формулируется закон эквивалентов? -
Почему
при выполнении расчетов в экспериментальной
части работы нужно знать давление
водяного пара? -
Какие
Вы знаете методы экспериментального
определения молярной массы эквивалента
металлов?
Задачи
-
Медь
с кислородом образует два соединения,
в которых содержится 79,9 % меди и 20,1 %
кислорода, и 88,8 % меди и 11,2 % кислорода.
Определите молярные массы эквивалентов
меди в этих соединениях и составьте
формулы этих соединений. -
При
сгорании 3 г магния образовалось 5 г
оксида магния. Рассчитайте молярную
массу эквивалента магния. -
При
взаимодействии 2,4 г углерода с кислородом
образовалось 5,6 г оксида. Определите
молярную массу эквивалента углерода
в этом соединении и напишите уравнение
реакции. -
При
взаимодействии 4 г двухвалентного
металла с кислородом образовалось 5,6
г оксида. Определите, какой это металл
и напишите уравнение реакции. -
При
растворении в соляной кислоте 5,4 г
трехвалентного металла выделилось
6,72 л водорода, измеренного при н.у.
Определите, какой это металл и напишите
уравнение реакции. -
При
взаимодействии одновалентного металла
с 0,2 г водорода образовалось 4,8 г гидрида
металла. Определите, какой это металл
и напишите уравнение этой реакции. -
При
окислении 8 г металла, проявляющего
валентность, равную I, получено 9 г
оксида. Определите, какой это металл и
напишите уравнение данной реакции. -
Рассчитайте
объем водорода, выделившегося при
растворении в соляной кислоте 18 г
металла, молярная масса эквивалента
которого равна 9 г/моль. -
При
взаимодействии 0,9 г трехвалентного
металла с серой образовалось 2,5 г
сульфида металла. Определите, какой
это металл, учитывая, что молярная масса
эквивалента серы в этом соединении 16
г/моль. Напишите уравнение соответствующей
реакции. -
При
окислении 6,4 г серы образовалось 16 г
оксида. Определите молярную массу
эквивалента серы в этом соединении и
напишите уравнение соответствующей
реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Молярная, молекулярная и атомная массы
Молярная масса (для обозначения в формулах используется буква М) — характеристика вещества, отражающая количество граммов, которое содержится в одном его моле. Измеряется эта величина в г/моль. Интересно, что в Международной системе единиц указано, что параметр должен выражаться в кг/моль. Но г/моль является более удобной единицей измерения, поэтому именно она обычно используется на практике.
Эту величину иногда путают с относительной молекулярной массой. Численно они равны, но суть у последней другая. Молекулярная масса показывает, во сколько раз молекула вещества тяжелее атомной единицы массы (а. е. м.). Относительной она называется потому, что в химии вообще не используется понятие абсолютной по причине её чрезвычайной малости. К примеру, абсолютная масса атома водорода — 1,7*10-24 г, этот параметр просто показывает, во сколько раз молекула тяжелее 1/12 углерода.
За единицу отсчёта атом элемента был взят за нейтральность и широкую распространённость в природе его изотопа. Но учёные не сразу ориентировались на углерод. Сначала были попытки создания водородной шкалы исходя из того, что водород наиболее лёгкий элемент, потом — кислородной. Но когда оказалось, что в природе это вещество является смесью изотопов с массой от 16 до 18, единица стала неприемлемой, поэтому её заменили углеродной.
С массой атомной молярная тоже может быть одинаковой, если простое вещество состоит из одного атома. Для каждого элемента её легко определить по таблице Менделеева — вместе с порядковым номером она указана в ячейке.
Определение атомной массы для каждого химического элемента было непростой задачей. Для этого учёные взвешивали все существующие в земной коре изотопы и вычисляли их среднее значение с учётом процентной распространённости в природе. Что касается синтетических элементов, то их определяли по наиболее стабильному изотопу.
Определение в сложных веществах
Для простых веществ, состоящих из одного атома, параметр считается так же, как для элемента. Молярная масса углерода всегда равна 12. Этот показатель справедлив и для натрия. Как простое вещество, этот мягкий серебристо-белый металл содержит в себе 23 г/моль, а купрум (так на латинском обозначается медь) — 63,5 г/моль. Газ также может состоять из одного элемента, например, гелий, искомый параметр которого 4 г/моль.
Но существуют и газы, которые образованы двумя молекулами (водород, азот, кислород, хлор, фтор и другие) или тремя (озон). Для них нужно не забывать умножать атомную массу на число молекул. Для сложных веществ параметр можно рассчитать аналогичным образом:
- В H2O содержится два атома водорода и один кислорода, результат считается как 2 * 1 + 16. Итоговое значение молярной массы воды равно 18. Этот параметр для углекислого газа CO2 равен 44 (сумма массы углерода 12 и двух атомов кислорода 32), а для сернистого газа SO2 — 64 г/моль.
- Органическое вещество метан, формула которого CH4, состоит из одного атома углерода и четырёх водорода, следовательно, ему свойственно значение 16. А у этана, содержащего на одну группу CH2 больше, масса равняется 30 г/моль.
- В аммиаке NH3 — 17 г/моль.
- В соляной кислоте HCl содержится 36,5 г/моль (обычно атомную массу хлора считают как 35,5, тогда как для многих других элементов её чаще округляют до целого значения). В хорошо известной калиевой щёлочи KOH — 56 г/моль.
- В натриевой соли серной кислоты Na2SO4, как следует из химической формулы, находится 142 г/моль, а в алюминиевой (Al2 (SO4)3) — 342 г/моль. В азотнокислом серебре AgNO3 — 170 г/моль, в хлориде калия KCl — 74,5 г/моль.
- В молекуле сахара, как в быту называют сахарозу, содержится 12 атомов углерода, 22 водорода и 11 кислорода, а это значит, что его масса равна 342 г/моль. В глюкозе 6, 12 и 6 атомов углерода, водорода и кислорода соответственно, а параметр равен 180 г/моль.
Исходя из этого, формулу молярной массы можно вывести следующим образом: М (XxYy) = М (Хx) + М (Yy) = x * М (Х) + y * М (Y). Таким образом, вычислить этот параметр для любого органического или неорганического вещества совсем несложно.
Главное, иметь под рукой таблицу Менделеева, тогда никакие онлайн-калькуляторы не потребуются.
Расчёты в смеси
Задачу можно усложнить, попробовав посчитать этот показатель в смеси, где в разных пропорциях входят различные соединения. Идеальным примером для этого является воздух. В нем можно выделить следующие составляющие:
- 23% кислорода;
- 76% азота;
- 1% аргона.
Искомый параметр будет вычисляться следующим образом: 0,23*32+0,76*28+0,01*40. Результат равен 29,04 г/моль (можно округлить до 29).
Конечно, в воздухе содержатся и другие вещества (углекислый и инертные газы, водород и т. д. ), но их масса составляет менее десятой процента, поэтому для простоты их допускается не учитывать.
Применение в химических задачах
С этим параметром связано множество других формул. Зная его, можно вычислить количество вещества (n). Для этого нужно разделить его фактическую массу на молярную (n = m / M). Чтобы узнать число частиц в нём (N), полученное значение n нужно умножить на константу Авогадро (N A). Получается 6,02*1023 (N = n * N A) Именно столько структурных единиц содержится в одном моле любого соединения или простого вещества. С другой стороны, зная показатель n, можно найти m по формуле n * M. В итоге получается ещё одна формула: M = m / n.
В учебнике может ждать такая задача: «Найдите массу 0,75 моль азота N2». Начать нужно с нахождения массы одного атома азота. По таблице Менделеева она равняется 14 г. Молекула состоит из двух атомов, следовательно, масса одного моля азота как простого вещества будет иметь значение 28, а масса 0,75 моль — 21 грамм.
Не менее распространена в мире химии физическая величина под названием молярный объём (V m). Её получают как отношение молярной массы к плотности вещества (M /ρ). Размерность этой величины — м3/моль или л/моль (кубический метр или литр на моль). В стандартных условиях для идеального газа её значение принимается за 22,41. Конечно, в реальных условиях наблюдаются отклонения от этого значения, но для решения задач ими можно пренебречь, поскольку они минимальны.
Величину для газа можно найти по формуле M = V m * ρ. Но более правильным будет вычислять её с учётом всех условий по уравнению Менделеева — Клайперона. Оно выглядит следующим образом: p * V = m * R * T / M, где p — давление, V — объём, m — масса, R — константа, равная 8,314, T — температура, M — молярная масса.
Иногда требуется найти параметр для эквивалента (MЭ). Он будет напрямую зависеть от класса соединения и его формулы. Для кислот эквивалентное число (z) соответствует количеству атомов водорода в составе (один для HCl, два для H2SO4, три для H3PO4), для щелочей — групп OH (одна для KOH, две для Ca (OH)2). Для веществ, эквивалент которых равен единице, результат не меняется, для всех остальных МЭ находится как М/ z. Исходя из этого:
- МЭ для HCl равно 36,5 г/моль (один атом водорода), для H2SO4 — 49 г/моль (два атома водорода, следовательно, массу нужно разделить на 2);
- МЭ для KOH равно 51 г/моль, для Ca (OH) 2 — 37 г/моль.
Химия может быть понятной и доступной только для тех, кто последовательно подходит к её изучению и уделяет внимание каждой теме, читая учебники или просматривая видеоуроки. Но старания стоят того, ведь эта наука невероятно важная и интересная, она может дать объяснение составу и строению любого объекта окружающей среды, а на основе этих данных можно узнать практически всё о его свойствах и научиться волшебству превращения одних веществ в другие.
Определение молярной массы эквивалента металла
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Определение 1
Эквивалент – это частица вещества (реальная/условная), которая способна замещать/присоединять один ион водорода в кислотно-основных реакциях, а также присоединять/высвобождать один электрон в ходе окислительно-восстановительных реакций.
Молярная масса эквивалента металла
Молярная масса эквивалента ($mathrm {M_э}$ – это масса одного моля эквивалента.
Замечание 1
Моль – это количество вещества, которое содержит столько структурных единиц, сколько содержится атомов в 12 г изотопа углерода.
Рассчитывается молярная масса эквивалента следующим образом:
$mathrm {M_э = f_э cdot M_{в-ва} = frac {M_{в-ва}}{В_{в-ва}}}$
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Где:
- $mathrm {M_э}$ – молярная масса эквивалента (г/моль),
- $mathrm {f_э}$ – фактор эквивалентности (число, которое показывает, какая часть молекулы соответствует эквиваленту),
- $mathrm {M_{в-ва}}$ – молярная масса вещества,
- $mathrm {В_{в-ва}}$ – валентность вещества .
В качестве примера возьмем двухвалентное железо, тогда молярная масса эквивалента будет рассчитываться следующим образом:
$mathrm {M_{Э_{Fe}} = frac {56}{2} = 28 г/моль}$
Закон эквивалентов
Закон эквивалентов гласит, что вещества взаимодействуют в количествах, пропорциональных их эквивалентам.
Из этого следует:
$mathrm {frac{m_1}{m_2} = frac {M_Э1}{M_Э2}}$
Рассмотрим пример решения задачи:
В результате сгорания 5г Ме образовалось 9,44 г оксида этого металла. Необходимо рассчитать молярную массу эквивалента Ме.
- Составим уравнение: $mathrm {2Ме + О_2 to MeO}$.
- Найдем массу кислорода в оксида $mathrm {m_{O_2} = 9,44 – 5 = 4,44 г}$.
- Применим закон эквивалента $mathrm {frac{m_{Me}}{m_{O_2}} = frac{M_{Э_{Me}}}{M_{Э_{O_2}}}}$
Молярная масса эквивалента кислорода равна 8 г/моль ($mathrm {frac {16}{2} = 8}$)
Из этого следует, что молярная масса эквивалента Ме равна: $mathrm {frac {m_{Me}} cdot M_{Э_{О_2}}{m_{O_2}}= frac {40}{4,44} = 9г/моль}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 21.12.2022
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.