- Относительная атомная и молекулярная масса
- Количество вещества. Постоянная Авогадро
- Молярная масса
- Молярный объем
- Задачи
п.1. Относительная атомная и молекулярная масса
Массы атомов и молекул, из которых состоят вещества, очень малы. Поэтому их чаще измеряют не в килограммах, а используют внесистемную единицу – атомную единицу массы.
Атомная единица массы – внесистемная единица, равная 1/12 массы свободного покоящегося атома углерода (^{12}mathrm{C}), находящегося в основном состоянии. $$ 1 text{а. е. м}approx 1,66cdot 10^{-27} text{кг} $$
Относительная атомная масса – это физическая величина, показывающая, во сколько раз масса данного атома больше атомной единицы массы: $$ A_rapprox frac{m_{at}}{1,66cdot 10^{-27}} $$
Относительную атомную массу проще всего найти, пользуясь таблицей Менделеева.

Например:
(A_r(mathrm{H})=1,00797 text{а. е. м}) – относительная атомная масса водорода
(A_r(mathrm{C})=12,01115 text{а. е. м}) – относительная атомная масса углерода
(A_r(mathrm{N})=14,0067 text{а. е. м}) – относительная атомная масса азота
(A_r(mathrm{O})=15,9994 text{а. е. м}) – относительная атомная масса кислорода
На практике при решении учебных задач относительные атомные массы округляют и единицу измерения а.е.м. не пишут.
Например: $$ A_r(mathrm{H})=1, A_r(mathrm{C})=12, A_r(mathrm{N})=14, A_r(mathrm{O})=16 $$
Относительная молекулярная масса вещества – это физическая величина, показывающая, во сколько раз масса одной молекулы данного вещества больше атомной единицы массы: $$ M_rapprox frac{m_{mol}}{1,66cdot 10^{-27}} $$ Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, из которых состоит данное вещество: $$ M_r=sum A_r $$
Например:
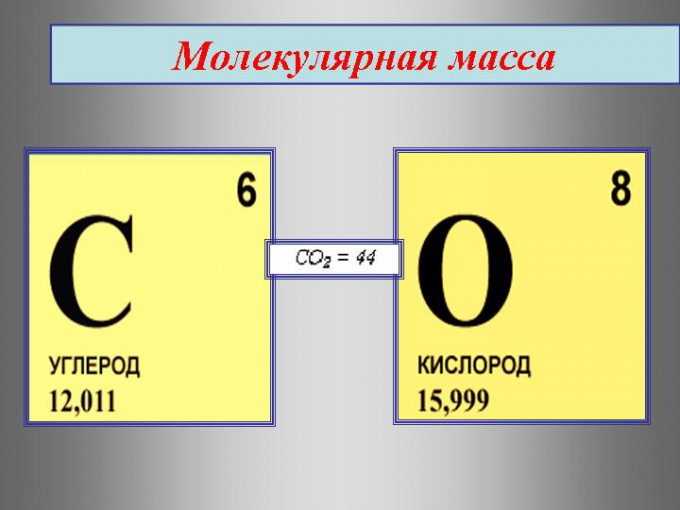
Найдем относительную молекулярную массу молекулы воды (mathrm{H_2O}), которая состоит из двух атомов водорода и одного атома кислорода $$ M_r(mathrm{H_2O})=2A_r(mathrm{H})+A_r(mathrm{O})=2cdot 1+16=18 $$
Масса молекулы вещества равна произведению относительной молекулярной массы данного вещества на величину 1 а.е.м., выраженную в килограммах: $$ m_{mol}approx 1,66cdot 10^{-27}cdot M_r (text{кг}) $$
Например:
Масса молекулы водорода $$ m(mathrm{H_2O})=approx 1,66cdot 10^{-27}cdot 18approx 2,99cdot 10^{-26} (text{кг}) $$
п.2. Количество вещества. Постоянная Авогадро
Моль – количество вещества системы, содержащей столько же структурных элементов (атомов, молекул, ионов), сколько содержится атомов в углероде-12 массой 0,012 кг.
В 1 моле любого вещества содержится одинаковое количество частиц $$ N_Aapprox 6,022cdot 10^{23} $$ Число (N_A) называют постоянной Авогадро.
Количество вещества – физическая величина, равная отношению числа однотипных структурных элементов (атомов, молекул, ионов), содержащихся в веществе, к числу Авогадро: $$ nu=frac{N}{N_A} $$ Единицей измерения количества вещества в СИ является моль.
Например:
В 5 молях углерода будет содержаться (N=5cdot N_Aapprox 6,022cdot 10^{23}approx 3,01cdot 10^{24}) атомов углерода. Причём, всё равно, будут ли эти атомы углерода образовывать уголь, графит или алмаз.
Аналогично, в 5 молях воды будет (N=5cdot N_Aapprox 3,01cdot 10^{24}) молекул воды. Причём, независимо от того, в каком агрегатном состоянии находится вода: в виде пара, жидкости или льда.
Т.е., «количество вещества» всегда говорит нам о «количестве частиц», независимо от других параметров.
п.3. Молярная масса
Молярная масса – это масса 1 моля вещества.
Из определения 1 моля вещества и относительной молекулярной массы следует, что молярная масса равна $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Молярная масса воды $$ mu(mathrm{H_2O})=M_r(mathrm{H_2O})cdot 10^{-3}=18cdot 10^{-3}frac{text{кг}}{text{моль}} $$
Алгоритм определения молярной массы вещества с помощью таблицы Менделеева
Шаг 1. По таблице Менделеева найти относительные атомные массы (A_{ri}) для всех элементов, входящих в молекулу вещества.
Шаг 2. Найти относительную молекулярную массу как сумму всех относительных атомных масс $$ M_r=sum_i A_{ri} $$ Шаг 3. Записать молярную массу в виде $$ mu=M_rcdot 10^{-3}frac{text{кг}}{text{моль}} $$
Например:
Найдем молярную массу этилового спирта begin{gather*} A_r(mathrm{C})=12, A_r(mathrm{H})=1, A_r(mathrm{O})=16\ M_r(mathrm{C_2H_5OH})= 2A_r(mathrm{C})+6A_r(mathrm{H}) +A_r(mathrm{O})=2cdot 12+6cdot 1+16=46\ mu(mathrm{C_2H_5OH})=46cdot 10^{-3}frac{text{кг}}{text{моль}} end{gather*}
п.4. Молярный объем
Молярный объем – это объем 1 моля вещества.
Молярный объем равен отношению молярной массы к плотности вещества: $$ V_{mu}=frac{mu}{rho} $$
Например:
Молярный объем воды begin{gather*} V_{mu}(mathrm{H_2O})=frac{18cdot 10^{-3} text{кг/моль}}{10^3 text{кг/м}^3}=18cdot 10^{-6}frac{text{м}^3}{text{моль}}=18frac{text{cм}^3}{text{моль}}=18frac{text{мл}}{text{моль}} end{gather*} Т.е. 1 моль воды занимает объем 18 мл (столовая ложка).
При нормальных условиях (t=0°C, ρ=1 атм) молярные объемы всех идеальных газов одинаковы и равны: $$ V_{mu text{газ}}=22,4frac{text{л}}{text{моль}} $$
Это свойство газов часто используется при изучении различных веществ и явлений в физике и химии.
п.5. Задачи
Задача 1. Масса кристалла серы равна 16 г. Сколько молекул серы (mathrm{S_8}) содержится в этом кристалле? (Ответ округлите до двух значащих цифр).
Дано:
(m=16 text{г}=16cdot 10^{-3} text{кг})
(A_r=32)
(N_A=6,022cdot 10^{23})
__________________
(N-?)
Относительная молекулярная масса одной молекулы $$ M_r=8cdot A_r=8cdot 32=256 $$ Молярная масса $$ mu=256cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в кристалле серы: $$ nu=frac{N}{N_A}=frac{m}{mu} $$ Количество молекул в кристалле серы: $$ N=frac{m}{mu}N_A $$ $$ N=frac{1,6cdot 10^{-3}}{256cdot 10^{-3}}cdot 6,022cdot 10^{23}approx 3,8cdot 10^{22} $$ Ответ: (3,8cdot 10^{22})
Задача 2*. В кислородном генераторе на космическом корабле было получено 1,6 кг кислорода (mathrm{O_2}). Одному космонавту по норме требуется 600 литров кислорода в сутки. Считая условия для газа приблизительно нормальными, определите, на сколько часов космонавту хватит полученного кислорода.
Дано:
(m=1,6 text{кг})
(V_t=600frac{text{л}}{text{сут}}=25frac{text{л}}{text{ч}})
(A_r=16)
(V_{mu}=22,4frac{text{л}}{text{моль}})
__________________
(t-?)
Относительная молекулярная масса молекулы кислорода $$ M_r=2cdot A_r=32 $$ Молярная масса кислорода $$ mu=32cdot 10^{-3}frac{text{кг}}{text{моль}} $$ Количество вещества в полученном кислороде $$ nu=frac{m}{nu}=frac{V}{V_{mu}} $$ Объем полученного кислорода $$ V=frac{m}{mu}=V_{mu} $$ Количество часов для дыхания одного человека begin{gather*} t=frac{V}{V_t}=frac{m}{mu}frac{V_{mu}}{V_t}\[6pt] t=frac{1,6 text{кг}}{32cdot 10^{-3} text{кг/моль}}cdot frac{22,4 text{л/моль}}{25 text{л/ч}}=44,8 text{ч} end{gather*} Ответ: 44,8 ч.
Для того чтобы разобраться с понятием «молярная масса», необходимо вспомнить важный химический термин «моль». Моль тесно связан с химической константой – числом Авогадро и химическим элементом углерод (С), который взят за основу при определении количества вещества, равного 1 молю. Помнить наизусть его значение необязательно, любой электронный или бумажный справочник легко напомнит нам, что число Авогадро (оно обозначается NА) составляет 6,02х1023. Это число частиц вещества (количество молекул или атомов), которое содержится в одном его моле. Принято считать, что в 1 моле любого химического соединения содержится такое количество вещества, которое содержат 12 г атома углерода.
Простыми словами молярную массу можно идентифицировать как «вес 1 моля химического вещества».
В международной системе единиц СИ в соответствии с принятыми стандартами молярную массу определяют в граммах на моль (г/моль). В определенных случаях ее также указывают в кг/моль, если так удобнее производить расчеты. В процессе решения задач по химии молярную массу обозначают большой буквой «М».
Молярную массу не надо путать с весом молекулы, атома и иона, эти понятия отнюдь не тождественны, хотя их числовые величины могут и совпадать. Далеко не для всех химических веществ молярная масса и молекулярный вес равны друг другу. Молярная и молекулярная массы соединений имеют одинаковые значения для химических веществ, состоящих из атомов.
Не путайте молярную массу с весом молекулы!
Рассмотрим это на примере галогена из 7-й группы таблицы Менделеева – хлора (CL):
• атом хлора Cl «весит» 35,5;
• ион хлора Cl– – 35,5;
• молекула хлора Cl2 – 71.
Отличаются между собой эти значения и для другого газа – азота (N2):
• молекула азота, состоящая из 2 атомов, имеет массу 28;
• атом элемента N – 14.
Вывод напрашивается сам по себе – молярные массы элемента, иона и вещества могут существенно различаться.
Как вычислить молярную массу
Чтобы рассчитать значение молярной массы химического вещества, целесообразно придерживаться следующего алгоритма:
- Подготовить таблицу Менделеева (она может понадобиться для определения валентности и атомных масс химических элементов).
- Правильно составить химическую формулу вещества, пользуясь знаниями об основных классах неорганических соединений и их свойствах и сведениями, почерпнутыми из таблицы Менделеева, например:
- углекислый газ – СО2;
- серная кислота – Н2SO4;
- хлорид кальция CaCL2;
- гидроксид алюминия Al(OH)3.
Прежде всего при составлении формул соединений необходимо помнить о валентности элементов, из которых они состоят.
- Определяем молекулярный вес и молярную массу каждого из вышеуказанных химических соединений (вес атомов опять берем в ячейке химического элемента в таблице Менделеева):
- СО2 – 1 атом углерода (12) + 2 атома кислорода (32) = 44;
- Н2SO4 – 2 атома водорода (2) + 1 атом серы (32) + 4 атома кислорода (64) = 98;
- CaCL2 – 1 атом кальция (40) + 2 атома хлора (71) = 111;
- Al(OH)3 – 1 атом алюминия (27) + 3 атома водорода (3) + 3 атома кислорода (48) = 78.
Как видно из приведенных примеров, для выполнения необходимых вычислений достаточно сложить значения атомных масс элементов, находящихся в составе сложных веществ. Для простых веществ следует взять этот показатель, относящийся к соответствующему элементу, из таблицы Менделеева, принимая во внимание количество атомов в одной молекуле вещества (индекс в его формуле).
- Определяем массу одной молекулы каждого из этих неорганических соединений с помощью числа Авогадро:
- m(СО2) = Мr(СО2) : NA= 44:6,02·1023 = 7,3·1023 г;
- m(H2SO4) = Мr(H2SO4) : NA= 98:6,02·1023 = 16,28·1023 г;
- m(CaCL2) = Мr(CaCL2) : NA= 111:6,02·1023 = 18,5·1023 г;
- m(Al(OH)3) = Мr(Al(OH)3) : NA= 78:6,02·1023 = 13,0·1023 г.
Практическое значение молярной массы вещества
Термин «молярная масса» широко используется в таких научных дисциплинах, как химия и физика. Значения молярных масс соединений часто требуется вычислять в химической промышленности при разработке полимерных комплексов и в ряде других ситуаций. Современную фармакологию также трудно представить без проведения расчетов этой величины.
Молярная масса – одно из ключевых понятий при проведении биохимических исследований.
Таким образом, молярную массу необходимо уметь вычислять не только ученым-химикам и сотрудникам химических лабораторий, но и специалистам из ряда других областей науки, фармакологам и работникам ряда отраслей промышленного производства.
Тест по теме “Молярная масса”
Как определить молекулярную массу
Определения молекулярной массы вещества – это довольно специфическое, но важное умение, которое требуется для качественного изучения курса химии или физики. Данная тема относится к одному из базовых школьных разделов, на которых строится умения решать расчетные задачи, причем как на контрольной или на самостоятельной работе, так и во время практических занятий. И даже если уже не придется заниматься собственным образованием, то полученные знания могут пригодиться для ответов на вопросы своих пытливых детей.
Вам понадобится
- Таблица Д.И. Менделеева, ручка, калькулятор
Инструкция
Если внимательно рассмотреть таблицу химических элементов Дмитрия Ивановича Менделеева, то можно увидеть, что она имеет вид многоквартирного многоэтажного дома, в котором находятся «жильцы» – химические элементы. Каждый из них имеет фамилию (название) и химический символ. Причем каждый из элементов живет в своей собственной квартире, а потому имеет порядковый номер. Эта информация представлена во всех клеточках таблицы.
Однако там стоит еще одна цифра, на первый взгляд совсем непонятная. Мало того, она указана с несколькими значениями после запятой, что делается для большей точности. Именно на это число и нужно обратить внимание, потому что это и есть относительная атомная масса. Причем эта характеристика – величина постоянная, которую не требуется запоминать и можно найти по таблице. Кстати даже на ЕГЭ по химии таблица Д.И. Менделеева является справочным материалом, доступным для использования, и у каждого лежит в индивидуальном пакете – КИМе.
Молекулярная масса, а точнее относительная молекулярная масса вещества обозначается буквами (Mr) складывается из относительных атомных масс (Ar), образующих молекулу, элементов. Относительная атомная масса – это как раз та, загадочная цифра, которая стоит в каждой клеточке таблицы. Для расчетов необходимо эти значения округлять до целого числа. Исключением является только атом хлора, у которого относительная атомная масса составляет 35,5. Единиц измерения эта характеристика не имеет.
Пример 1. Найдите молекулярную массу гидроксида калия (KOH)
Молекула гидроксида калия состоит из одного атома калия (К), одного атома кислорода (О) и одного атома водорода (Н). Следовательно, находим:
Mr (KOH) = Ar (К) + Ar (О) + Ar (Н)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (KOH) = 39 + 16 + 1 = 56
Пример 2. Найдите молекулярную массу серной кислоты (H2SO4 аш-два-эс-о-четыре)
Молекула серной кислоты состоит из двух атомов водорода (Н), одного атома серы (S) и четырех атомов кислорода (О). Следовательно, находим:
Mr (H2SO4) = 2Ar (H) + Ar (S) + 4Ar (O)
По таблице Д.И. Менделеева находим значения относительных атомных масс элементов:
Ar (К) = 39, Ar (О) = 16, Ar (Н) = 1
Отсюда: Mr (H2SO4) = 2 х 2 + 32 + 4 х 16 = 98
Видео по теме
Обратите внимание
При расчетах сначала выполняется умножение или деление, а только потом сложение или вычитание
Полезный совет
При определении относительной атомной массы округляйте значения, которые находятся в таблице Д.И. Менделеева до целого числа
Источники:
- как вычислить молекулярную массу
- Молекулярной массы определение
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.

Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.

Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).

Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
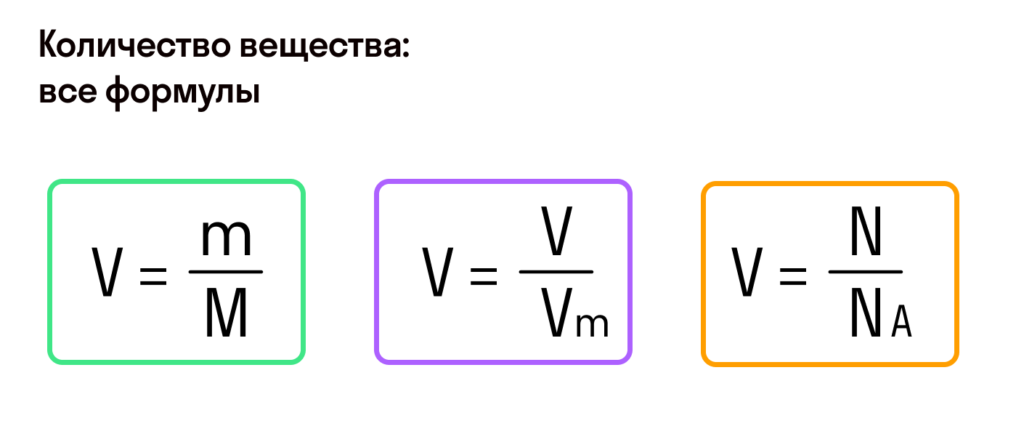
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
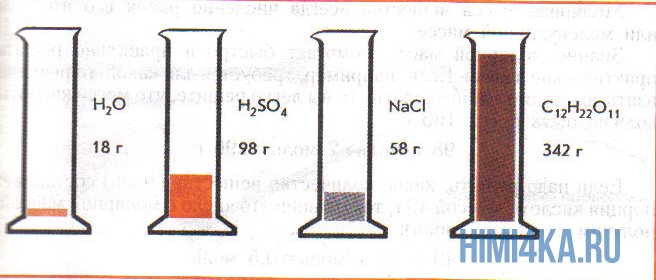
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
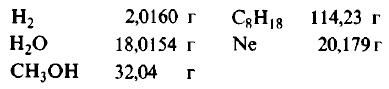
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
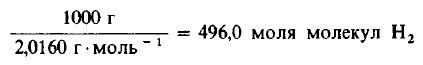
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
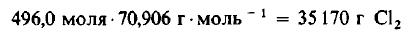
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.

Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.

Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.

Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
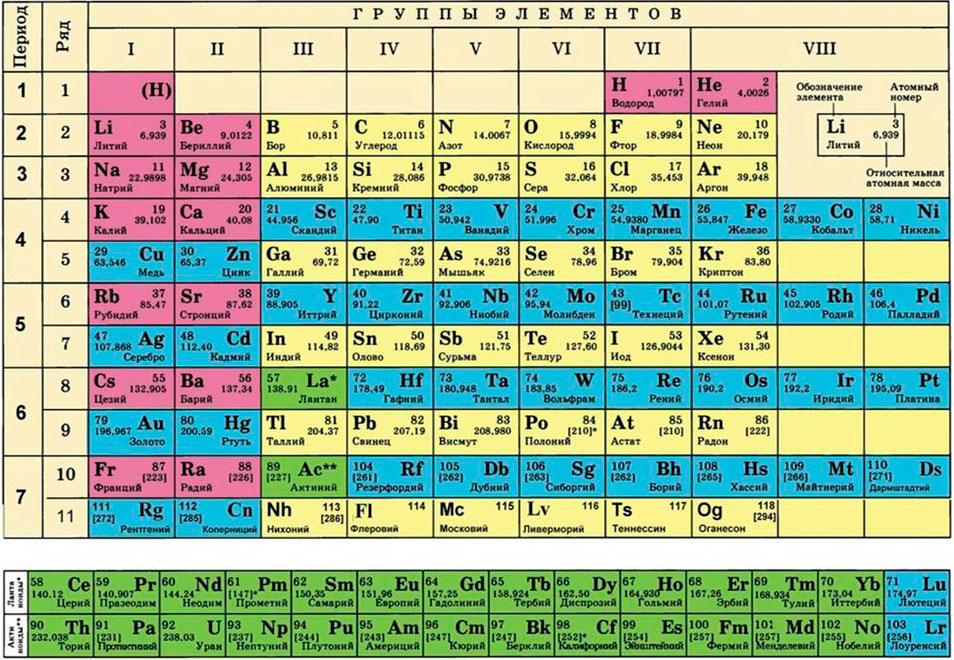
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
