Относительная молекулярная масса соединения равна сумме относительных атомных масс элементов, образующих соединение, с учётом числа атомов.
Mr (CuSO4) = Ar (Cu) + Ar (S) + 4 * Ar (O) = 63,5 + 32 + 4 * 16 = 159,5
Ответ: Mr (CuSO4) = 159,5
2. Вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
3. Вычислите массовые доли элементов в процентах по формулам соединений: а) CuSO4 — сульфат меди; б) Fe2O3 — оксид железа; в) HNO3 — азотная кислота.
4. Во сколько раз массовая доля химического элемента серы в оксиде серы SO3 меньше, чем в оксиде серы SO2?
5. Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
6. Применяя сведения об относительных атомных массах химических элементов, составьте химическую формулу сульфата меди, если массовые отношения в нем меди, серы и кислорода соответственно равны 2 : 1 : 2.
7. Выведите простейшую формулу соединения, в котором массовая доля натрия равна 32,4%, серы — 22,5%, кислорода — 45,1%.
8. Смешали 14 г порошкообразного железа с 14 г порошкообразной серы. Смесь нагрели. Найдите массу сульфида железа, если известно, что Fe и S в данном случае соединяются в массовых отношениях 7 : 4.
Тестовые задания.
- Формула: CuO4S или CuSO4
- Относительная молекулярная масса CuO4S: 159.6086
- Молярная масса CuO4S: 159.6086 г/моль (0.15961 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Cu (медь) | 1 | 63.546 | 63.546 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 159.6086 |
Расчёт молярной и относительной молекулярной массы CuO4S
- Mr[CuO4S] = Ar[Cu] + Ar[O] * 4 + Ar[S] = 63.546 + 15.9994 * 4 + 32.065 = 159.6086
- Молярная масса (в кг/моль) = Mr[CuO4S] : 1000 = 159.6086 : 1000 = 0.15961 кг/моль
Расчёт массовых долей элементов в CuO4S
- Массовая доля меди (Cu) = 63.546 : 159.6086 * 100 = 39.814 %
- Массовая доля кислорода (O) = 63.9976 : 159.6086 * 100 = 40.097 %
- Массовая доля серы (S) = 32.065 : 159.6086 * 100 = 20.09 %
Калькулятор массы
| Сульфат меди(II) | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Сульфат меди(II) |
| Традиционные названия | пентагидрат: «медный купорос» |
| Хим. формула | CuSO4 |
| Рац. формула | CuSO4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5[1] |
| Термические свойства | |
| Температура | |
| • разложения | выше 650 °C |
| Химические свойства | |
Константа диссоциации кислоты  |
5⋅10−3 |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура |
безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES |
[O-]S(=O)(=O)[O-].[Cu+2] |
| InChI |
InChI=1S/Cu.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 ARUVKPQLZAKDPS-UHFFFAOYSA-L |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| Безопасность | |
| Предельная концентрация | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 |
крысы, орально[2][3]: 300 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | Умеренно токсичен, ирритант, опасен для окружающей среды |
| Пиктограммы ECB |
|
| NFPA 704 |
0 2 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат меди(II) моногидрат
Сульфа́т меди(II) (медь(II) серноки́слая, традиционное название кристаллогидрата — ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой CuSO4.
Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего. На воздухе постепенно выветриваются (теряют кристаллизационную воду). Имеет горьковато-металлический вяжущий вкус.
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется в виде голубого пентагидрата CuSO4·5H2O (медный купоро́с). Токсичность медного купороса для теплокровных животных относительно невысока, в то же время он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Нахождение в природе[править | править код]
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов[4].
Получение[править | править код]
В промышленности[править | править код]
В промышленности загрязнённый сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании раствора воздухом:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях[править | править код]
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл концентрированной азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности плёнки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 раза перекристаллизовать из дистиллированной воды и высушить[5].
Очистка[править | править код]
Очистить загрязнённый или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространённой примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности плёнки кристаллов, после чего охлаждают для кристаллизации[5].
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ»[5].
Глубокая очистка[править | править код]
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10-4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная).
В него добавляют перекись водорода в количестве 2—3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3—5 граммов, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3-х процентного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов[6].
Физические свойства[править | править код]
| Температура, °С |
Растворимость | ||
|---|---|---|---|

|

|
||
| % | % | в г на 100 г воды |
|
| 0 | 12,9 | 20,2 | 23,3 |
| 15 | 16,2 | 25,3 | 30,2 |
| 25 | 18,7 | 29,2 | 34,9 |
| 30 | 20,3 | 31,6 | 39,9 |
| 40 | 22,8 | 35,5 | 46,2 |
| 50 | 25,1 | 39,2 | 52,6 |
| 60 | 28,1 | 43,8 | 61,1 |
| 70 | 31,4 | 49,0 | 71,6 |
| 80 | 34,9 | 54,4 | 83,8 |
| 90 | 38,9 | 60,0 | 98,2 |
| 100 | 42,4 | 66,0 | 115,0 |
Пентагидрат сульфата меди(II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см3. При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание[8].
Растворимость в воде[править | править код]
Растворимость сульфата меди(II) в воде при разных температурах приведена в таблице.
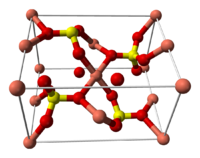
Строение кристаллогидрата[править | править код]
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие[править | править код]
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла (79 кДж/моль).
Химические свойства[править | править код]
Электролитическая диссоциация[править | править код]
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10−3.
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) диссоциирует в одну стадию:
Реакция замещения[править | править код]
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)[править | править код]
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета[9]:
Сокращённое ионное уравнение (Правило Бертолле)[править | править код]
Реакция обмена с другими солями[править | править код]
Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-:
Окислительные свойства[править | править код]
Сульфат меди окисляет HI, йодиды и при нагревании HBr и бромиды до свободных галогенов. Восстанавливается йодоводородом и йодидами до металлической меди при освещении, так как образующийся йодид меди (I) разлагается на свету. Смесь сухих сульфата меди и бромида натрия из-за образования бромида меди (II), который в сухом состоянии разлагается при температуре выше +500°C, а в присутствии влаги снижается его температура разложения до 115-140°C:







Прочее[править | править код]
С сульфатами щелочных металлов и аммония образует комплексные соли, например: Na2[Cu(SO4)2]·6H2O.
Ион Cu2+ окрашивает пламя в зелёный цвет.
Производство и применение[править | править код]
Кристаллы пентагидрата сульфата меди(II) CuSO4 · 5H2O
Сульфат меди(II) — одна из важнейших солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для обезвоживания (абсолютирования) этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
Лёгкость выращивания кристаллов пентагидрата сульфата меди и их резкое различие с безводной формой используются в школьном образовании.
В машиностроении используется для окраски металлических деталей перед их ручной разметкой.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1 %-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные повреждённые участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордо́ской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом[10].
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Безопасность[править | править код]
Вещество малотоксично. ПДК 500 мг/л[11][12]. Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становятся заметными при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 300 мг/кг[2]. Картина отравления при вдыхании аэрозолей медного купороса более сложна.
Правила обращения с веществом[править | править код]
Попадание на кожу сухого вещества считается безопасным, но его необходимо смыть. Аналогично при попадании растворов и увлажнённого твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струёй). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди, следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг[13]. При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жёсткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.
Гигиенические нормативы[править | править код]
ПДК в рабочей зоне — 1 мг/л (1г/м³) (по ионам двухвалентной меди).
Примечания[править | править код]
- ↑ Медный купорос. kristallov.net. Дата обращения: 26 апреля 2017. Архивировано 9 мая 2017 года.
- ↑ 1 2
Ершов Ю. А., Плетнева Т. В. Механизмы токсического действия неорганических соединений. — М.: Медицина, 1989. — С. 142. - ↑ Cupric sulfate Архивная копия от 12 августа 2014 на Wayback Machine. US National Institutes of Health
- ↑ Меди сульфат // Химическая энциклопедия / Гл. ред. И. Л. Кнунянц, Н. С. Зефиров. — М.: Советская энциклопедия, 1990. — Т. 3. — ISBN 5-85270-008-8.
- ↑ 1 2 3 Карякин Ю. В. Чистые химические реактивы. Руководство по лабораторному приготовлению неорганических препаратов. — 2-е изд. — М.—Л.: ГХИ, 1947. — С. 343. — 577 с.
- ↑ Полянский Н. А., Кожевник С. Н. Очистка соединений меди от примесей. Приготовление сульфата меди высокой чистоты // Сборник лабораторных работ. — Норильск, 1998.
- ↑ Вассерман И. М. Производство минеральных солей. — Издание 2-е изд., перераб. и доп.. — Ленинград: Госхимиздат. Ленингр. отд-ние, 1962. — 439 с.: ил. с. Архивная копия от 26 июля 2020 на Wayback Machine
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.—М.: Химия, 1963. — Т. 2. — С. 124—125, 265. — 1168 с. — 20 000 экз. Архивная копия от 16 октября 2012 на Wayback Machine
- ↑ Получение нерастворимых оснований. Единая коллекция ЦОР. Дата обращения: 26 апреля 2017. Архивировано 26 апреля 2017 года.
- ↑ Сельскохозяйственное водоснабжение и обводнение. — Колос. — М., 1984.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 19347-2014 Купорос медный. Технические условия (Издание с поправкой)
- ↑ name=https://www.safework.ru Архивная копия от 8 марта 2022 на Wayback Machine
- ↑ Copper Sulfate (англ.). Pesticide Management Education Program (PMEP). Cornell University (декабрь 1993). Дата обращения: 26 апреля 2017. Архивировано 5 июля 2019 года.
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
ГДЗ (готовое домашние задание из решебника) на Вопрос №1, § 15 по учебнику Химия. 8 класс: учебник для общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. 4 издание. Просвещение, 2016-2021г.
Условие
1. Вычислите относительную молекулярную массу сульфата меди CuSO4.
M(CuSO4)=Ar(Cu)+Ar(S)+4Ar(O)=64+32+4·16=160
Решение 1
Подробное решение

Белый фонпереписывать в тетрадь
Цветной фонтеория и пояснения
Другие задачи из этого учебника
Популярные решебники
Ваше сообщение отправлено
и скоро будет рассмотрено







![{displaystyle {mathsf {2CuSO_{4}{xrightarrow[{}]{^{o}t}}2CuO+2SO_{2}+O_{2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30ce2fce7426159cad7b80889c0718c4c74c6351)
















