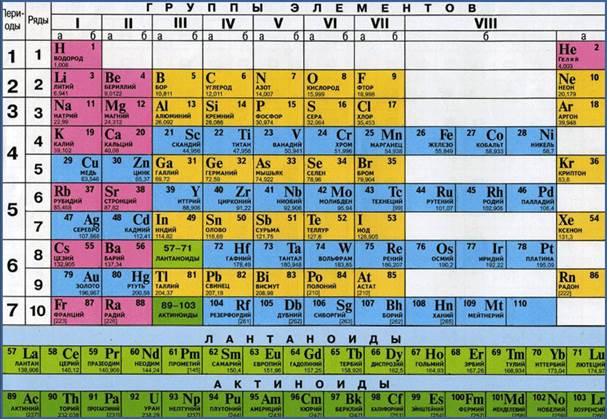
Если
посмотреть в периодическую таблицу Д. И. Менделеева, то можно заметить, что все
элементы в ней расположены в клетках. В таких клетках изображён знак
химического элемента, его название. Вверху клетки указан порядковый, или
атомный, номер. Над символом элемента – его название.
Например,
рассмотрим клетку, где расположен элемент сера. Здесь указано название
элемента, его символ. Вверху стоит число 16. А что же обозначает нижнее число
32,064?
Это
число называется относительной атомной массой. Как известно, важным
свойством атомов является их масса, она выражается в граммах, киллограммах, миллиграммах.
Ещё в девятнадцатом веке, когда все учёные наконец-то приняли
атомно- молекулярное учение (то есть было доказано, что вещества состоят
из молекул и атомов), были рассчитаны атомные массы химических элементов.
Эти массы оказались очень маленькими. Это и понятно, ведь атомы
настолько малы, что их не увидишь даже в самые мощные микроскопы.
Для
удобства массы атомов химических элементов сравнивают с массой атома самого
лёгкого химического элемента – водорода. Масса атома водорода равна 1. Поэтому
можно сказать, что масса атома серы в 32 раза больше массы атома водорода.
То
есть относительная атомная масса – это величина, которая показывает, во
сколько раз масса атома данного химического элемента больше массы атома
водорода.
Относительную
атомную массу обозначают символом Ar, где буква r – это первая буква английского слова
relative,
что означает «относительный».
Все
значения относительных атомных масс округляют до целого значения по всем
правилам округления. Единственным исключением является элемент хлор, у которого
относительная атомная масса равна 35,5. Так, относительная атомная масса
кислорода – 16, азота – 14, углерода – 12, железа – 56, меди – 64, фтора – 19,
алюминия – 27, цинка – 65, фосфора – 31, брома – 80.
Как
вы могли заметить, относительная атомная масса является безразмерной
величиной.
Как
и атомы, молекулы обладают массой. Для того, чтобы найти их массу, нужно
сложить массы всех атомов, которые входят в состав молекулы.
То
есть относительная молекулярная масса – это сумма относительных атомных
масс атомов, входящих в состав молекул.
Например,
определим относительную молекулярную массу воды – Н2О. Для этого
относительную атомную массу водорода умножаем на 2, так как в молекуле 2 атома
водорода, на что нам указывает индекс. Затем складываем относительную атомную
массу водорода с относительной атомной массой кислорода. Подставляем значения и
получаем результат – 18.
Mr
(H2O) = Ar (H) · 2 + Ar (O) = 1 · 2 + 16 = 18
Понятие
«относительная молекулярная масса» справедливо только для веществ молекулярного
строения, если же вещество состоит из атомов или ионов, тогда вместо
относительной молекулярной массы говорят об относительной формульной массе.
Определим
относительную молекулярную массу углекислого газа – СО2. Для этого
относительную атомную массу углерода складываем с относительной атомной массой
кислорода, умноженной на два, так как в молекуле 2 атома кислорода. Подставляем
значения относительных атомных масс: 12 складываем с 32 и получаем 44.
Mr
(CO2)
= Ar
(C)
+ Ar
(O)
· 2 = 12 + 16 · 2 = 44
Найдём
относительную формульную массу NaNO3.
Для этого относительную атомную массу натрия складываем с относительной атомной
массой азота и относительной атомной массой кислорода, умноженной на три.
Подставляем значения относительных атомных масс и получаем 85.
Mr
(NaNO3)
= Ar
(Na)
+ Ar
(N)
+ Ar
(O)
· 3 = 23 + 14 + 16 · 3 = 85
Содержание:
- § 1 Из чего складывается масса вещества
- § 2 Атомная единица массы
- § 3 Относительная атомная масса
- § 4 Относительная молекулярная масса
§ 1 Из чего складывается масса вещества
Любое тело имеет массу. Возьмем такое тело как, например, мешок яблок. Это тело имеет массу. Его масса будет складываться из массы каждого яблока в мешке. Мешок риса тоже имеет свою массу, которая определяется путем сложения массы всех рисовых зернышек, хотя они очень маленькие и легкие.
Все тела состоят из веществ. Масса тела складывается из массы составляющих его веществ. Вещества, в свою очередь, состоят из частиц, молекул или атомов, следовательно, частицы вещества тоже имеют массу.
§ 2 Атомная единица массы
Если выразить массу самого легкого атома водорода в граммах, то получим очень сложное для дальнейшей работы число
1,66 ∙10-24г.
Масса атома кислорода примерно в шестнадцать раз больше и составляет 2,66∙10-23г, масса атома углерода 1,99∙10-23г. Масса атома обозначается – ma.
Производить расчеты с такими числами неудобно.
Для измерения атомных (и молекулярных) масс применяют атомную единицу массы (а.е.м.).
Атомная единица массы – это 1/12 массы атома углерода.
В таком случае, масса атома водорода будет равна 1 а.е.м., масса атома кислорода – 16 а.е.м., а масса атома углерода – 12 а.е.м.
Химики долгое время не имели ни малейшего представления о том, сколько весит один атом какого-либо элемента в привычных и удобных для нас единицах измерения массы (грамм, килограмм и т. д.).
Поэтому первоначально задача определения атомных масс была изменена.
Были предприняты попытки определить, во сколько раз атомы одних элементов тяжелее других. Таким образом, учёные стремились сопоставить массу атома одного элемента с массой атома другого элемента.
Решение этой задачи также было сопряжено с большими трудностями, и прежде всего с выбором эталона, т. е. того химического элемента, относительно которого следовало проводить сравнение атомных масс остальных элементов.
§ 3 Относительная атомная масса
Учёные XIX столетия решили эту проблему на основании экспериментальных данных по определению состава веществ. В качестве эталона был взят самый лёгкий атом – атом водорода. Экспериментально, было установлено, что атом кислорода в 16 раз тяжелее атома водорода, т. е. его относительная масса (относительно массы атома водорода) равна 16.
Эту величину условились обозначать буквами Ar (индекс «r» – от начальной буквы английского слова «relative» –относительный). Таким образом, запись значения относительных атомных масс химических элементов должна выглядеть следующим образом: относительная атомная масса водорода равна 1, относительная атомная масса кислорода равна 16, относительная атомная масса углерода равна 12.
Относительная атомная масса показывает, во сколько раз масса атома одного химического элемента больше массы атома, являющегося эталоном, поэтому данная величина не имеет размерности.
Как уже говорилось, первоначально значения атомных масс определяли по отношению к массе атома водорода. Позже эталоном для определения атомных масс стала 1/12 часть массы атома углерода (атом углерода в 12 раз тяжелее атома водорода).
Относительная атомная масса элемента (Ar) – это отношение массы атома химического элемента к 1/12 массы атома углерода.
Значения атомных масс химических элементов приведены в Периодической системе химических элементов Д.И. Менделеева. Взгляните на периодическую таблицу и рассмотрите любую ее клетку, например, под номером 8.
Под химическим знаком и названием в нижней строке указывается значение атомной массы химического элемента: относительная атомная масса кислорода равна 15,9994. Обратите внимание: относительные атомные массы почти всех химических элементов имеют дробное значение. Причиной этого является существование изотопов. Напомню, что изотопами называют атомы одного и того же химического элемента, незначительно отличающиеся по массе.
В школе в расчётах обычно используют значения относительных атомных масс, округленные до целых чисел. Но в нескольких случаях пользуются дробными величинами, например: относительная атомная масса хлора равна 35,5.
§ 4 Относительная молекулярная масса
Из масс атомов складывается масса молекулы.
Относительной молекулярной массой вещества называется число, показывающее, во сколько раз масса молекулы этого вещества больше 1/12 массы атома углерода.
Относительная молекулярная масса обозначается – Mr
Относительную молекулярную массу веществ рассчитывают по химическим формулам, выражающим состав веществ. Для нахождения относительной молекулярной массы надо суммировать значения относительных атомных масс элементов, входящих в состав молекулы вещества, с учётом количественного состава, т. е. числа атомов каждого элемента (в химических формулах оно выражается с помощью индексов). Например, относительная молекулярная масса воды, имеющей формулу H2O, равна сумме двух значений относительной
атомной массы водорода и одного значения относительной атомной массы кислорода:
Относительная молекулярная масса серной кислоты, имеющей формулу H2SO4, равна сумме
двух значений относительной атомной массы водорода, одного значения относительной атомной массы серы и четырех значений относительной атомной массы кислорода: .
Относительная молекулярная масса – величина безразмерная. Ее не следует путать с истинной массой молекул, выражаемой в атомных единицах массы.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Как найти молекулярную массу вещества видеоурок
Как найти молекулярную массу
Количество вещества. Молярная масса | Химия 8 класс #16 | Инфоурок
Химия | Относительная атомная и молекулярная масса
Главная > Химия 8 класс > Молярная масса МОЛЬ
Молярная масса МОЛЬ – видеоурок
На этом видеоуроке по химии и физике по учебнику Габриеляна объясняются понятия и темы: относительной молекулярной массы; молярная масса вещества; постоянной Авагадро; решаются задачи по нахождению молярной массы вещества
Атомная масса химических элементов крайне мала.
Водород является наиболее легким элементом. Его атомная масса составляет
m(Н) = 0, 000 000 000 000 000 000 000 000 001 663 г = 1,663*10-27 кг
Уран признан самым тяжелым элементом. Значение его атомной массы соответствует
m(U) = 0, 000 000 000 000 000 000 000 395 г = 3,95*10-22 кг
Массы атомов остальных элементов из периодической системы также крайне малы
| Наименование химического элемента | Обозначение | Абсолютная атомная масса, кг | Относительная атомная масса |
| водород | H | 1,663*10-27 | 1 |
| уран | U | 3,95*10-22 | 238 |
| кислород | O | 26,6*10-27 | 16 |
| сера | S | 53,2*10-27 | 32 |
| алюминий | Al | 44,79*10-27 | 27 |
| углерод | C | 19,93*10-27 | 12 |
| железо | Fe | 93*10-27 | 56 |
Записывать и потом считывать такие значения затруднительно. В связи с этим для определения атомной массы была разработана единая система. Для вычисления этих показателей используются относительные единицы — атомные единицы массы.
Атомная единица массы (1a.e.m.) равняется одной двенадцатой доли массы атома углерода
1a.e.м. = m(C) = 1.667*10-27 кг
Определение относительной массы атома
Относительную атомную массу обозначают Ar, при этом r является первой буквой английского слова «reletive», которое переводится как «относительный». Следовательно, если данная величина относительна, она не обладает единицами измерения.
Относительная атомная масса — безмерная величина, равная отношению средней массы атома конкретного элемента к одной двенадцатой части массы атома углерода mam
Ar = =
Показатель относительной атомной массы можно узнать из периодической системы. Для удобства вычислений при подсчете их округляют до целой единицы.
Вспомним правила округления
Если в числе после запятой расположена цифра менее 5, число сохраняется неизменным. Если после запятой располагается цифра 5 и более, число повышается на одну единицу.
В периодической системе относительная атомная масса железа указана как 55,847. Применяя правило округления, получается, что данная величина равняется 56.
Относительная атомная масса меди равняется 63,546, если округлить, то получается число 64.
Относительная масса атома свинца составляет 207,19, а при округлении эта величина равна 207.
Лишь атомная масса хлора не попадает под эти правила. Эта величина согласно периодической системе составляет 35,453, а при округлении получает число 35,5.
Относительная молекулярная масса
Посмотрим, как находиться относительная молекулярная масса вещества. Эта величина обозначается буквой Mr, где r свидетельствует о ее относительности, то есть безмерности.
Относительная молекулярная масса равняется суммарному значению относительных атомных масс всех химических элементов, присутствующих в составе конкретной молекулы с учетом их количества атомов.
Mr = ,
где количество атомов отдельного элемента,
— относительная атомная масса конкретного элемента, присутствующего в структуре молекулы.
Необходимо рассчитать значение относительной молекулярной массы воды. Молекула вещества содержит атом водорода, в количестве двух штук, и атом кислорода. Молекулярная масса воды рассчитывается как результат сложения относительных атомных масс водорода и кислорода с учетом их индексов.
Получаем
Mr(Н2О) = n(H)*Ar(H) + n(O)*Ar(O)
Mr(Н2О) = 2 х 1 + 1 х 16 = 18
Молекулярная масса воды равняется 18.
Вычислите, во сколько раз масса кислорода превышает массу водорода (самого легкого элемента).
Атом кислорода тяжелее атома водорода в 16 раз.
= 16
По аналогии, атом углерода превышает массу атома водорода в 12 раз
= 12
Масса молекулы воды больше массы атома водорода в 18 раз
= 18
Эти величины наглядно показывают во сколько раз масса атома конкретного химического элемента превышает массу атома водорода.
Химическая формула заключает в себе основную информацию о веществе. К примеру, формула углекислого газа (CO2) представляет такую информацию:
- вещество — углекислый газ
- качественный состав — в структуре присутствует 2 элемента — углерод и кислород
- тип вещества — сложное вещество
- количественный состав — одна молекула включает атом углерода и атом кислорода, в количестве двух штук.
- относительная молекулярная масса углекислого газа составляет —
Mr(CO2) = 1*12 + 2*16 = 44