Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.

Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь

Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.

Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.

Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.

Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).

Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В

При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;

– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.

В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.

Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:

Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.

Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:

Металлическая химическая связь

Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.

Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
398
Создан на
07 января, 2022 От Admin

Тренировочный тест “Химические связи”
1 / 10
Из предложенного перечня выберите два вещества, в которых есть связи, образованные по донорно-акцепторному механизму.
1) нитрат аммония
2) аммиак
3) тетрагидроксоцинкат калия
4) кислород
5) фтороводород
2 / 10
Из предложенного перечня выберите два вещества, которые имеют ионную кристаллическую решётку.
1) Na2CO3
2) HBr
3) SO2
4) PCl3
5) (NH4)2SО4
3 / 10
Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную неполярную химическую связь.
1) ацетиленид натрия
2) бром
3) алмаз
4) гидроксид натрия
5) оксид кремния(IV)
4 / 10
Из предложенного перечня выберите два вещества, в которых присутствует и ионная, и ковалентная химическая связь.
1) хлорид фосфора(III)
2) серная кислота
3) фосфат калия
4) сульфат аммония
5) аммиак
5 / 10
Из предложенного перечня веществ выберите два соединения, в которых одна из ковалентных связей образована по донорно-акцепторному механизму.
1) K3PO4
2) NH4HSO4
3) H2SO4
4) KOH
5) NH4CI
6 / 10
Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную неполярную химическую связь.
1) пероксид водорода
2) ацетон
3) кремний
4) фенолят натрия
5) медь
7 / 10
Из предложенного перечня выберите два соединения, между молекулами каждого из которых образуется водородная связь.
1) HCOOCH3
2) HCOOH
3) HF
4) HCHO
5) CH4
8 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная связь.
1) фторид серы(VI)
2) оксид бария
3) фторид натрия
4) сульфат магния
5) ромбическая сера
9 / 10
Из предложенного перечня выберите два вещества, в которых есть водородные связи.
1) Na2SO4
2) H2
3) CH3OH
4) C6H5NH2
5) NaH
Запишите номера выбранных ответов.
10 / 10
Из предложенного перечня выберите два вещества с атомной кристаллической решёткой.
1) сульфид бария
2) ромбическая сера
3) оксид кремния
4) гидроксид калия
5) карбид кремния
Ваша оценка
The average score is 43%
Молекулярная связь
Cтраница 1
Молекулярная связь ( или связь Ван-дер – Ваальса) возникает вследствие смещения электрических зарядов в молекулах и атомах и появления слабого электрического притяжения. Этот тип межатомной связи характерен для инертных газов с завершенными электронными оболочками.
[1]
Молекулярная связь возникает в кристаллах, образованных отдельными молекулами того или иного вещества. Она характеризуется промежутками между молекулами с нулевой электронной плотностью. В молекулярных кристаллах силы, связывающие атомы в молекулы, значительны, а связь между молекулами, которые притягиваются одна к другой лишь силами межмолекулярного притяжения ( ван-дер-ваальсовыми силами), – слабая. Поэтому связи между молекулами разрушаются при нагревании много легче, чем между атомами в молекулах.
[2]
Молекулярная связь имеет три основные разновидности: ориентаци-онную, индукционную и дисперсионную. Химическая связь имеет две основные разновидности: гетерополярную ( ионную) и гомеопо-лярную ( ковалентную) связи.
[3]
Молекулярная связь при металлизации ослабляется из-за неблагоприятных условий смачивания, поскольку не все частицы, попадающие на металлизируемую деталь, обладают одинаковой кинетической энергией и температурой. При этом деформация частиц и степень их пластичности различны.
[4]
Молекулярная связь между прирабатываемыми поверхностями может возникать при появлении между молекулами сил притяжения электрического происхождения. Хотя молекула и является эмпирически нейтральной как целое, она все же обладает определенным электрическим моментом, если ее рассматривать как диполь. При достаточно малых расстояниях между диполями возникает взаимное притяжение противоположно заряженных концов.
[5]
Молекулярная связь обусловлена различными видами взаимодействий – дисперсионным, ориентационным, индукционным, а также отталкиванием между заполненными электронными оболочками атомов молекул.
[6]
Молекулярная связь ( связь Ван-дер – Ваальса) осуществляется за счет смещения электрических зарядов в молекулах и атомах и возникновения слабого электрического притяжения. В наиболее чистом виде она проявляется у инертных газов, имеющих завершенные электронные, оболочки.
[7]
Молекулярная связь играет особенно большую роль в органических кристаллах. Энергия связи молекулярных кристаллов мала, и поэтому температуры плавления и кипения соответствующих веществ низки.
[8]
Молекулярная связь ( связь Ван-дер – Ва-альса) осуществляется за счет смещения электрических зарядов в молекулах и атомах и возникновения слабого электрического притяжения. В наиболее чистом виде она проявляется у инертных газов, имеющих завершенные электронные оболочки.
[9]
Молекулярная связь возникает вследствие взаимодействия диполей. Она менее прочна, чем связи, рассмотренные выше.
[10]
Молекулярная связь ( или связь Ван-дер – Ваальса) возникает вследствие смещения электрических зарядов в молекулах и атомах и появления слабого электрического притяжения. Этот тип межатомной связи характерен для инертных газов с завершенными электронными оболочками.
[11]
Молекулярная связь характерна для атомов с относительно легко деформируемыми электронными оболочками и для объединившихся в молекулы атомов, также способных к деформации внешних объединенных оболочек. Это взаимодействие определяет отклонение свойств реальных газов от идеальных, структуру и свойства молекулярных кристаллов и жидкостей и др. Молекулярная связь менее прочна, чем рассмотренная выше химическая, и вещества с такой связью имеют более низкие температуры плавления и сублимации.
[12]
Примеры молекулярной связи могут быть найдены в кристаллах многих органических соединений, а также в решетках хлоридов многовалентных металлов.
[13]
Прочность молекулярной связи на сдвиг т0 и пьезокоэффициент упрочнения молекулярной связи р пары трения, ввиду отсутствия расчетных методов, определяются экспериментально.
[14]
Для молекулярной связи типа Ван-дер – Ваальса, существующей, например, в жидких и твердых инертных газах, наблюдаются аналогичные линейные зависимости между температурами и теплотами кипения и плавления.
[15]
Страницы:
1
2
3
4
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Предпосылки возникновения метода
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом валентных связей.
Рассмотрим некоторые из них.
Основное положение метода валентных связей состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двух-электронных облаков). Но это не всегда так. В ряде случаев в
образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н 2+ одноэлектронная связь. Метод валентных связей образование одноэлектронной связи объяснить не может,
она противоречит его основному положению.
Метод валентных связей не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле, так как неспаренный электрон
создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с
параллельной ориентацией спинов, что противоречит методу валентных связей. Необходимо также отметить, что метод валентных связей не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей.
Основные положения метода
Согласно методу молекулярных орбиталей электроны в молекулах распределены по молекулярным орбиталям, которые подобно атомным орбиталям характеризуются определенной энергией (энергетическим уровнем) и
формой. В отличие от атомных орбиталей молекулярные орбитали охватывают не один атом, а всю молекулу, т.е. являются двух- или многоцентровыми. Если в методе валентных связей атомы молекул сохраняют
определенную индивидуальность, то в методе молекулярных орбиталей молекула рассматривается как единая система.
Наиболее широко в методе молекулярных орбиталей используется линейная комбинация атомных орбиталей. При этом соблюдается несколько правил:
- Число молекулярных орбиталей равно общему числу атомных орбиталей, из которых комбинируются молекулярные орбитали.
- Электроны в молекуле, как и в атоме, занимают соответствующие орбитали, которые характеризуются своим набором квантовых чисел.
- Энергия одних молекулярных орбиталей оказывается выше, других – ниже энергии исходных атомных орбиталей. Средняя энергия молекулярных орбиталей, полученных из набора атомных орбиталей,
приблизительно совпадает со средней энергией этих атомных орбиталей. - Для молекул, образованных атомами одного химического элемента (гомоядерных), выигрыш в энергии за счет образования связывающей орбитали компенсируется повышением энергии разрыхляющей орбитали.
На энергетической диаграмме обе орбитали располагаются симметрично относительно атомных орбиталей. - В гетероядерных (разноэлементных) молекулах связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома (В), а разрыхляющие – ближе к орбитали менее
электроотрицательного атома (А). Разность в энергиях исходных атомных орбиталей (b) равна полярности связи. Эта разность является мерой ионности связи, а разность в энергиях между связывающей
орбиталью и атомной орбиталью более электроотрицательного атома определяет ковалентность связи. - Вся молекула рассматривается как единое целое, состоящее из ядер (бывших атомов) и электронов (ранее принадлежавших атомам).
- Электроны заполняют молекулярные орбитали, как и атомные орбитали, в порядке возрастания энергии, при этом соблюдается принцип запрета Паули и правило Гунда.
- Все электроны являются общими для всех ядер, т.е. химические связи являются многоцентровыми и каждая связь простирается между всеми ядрами в той или иной степени. Таким образом, двухцентровая
связь представляет собой лишь частный случай многоцентровой химической связи. - Наиболее эффективно комбинируются атомные орбитали с теми атомными орбиталями, которые характеризуются сопоставимыми энергиями и соответствующей симметрией.
- Прочность связи в методе молекулярных орбиталей пропорциональна степени перекрывания атомных орбиталей.
- Кратность химической связи равна половине разности числа электронов, расположенных на связывающих орбиталях, и числа электронов на разрыхляющих.
- Состояние электронов в молекуле описывается решением соответствующего уравнения Шредингера для молекулярной системы.


Уравнение Шредингера для молекулярной системы должно состоять из члена кинетической энергии и члена потенциальной энергии сразу для всех электронов. Но решение одного уравнения с таким большим
количеством переменных (индексы и координаты всех электронов) невозможно, поэтому вводится понятие одноэлектронного приближения.
Одноэлектронное приближение предполагает, что можно рассматривать каждый электрон движущимся в поле ядер и усредненном поле остальных электронов молекулы. Это означает, что каждый i-й электрон в
молекуле описывается своей собственной функцией ψi и имеет свою собственную энергию Ei. В соответствии с этим, для каждого электрона в молекуле можно составить свое
уравнение Шредингера. Тогда для n электронов необходимо решить n уравнений. Это осуществляется методами матричного исчисления с помощью компьютеров.
При решении уравнения Шредингера для многоцентровой и многоэлектронной системы получаются решения в виде одноэлектронных волновых функций – молекулярных орбиталей, их энергий и электронной энергии всей
молекулярной системы как целого.
Линейная комбинация атомных орбиталей
В одноэлектронном приближении метод молекулярных орбиталей описывает каждый электрон своей орбиталью. Как в атоме есть атомные орбитали, так и в молекуле есть молекулярные орбитали. Различие заключается
в том, что молекулярные орбитали – многоцентровые.
Рассмотрим электрон, расположенный на молекулярной орбитали ψi нейтральной молекулы, в тот момент времени, когда он находится вблизи ядра некоторого атома m. В этой области
пространства потенциальное поле создается, в основном, ядром атома m и находящимися вблизи электронами. Поскольку молекула в целом нейтральна, притяжение между рассматриваемым электроном и каким-либо
другим ядром n приблизительно компенсируется отталкиванием между рассматриваемым электроном и электронами, находящимися вблизи ядра n. Значит, вблизи ядра движение электрона будет приближенно
таким же, как и в отсутствие остальных атомов. Поэтому в орбитальном приближении молекулярная орбиталь ψi вблизи ядра m должна быть похожа на одну из атомных орбиталей этого
атома. Поскольку атомная орбиталь имеют существенные значения только вблизи своих ядер, можно приблизительно представить молекулярную орбиталь ψi в виде линейной комбинации атомных
орбиталей отдельных атомов.
Для простейшей молекулярной системы, состоящей из двух ядер атомов водорода, учитывая 1s-атомные орбитали , описывающие движение электрона в атоме Н, молекулярная орбиталь представляется
в виде:

Величины c1i и c2i – численные коэффициенты, которые и находятся решением уравнения Шредингера. Они показывают вклад каждой атомной орбитали в конкретную
молекулярную орбиталь. В общем случае коэффициенты принимают значения, лежащие в интервале от -1 до +1. Если в выражении для конкретной молекулярной орбитали один из коэффициентов преобладает, то это
отвечает тому, что электрон, находясь на данной молекулярной орбитали, в основном находится вблизи того ядра и описывается в основном именно той атомной орбиталью, чей коэффициент больше. Если коэффициент
перед атомной орбиталью близок к нулю, то это означает, что пребывание электрона в области, описываемой данной атомной орбиталью маловероятно. По физическому смыслу квадраты данных коэффициентов определяют
вероятность нахождения электрона в области пространства и энергий, описываемых данной атомной орбиталью.

В методе ЛКАО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того,
нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание
электронных облаков. При сложении атомных орбиталей образуется молекулярная орбиталь, энергия которой понижается относительно энергий атомных орбиталей. Такая молекулярная орбиталь называется
связывающей. Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между
ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей. Электронная плотность
в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и
разрыхляющей орбиталей.
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных
орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей.
Классификация орбиталей
Классификация орбиталей на σ или π производится в соответствии с симметрией их электронных облаков. σ-орбиталь имеет такую симметрию электронного облака, при которой
поворот ее вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае π-орбитали при повороте ее на
180° знак волновой функции меняется на противоположный. Отсюда следует, что s-электроны атомов при взаимодействии между собой могут образовывать только σ-орбитали, а три (шесть)
p-орбитали атома – одну σ- и две π-орбитали, причем σ-орбиталь возникает при взаимодействии рх атомных орбиталей, а π-орбиталь – при
взаимодействии рy и рz. Молекулярные π-орбитали повернуты относительно межьядерной оси на 90°.

Для того чтобы отличать связывающие и разрыхляющие орбитали друг от друга, а также их происхождение, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением «св»,
располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая – соответственно «разр». Принято еще одно обозначение: звездочкой помечаются разрыхляющие орбитали, а без
звездочки – связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, πразр2py.
Это означает, что молекулярная орбиталь π-типа, разрыхляющая, образовалась при взаимодействии 2рy – атомных орбиталей.
Положение атомной орбитали на шкале энергий определяется значением энергии ионизации атома, отвечающей удалению электрона, описываемого данной орбиталью, на бесконечно большое расстояние. Такая энергия
ионизации называется орбитальной энергией ионизации. Так, для атома кислорода возможны типы ионизации, когда удаляется электрон с 2р– или с 2s-электронной подоболочки.
Положение молекулярной орбитали энергетических диаграммах также определяется на основании квантово-химических расчетов электронной структуры молекул. Для сложных молекул число энергетических уровней
молекулярных орбиталей на энергетических диаграммах велико, однако для конкретных химических задач часто важно знать энергии и состав не всех молекулярных орбиталей, а только наиболее «чувствительных» к
внешним воздействиям. Такими орбиталями являются молекулярные орбитали, на которых размещены электроны самых высоких энергий. Эти электроны могут легко взаимодействовать с электронами других молекул,
удаляться с данной молекулярной орбитали, а молекула будет переходить в ионизированное состояние или видоизменяться вследствие разрушения одних или образования других связей. Такой молекулярной орбиталью
является высшая занятая молекулярная орбиталь. Зная число молекулярных орбиталей (равно суммарному числу всех атомных орбиталей) и число электронов, нетрудно определить порядковый номер
ВЗМО и, соответственно, из данных расчета – ее энергию и состав. Также наиболее важной для изучения химических задач является низшая свободная
молекулярная орбиталь, т.е. следующая по очереди за ВЗМО на шкале энергий, но вакантная молекулярная орбиталь. Важны и другие орбитали, прилегающие
по энергии к ВЗМО и НСМО.
Молекулярные орбитали в молекулах, как и атомные орбитали в атомах, характеризуются не только относительной энергией, но и определенной суммарной формой электронного облака. Аналогично тому, как в
атомах имеются s-, р-, d-, … орбитали, самая простая молекулярная орбиталь, обеспечивающая связь между только двумя центрами (двухцентровая молекулярная орбиталь), может быть
σ-, π-, δ-, … типа. Молекулярные орбитали разделяются на типы в зависимости от того, какой симметрией они обладают относительно линии, соединяющей ядра атомов
относительно плоскости, проходящей через ядра молекулы и др. Это приводит к тому, что электронное облако молекулярной орбитали различным образом распределяется в пространстве.
Физический смысл метода
Для любой другой системы, включающей k атомных орбиталей, молекулярная орбиталь в приближении метода ЛКАО запишется в общем виде
следующим образом:

Для уяснения физического смысла такого подхода вспомним, что волновая функция Ψ соответствует амплитуде волнового процесса, характеризующего состояние электрона. Как известно, при взаимодействии,
например, звуковых или электромагнитных волн их амплитуды складываются. Как видно, приведенное уравнение разложения молеклярной орбитали на составляющие атомные орбитали равносильно предположению, что
амплитуды молекулярной «электронной волны» (т. е. молекулярная волновая функция) тоже образуются сложением амплитуд взаимодействующих атомных «электронных волн» (т. е. сложением атомных волновых функций).
При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого атомного электрона изменяется по сравнению с исходной волновой функцией этого электрона в
изолированном атоме. В методе ЛКАО эти изменения учитываются путем введения коэффициентов ciμ, где индекс i определяет
конкретную молекулярную орбиталь, а индекс cμ – конкретную атомную орбиталь. Так что при нахождении молекулярной волновой функции складываются не исходные, а измененные амплитуды –
ciμ·ψμ.

Выясним, какой вид будет иметь молекулярная волновая функция Ψ1, образованная в результате взаимодействия волновых функций ψ1 и ψ2 –
1s-орбиталей двух одинаковых атомов. Для этого найдем сумму c11·ψ1 + c12·ψ2. В данном случае оба рассматриваемых атома
одинаковы, так что коэффициенты c11 и c12 равны по величине (c11 = c12 = c1) и задача сводится к определению суммы
c1·(ψ1 + ψ2). Поскольку постоянный коэффициент c1 не влияет на вид искомой молекулярной волновой функции, а только изменяет ее
абсолютные значения, ограничимся нахождением суммы (ψ1 + ψ2). Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r), на котором
они находятся в молекуле, и изобразим волновые функции 1s-орбиталей этих атомов (рисунок а).
Чтобы найти молекулярную волновую функцию Ψ1, сложим величины ψ1 и ψ2: в результате получится кривая, изображенная на (рисунке б).
Как видно, в пространстве между ядрами значения молекулярной волновой функции Ψ1 больше, чем значения исходных атомных волновых функций. Но квадрат волновой функции характеризует
вероятность нахождения электрона в соответствующей области пространства, т. е. плотность электронного облака. Значит, возрастание Ψ1 в сравнении с ψ1 и
ψ2 означает, что при образовании молекулярной орбиталли плотность электронного облака в межъядерном пространстве увеличивается. В результате образуется химическая связь. Поэтому
молекулярная орбиталь рассматриваемого типа называется связывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся молекулярная орбиталь относится к σ-типу. В соответствии с этим, связывающая
молекулярная орбиталь, полученная в результате взаимодействия двух атомных 1s-орбиталей, обозначается σ1sсв.
Электроны, находящиеся на связывающей молекулярной орбитали, называются связывающими электронами.

Рассмотрим другую молекулярную орбиталь Ψ2. По причине симметрии системы следует предположить, что коэффициенты перед атомными орбиталями в выражении для молекулярной орбитали
Ψ2 = c21·ψ1 + c22·ψ2 должны быть равны по модулю. Но тогда они должны отличаться друг от друга знаком:
c21 = – c22 = c2.
Значит, кроме случая где знаки вкладов обеих волновых функции одинаковы, возможен и случай, когда знаки вкладов 1s-атомных орбиталей различны. В таком случае (рисунок (а))вклад
1s-атомной орбитали одного атома положителен, а другого – отрицателен. При сложении этих волновых функций получится кривая, показанная на рисунке (б). Молекулярная орбиталь, образующаяся
при подобном взаимодействии, характеризуется уменьщением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи появляется даже узловая
точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между
атомами. В результате притяжение каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т.е. возникнут силы, приводящие к взаимному
отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае молекулярная орбиталь называется разрыхляющей
σ1s* , а находящиеся на ней электроны – разрыхляющими электронами.
Переход электронов с атомных 1s-орбиталей на связывающую молекулярную орбиталь, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход электронов с
атомных 1s-орбиталей на разрыхляющую молекулярную орбиталь требует затраты энергии. Следовательно, энергия электронов на орбитали σ1sсв
ниже, а на орбитали σ1s* выше, чем на атомных 1s-орбиталях. Приближенно можно считать, что при переходе 1s-электрона на
связывающую молекулярную орбиталь выделяется столько же энергии, сколько необходимо затратить для его перевода на разрыхляющую молекулярную орбиталь.
Порядок связи
В методе молекулярных орбиталей для характеристики электронной плотности, ответственной за связывание атомов в молекулу вводится величина – порядок связи. Порядок связи, в отличие от кратности
связи, может принимать нецелочисленные значения. Порядок связи в двухатомных молекулах принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона
соответствуют простой связи, четыре связывающих электрона – двойной связи и т. д. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов. Так, если в молекуле
имеются 6 связывающих и 2 разрыхляющих электрона, то избыток числа связывающих электронов над числом разрыхляющих равен четырем, что соответствует образованию двойной связи. Следовательно, с позиции
метода молекулярных орбиталей химическую связь в молекуле водорода, образованную двумя связывающими электронами, следует рассматривать как простую связь.
У элементов первого периода валентной орбиталью является 1s-орбиталь. Эти две атомных орбитали образуют две σ-молекулярные орбитали – связывающую и разрыхляющую. Рассмотрим
электронное строение молекулярного иона H2+. Он имеет один электрон, который будет занимать более энергетически выгодную s-связывающую
орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон, H2+ будет
обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: σ1sсв. Появление
второго электрона на s-связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности
связи повлечет за собой и увеличение энергии диссоциации молекулы H2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода.
Двухатомная молекула Не2 существовать не будет, так как имеющиеся у двух атомов гелия четыре электрона расположатся на связывающей и разрыхляющей орбиталях, что приводит к нулевой
кратности связи. Но в тоже время ион He2+ будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать
парамагнитными свойствами.

У элементов второго периода появляются еще четыре атомных орбитали: 2s, 2рх, 2ру, 2рz, которые будут принимать участие в образовании молекулярных орбиталей.
Различие в энергиях 2s– и 2p-орбиталей велико, и они не будут взаимодействовать между собой с образованием молекулярных орбиталей. Эта разница в энергиях при переходе от первого элемента к
последнему будет увеличиваться. В связи с этим обстоятельством электронное строение двухатомных гомоядерных молекул элементов второго периода будет описываться двумя энергетическими диаграммами,
отличающимися порядком расположения на них σсв2px и πсв2py,z. При относительной энергетической близости 2s– и 2p-орбиталей,
наблюдаемой в начале периода, включая атом азота, электроны, находящиеся на σразр2s и σсв2px-орбиталях, взаимно отталкиваются. Поэтому
πсв2py– и πсв2pz-орбитали оказываются энергетически более выгодными, чем σсв2px-орбиталь. На рисунке
представлены обе диаграммы. Так как участие 1s-электронов в образовании химической связи незначительно, их можно не учитывать при электронном описании строения молекул, образованных элементами
второго периода.
Второй период системы открывают литий и бериллий, у которых внешний энергетический уровень содержит лишь s-электроны. Для этих элементов схема молекулярных орбиталей ничем не будет отличаться от
энергетических диаграмм молекул и ионов водорода и гелия, с той лишь разницей, что у последних она построена из 1s-электронов, а у Li2 и Ве2 – из 2s-электронов.
1s-электроны лития и бериллия можно рассматривать как несвязывающие, т.е. принадлежащие отдельным атомам. Здесь будут наблюдаться те же закономерности в изменении порядка связи, энергии диссоциации
и магнитных свойств. Ион Li2+ имеет один неспаренный электрон, расположенный на σсв2s-орбитали – ион парамагнитен. Появление
второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер.

Третий s-электрон расположится на σразр-орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое
электронное строение имеет парамагнитный ион Be2+. Молекула Ве2, так же как и Hе2, существовать не может из-за
нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Ряд заканчивается нестабильной
молекулой Ne2. Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и
уменьшению межъядерного расстояния. Ионизация молекулы, сопровождаемая удалением связывающего электрона дает прямо противоположный эффект.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
Перед началом данной статьи хочу напомнить, что все материалы по химии, написанные мной, можно найти в данном каталоге.
Итак, я давно заметил, что для многих учащихся химии, понятие химической связи является чем-то непостижимым, ну а её виды и как научиться их различать – за гранью возможности понимания. Давайте по порядку.
Что такое химическая связь?
Это связь между атомами (химически неделимыми частицами), которая обуславливает целостность молекулы. То есть, возьмём какую-нибудь молекулу.
В ней есть атомы углерода, водорода и кислорода. Чёрточки на схеме показывают химические связи. Именно благодаря им атомы держат такую вот целостную структуру молекулы.
Это максимально упрощённое объяснение. Полное даётся в курсе квантовой химии. У кого есть желание – можете почитать. Моя же задача сделать это коротко и понятно, поэтому едем дальше.
Виды химической связи:
Существует всего 6 видов химической связи. Я объясню вам логику каждой из них и, на практических примерах, покажу где и почему это работает именно так.
Металлическая связь:
Металлическая связь, если совсем кратко, характеризуется наличием кристаллической решётки. Этот тип связи характерен для каждого металла. Ну а что есть металл? Вспоминаем школьный лайфхак:
Берём таблицу Менделеева, проводим диагональ от бора к астату, и всё, что ниже – это металлы. И да, в седьмом периоде только металлы. Все лантаноиды и актиноиды – тоже металлы.
Безусловно, металлическая связь делится ещё на подвиды. Тетрагональная, ромбоэдрическая и так далее. Но в школе такое не спрашивают, а студенты химических ВУЗов и без меня знают. Кому это надо будет – может дополнительно погуглить, или спросить в комментариях, тут я задерживаться не буду. Запомнили: вижу строго металл – связь металлическая.
Ковалентная связь:
А вот тут у всех возникает геморрой. Мало определить ковалентную связь. Она ж ещё бывает полярная и неполярная. Давайте разберёмся.
Начну с неполярной, потому что объяснить её проще некуда. У нас есть 2 атома неметалла, которые соединены между собой.
Скажем, хлорин, он же Cl2. Как и О2, F2 и другие молекулы, в которых связаны 2 одноимённых атома неметалла – это ковалентная неполярная.
Полярная же связь возникает у атомов с разной электроотрицательностью. И вот тут надо пояснить, что ковалентные связи возникают только среди неметаллов.
Перед вами молекула серной кислоты. В ней нет ни одной связи между одноимёнными неметаллами. При этом в серной кислоте металлов, всё-таки, нет. Вот вам самый явный пример ковалентной полярной связи. Конечно, тут ещё надо бы упомянуть про донорно-акцепторный механизм. Но это я оставлю на следующий раз.
Ионная связь:
Во-первых, ионная связь, по-научному, это связь элементов с большой разницей электроотрицательности. Большой считается разница более 1,7. Определяется по шкале Полинга. Она охватывает значения от 0,7 для франция, до 4,0 для фтора. Хотя, в апреле этого года были исследования, и есть вероятность, что скоро эта информация станет неактуальной. Ну, когда станет, тогда подредактирую)
Говоря же о школьных знаниях, то вполне достаточно запомнить: металл + неметалл = ионная связь. (И ещё амины с амидами: ЕГЭ очень любит на такое ловить).
Для примера возьмём сульфид алюминия. Алюминий – металл, сера…
Итого: ионная связь.
Водородная связь:
Строго говоря, водородная связь – это подвид ковалентной полярной связи. Ну, либо неполярной в молекуле H2. Выделение данного вида обусловлено ещё и тем, что водородная связь, помимо внутримолекулярной, может быть и межмолекулярной.
На данной диаграмме вы видите, что молекулы воды соединяются с помощью именно водородных связей. С внутримолекулярной всё малость сложнее. Тут нужно чтобы водород и электроотрицательный атом находились близко друг к другу, как в этих белках на схеме. Ну, либо варианты попроще.
2-гидробензальальдегид, этиленгликоль, дигидроксибензол и 2-аминофенол. Такие вещи уже больше относятся к органике и понять их можно только нарисовав структурную схему вещества. Понятное дело, что прочность такой связи очень мала, и в школьном курсе она почти ничего не решает. Но… Чем глубже в органику – тем важнее её эффект.
Ну и остались 2 типа связи, которые и в школе не проходят, да и в институте не сказать что. Поэтому объединю их в один раздел, просто для общего развития:
Силы Ван-дер-Ваальса и Двухэлектронная трёхцентровая связь:
Тут уже рил тёмный лес для обывателя. Силы Ван-дер-Ваальса объясняют возникновение дипольных моментов при поляризации атомов химического вещества. Где вам это понадобится в школе? Я более чем уверен, что нигде. Однако, забавный факт:
Именно благодаря силам Ван-дер-Ваальса, химическое вещество, выделяемое присосками геккона, позволяет ему карабкаться по стеклу. Объяснить, что там происходит, в двух словах, невозможно. А долгое разглагольствование – не наш сегодняшний формат – так что ловите ссылку.
Двухэлектронная трёхцентровая связь – это вообще вспомогательный тип. Появился он из-за того, что долгое время не могли понять: как трёхвалентный бор может образовать диборан? История об этом в данной статье.
Собственно, это всё. Можете задавать вопросы в комментариях, с радостью на них отвечу.
Записаться ко мне на бесплатное пробное занятие можно здесь. Либо написав мне на почту repetitorgns@yandex.ru .
Ну а так лайки и подписки приветствуются – до скорых встреч.
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.

Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
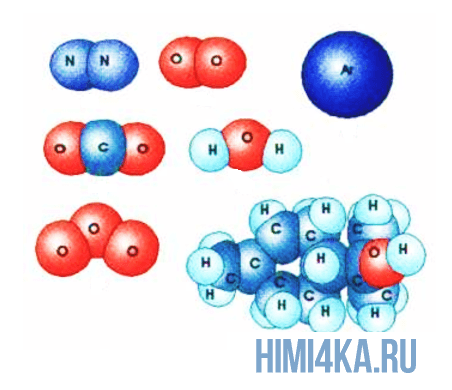
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
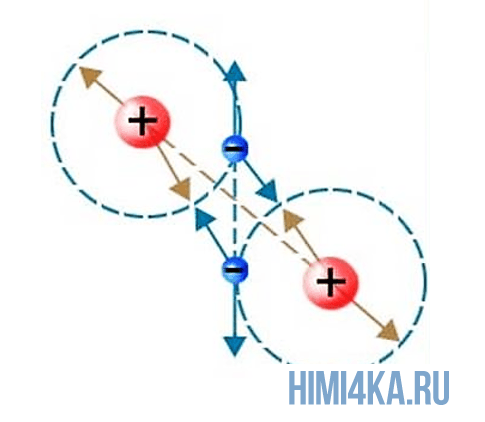
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
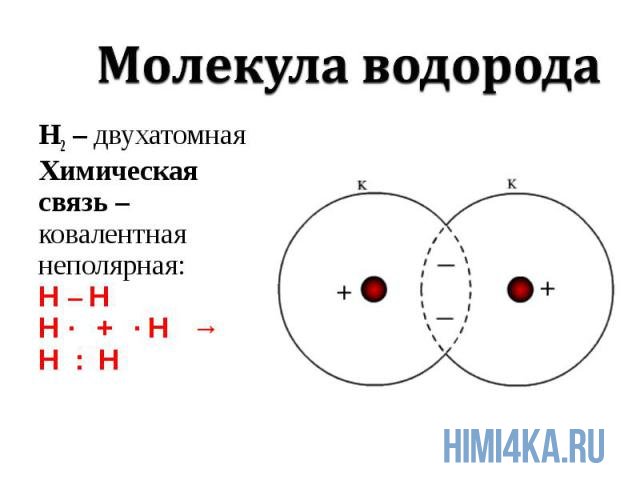
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
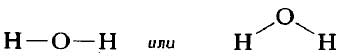
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
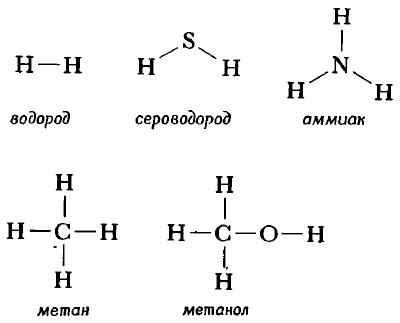
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
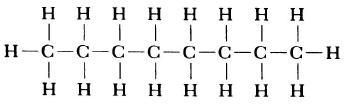
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
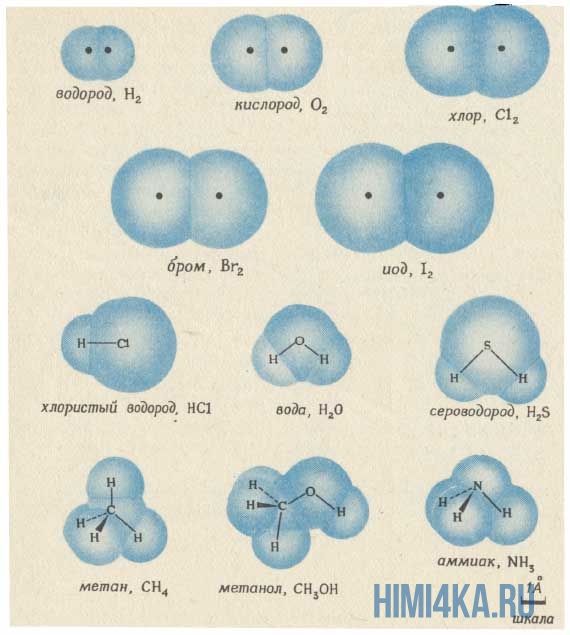
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
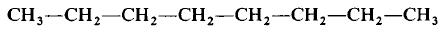
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
