При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% – 21% – 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Молярная доля – величина, которая характеризует отношение количества молей искомого вещества к общему количеству молей всех веществ, находящихся, например в растворе или смеси газов.
Как-же ее вычислить?
Для вычисления потребуется таблица Менделеева и калькулятор.
Этап 1.
Следует выписать формулы всех веществ и расчитать их молярные массы, используя таблицу Менделеева.
Пример:
Молярная масса воды (H20) равна 18. Почему? Атомная масса водорода (H) равна 1, а атомная масса кислорода (O) равна 16, соответственно 16+1+1=18.
Также, к примеру молярная масса оксида аллюминия (Al2O3) равна 27+27+16+16+16=102 (Атомная масса аллюминия 27, и как сказанно выше, кислорода 16).
Этап 2.
Теперь нужно определить количество молей каждого вещества. Для этого, массу вещества следует разделить на молярную массу.
Этап 3.
Теперь у нас есть сумма молей всех веществ (запишем, как Z) и количество молей искомого вещества (запишем, как n)
Формула для определения молярной доли X=n/Z, где X – искомая молярная доля, Z – сумма всех молей, n – моли искомого вещества.
Расчёт мольной доли (φ) вещества
Для характеристи состава многокомпонентной системы (смеси веществ или раствора) часто требуется определить мольную долю (φ) отдельного компонента в этой системе.
Мольная доля вещества – содержание вещества в смеси (растворе), выраженное отношением числа молей этого вещества к общему числу молей всех веществ, содержащихся в смеси.
Мольная доля φ(компонента) в смеси вычисляется по формуле:
φ(компонента) = ν(компонента) / сумма ν(компонентов смеси).
Задача 1. Какова мольная доля пропана в пропан-бутановой смеси, если его массовая доля в этой смеси составляет 75%?
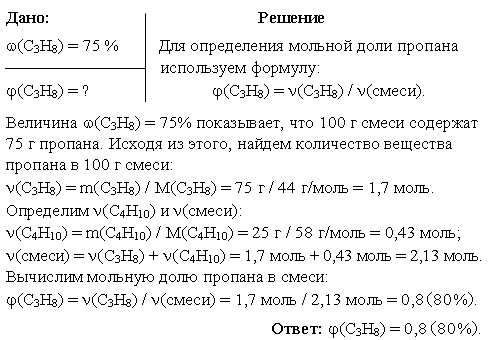
Задача 2. Синтетический каучук марки СКC-30 (сополимер бутадиена-1,3 и стирола) содержит 23,5% (по массе) звеньев стирола. Определите мольную долю звеньев бутадиена-1,3 в этом сополимере.
Решение
Сополимер бутадиена-1,3 и стирола образуется по схеме:
nCH2=CH–CH=CH2 + mCH2=СН–C6H5  [(–CH2–CH=CH–CH2–)x(–CH2–CH(C6H5)–)y]n+m
[(–CH2–CH=CH–CH2–)x(–CH2–CH(C6H5)–)y]n+m
1 ≤ x << n; 1 ≤ y << m;
По условию задачи ω(–CH2–CH(C6H5)–) = 23,5%, то есть 100 г сополимера содержат 23,5 г звеньев стирола C8H8 и 76,5 г бутадиеновых звеньев C4H6.
Найдём количество вещества C4H6 в 100 г сополимера:
ν(C4H6) = m(C4H6) / M(C4H6) = 76,5 г / 54 г/моль = 1,42 моль.
Определим количество вещества C8H8:
ν(C8H8) = m(C8H8) / M(C8H8) = 23,5 г / 104 г/моль = 0,22 моль.
Мольную долю звеньев бутадиена-1,3 рассчитаем по формуле:
φ(C4H6) = ν(C4H6) / [ν(C4H6) + ν(C8H8)] = 1,42 / 1,64 = 0,87 или 87%.
Ответ: φ(C4H6) = 0,87 (87%)
Mole fraction is one of the ways to represent the concentration of the solution. It is defined as the number of molecules of component A divided by the total number of molecules of all the components in the solution. Let’s learn about the mole fraction its formula and examples in this article.
What is Mole Fraction?
Mole fraction is defined as,
Number of moles of component A in a mixture divided by the total number of moles of all the components in that mixture.
Mole fraction is one of the measurements of the concentration of the solution. The image given below tells the formula used to calculate the mole fraction.

The mole fraction is represented by the letter ‘X’. For example for a solution that has ‘a’ moles of solute and ‘b’ moles of the solvent the total moles in the solution is ‘a+b’. Now, the mole fraction of solute is Xsolute = a / (a+b), similarly the mole fraction of solvent Xsolvent = b / (a+b).
A Mole is a unit of measurement for measuring a larger number of substances such as molecules, atoms, and other particles in chemistry. One mole is equal to 6.02214076 × 1023 values.
Mole Fraction Formula
The formula to calculate the mole fraction of any substance is discussed below in the article. Let’s take a solution in which two compounds compound A and compound B are mixed and the moles of compound A is nA and the moles of compound B are nB then,
Mole Fraction of A = Number of moles of A / (Number of moles of A + Number of moles of B)
XA = nA / (nA+nB)
Mole Fraction of B = Number of moles of B / (Number of moles of A + Number of moles of B)
XB = nB / (nA+nB)
Also, one of the most used properties of mole fraction is,
Xsolute + Xsolvent = 1
Proof:
Using Mole Fraction Formula
Xsolute + Xsolvent = a /(a+b) + b/(a+b)
= (a+b) / (a+b)
Xsolute + Xsolvent = 1
Now, by using the above formula
- Xsolute = 1 – Xsolvent
- Xsolvent = 1 – Xsolute
Unit of Mole Fraction
Mole fraction is a way of representing the concentration of the solution. It is the ratio of the moles of the solute or the mole of the solvent to the total moles of the solution. As we see it is a ratio of two similar quantities thus, it is a dimensionless quantity.
So, Mole Fraction has no Unit.
Properties of Mole Fraction
Mole fraction is one the most important way for finding the concentration of the solution and it helps in studying the various properties of the solution. Some of the basic properties of Mole Fractions are,
- Mole fraction is independent of the temperature. Unlike other molar concentrations, mole fraction does not require knowledge of phase densities.
- The roles of ‘solvate’ and ‘solvent’ are reversible in a mole fraction as it is symmetric.
- For any Ideal gas mole fraction is defined as the ratio of the partial pressure of individual gas to the total pressure of the mixture.
- Finding the mole faction of the liquid solutions is difficult.
Advantages of Mole Fraction
The following are some of the advantages of using a mole fraction:
- Change in temperature has no effect on the mole fraction of the solution.
- Mole fraction in an ideal gas mixture is equal to the ratio of partial pressure to total pressure.
- Density of various phases is not required for finding the mole fraction of any solution.
Disadvantages of Mole Fraction
There are not many disadvantages of using mole fraction as the measure of the concentration of the solution. The only disadvantage of using mole fraction is that it cannot be used properly with liquid solutions.
Note:
- Sum of all the mole fractions in a solution is always one.
Read, More
- Molarity
- Normality
- Molality
Solved Examples on Mole Fraction
Example 1: If the molecular mass of CH3OH is 39 and the molecular mass of H2O is 27, what is the mole fraction of CH3OH and H2O in a solution made by dissolving 4.1 g of alcohol in 36 g of H2O?
Answer:
Using the formula for moles,
Moles = wt(in gm) / molecular mass
Moles of H2O = 36 / 27
= 1.3 molesMoles of CH3OH = 4.1 / 39
= 0.10 moleMole fraction of CH3OH = 0.10 / (1.3 + 0.10)
= 0.10 / 1.4Mole fraction of CH3OH = 0.0714
Now,
Mole fraction of H2O = 1.3/(1.3+0.1)
= 1.3/1.4Mole fraction of H2O = 0.9286
Example 2: Calculate the mole fraction of each gas in a tank containing 2.5 × 104 mol oxygen and 4.8 × 104 mol helium.
Answer:
Number of moles of Helium = 4.8 × 104
Number of moles of Oxygen = 2.5 × 104
Since,
Mole Fraction of Helium = Number of moles of Helium / (Number of moles of Helium + Number of moles of Oxygen)
XHelium = 4.8 × 104 / (4.8 × 104 + 2.5 × 104)
= 4.8 × 104 / 7.3 × 104
XHelium = 0.6575
Mole Fraction of Oxygen = Number of moles of Oxygen / (Number of moles of Helium + Number of moles of Oxygen)
XOxygen = 2.5 × 104 / (4.8 × 104 + 2.5 × 104)
= 2.5 × 104 / 7.3 × 104
Xoxygen = 0.3424
Example 3: Calculate the acetone mole fraction in a solution of 6-mole benzene, 13 moles carbon tetrachloride, and 21 moles acetone.
Answer:
Moles of Benzene = 6
Moles of Carbon Tetrachloride = 13
Moles of Acetone = 21
Now,
Mole Fraction of Acetone = Moles of Acetone / (Moles of Benzene + Moles of Carbon Tetrachloride + Moles of Acetone)
Xacetone = 21 / (6+13+21)
Xacetone = 21 / 40
Xacetone = 0.525
Mole Fraction of Benzene = Moles of Benzene / (Moles of Benzene + Moles of Carbon Tetrachloride + Moles of Acetone)
Xbenzene = 6 / (6+13+21)
Xbenzene = 0.15
Mole Fraction of Carbon Tetrachloride = Moles of Carbon Tetrachloride / (Moles of Benzene + Moles of Carbon Tetrachloride + Moles of Acetone)
Xcarbon tetrachloride = 6 / (6+13+21)
Xcarbon tetrachloride = 0.15
Example 4: Calculate the mole fraction of solute, when the mole fraction of solvent is 0.23
Answer:
Since,
Xsolute = 1 – Xsolvent
Xsolute = 1 – 0.23
Xsolute = 0.77
Example 5: If the mole fraction of the solute is 0.64, determine the mole fraction of the solvent.
Answer:
Since,
Xsolvent = 1 – Xsolute
Xsolvent = 1 – 0.64
Xsolvent = 0.36
FAQs on Mole Fraction
Question 1: What is a mole fraction?
Answer:
Mole fraction is the ratio of the number of moles of the given solute to the total number of moles of the solution.
Question 2: Why do we use Mole Fraction?
Answer:
Mole fraction is the ratio of the number of moles of component A in the mixture to the total number of moles of the mixture. The mole fraction is useful because the ratio of the two components can be calculated if the mole fraction of each component is known and it does not changes with the temperature.
Question 3: What is the unit of mole fraction?
Answer:
Mole fraction is the ratio of two similar quantities so it is a unit less quantity.
Question 4: Is mole fraction temperature dependent concentration term?
Answer:
No, the mole fraction is not temperature dependent. So it is widely used when the temperature of the concentration changes rapidly.
Question 5: What is the relation between Mole Fraction and Molality?
Answer:
The relation between mole fraction and molality is discussed below,
Molality = (XB × 1000) / (XA × MA)
where,
XB is mole fraction of solute
XA is mole fraction of solvent
MA is mass of solvent
Last Updated :
13 Mar, 2023
Like Article
Save Article
Мольная (молярная) доля
Мольная
доля —
отношение количества молей данного
компонента к общему количеству молей
всех компонентов. Мольную долю выражают
в долях единицы.
![]() ,
,
где:
νi —
количество i-го
компонента, моль;
n —
число компонентов;
Моляльность (молярная весовая концентрация)
Моляльность —
количество растворённого вещества
(число молей) в 1000 г растворителя.
Измеряется в молях на кг, также
распространено выражение в «моляльности».
Так, раствор с концентрацией 0,5
моль/кг называют 0,5-моляльным.
![]() ,
,
где:
ν — количество
растворённого вещества, моль;
m2 —
масса растворителя, кг.
Следует
обратить особое внимание, что несмотря
на сходство названий, молярная концентрация
и моляльность — величины различные.
Прежде всего, в отличие от молярной
концентрации, при выражении концентрации
в моляльности расчёт ведут на
массу растворителя,
а не на объём раствора. Моляльность, в
отличие от молярной концентрации, не
зависит от температуры.
Титр раствора
Титр
раствора — масса растворённого
вещества в 1 мл раствора.
![]() ,
,
где:
m1 —
масса растворённого вещества, г; V —
общий объём раствора, мл;
В аналитической
химии обычно
концентрацию титранта пересчитывают
применительно к конкретной реакции
титрования таким образом, чтобы объём
использованного титранта непосредственного
показывал массу определяемого вещества;
то есть титр раствора показывает, какой
массе определяемого вещества (в граммах)
соответствует 1 мл титрованного раствора.
Другие способы выражения концентрации растворов
Существуют
и другие, распространённые в определённых
областях знаний или технологиях, методы
выражения концентрации. Например, в
фотометрии часто используютмассовую
концентрацию,
равную массе растворённого вещества в
1 л раствора. При приготовлении растворов
кислот часто указывают, сколько объёмных
частей воды приходится на одну объёмную
часть концентрированной кислоты
(например, 1:3). Концентрация загрязнений
в воздухе может выражаться в частях на
миллион (ppm).
Иногда используют также отношение масс
(отношение массы растворённого вещества
к массе растворителя) и отношение объёмов
(аналогично, отношение объёма растворяемого
вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В
связи с тем, что моляльность, массовая
доля, мольная доля не включают в себя
значения объёмов, концентрация таких
растворов остаётся неизменной при
изменении температуры. Молярность,
объёмная доля, титр, нормальность
изменяются при изменении температуры,
так как при этом изменяется плотность растворов.
Именно моляльность используется в
формулах повышения
температуры кипения и понижения
температуры замерзания растворов.
Разные
виды выражения концентрации растворов
применяются в разных сферах деятельности,
в соответствии с удобством применения
и приготовления растворов заданных
концентраций. Так, титр раствора удобен
в аналитической химии для волюмометрии
(титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций растворов к другим
От
массовой доли к молярности:
![]() ,
,
где:
ρ — плотность раствора,
г/л;
ω —
массовая доля растворенного вещества
в долях от 1;
M1 —
молярная масса растворенного вещества,
г/моль.
От
молярности к нормальности:
![]() ,
,
где:
M —
молярность, моль/л;
z — число
эквивалентности.
От
массовой доли к титру:
![]() ,
,
где:
ρ — плотность раствора,
г/л;
ω —
массовая доля растворенного вещества
в долях от 1;
От
молярности к титру:
![]() ,
,
где:
M —
молярность, моль/л;
M1 —
молярная масса растворенного вещества,
г/моль.
От
молярности к моляльности:
![]() ,
,
где:
M —
молярность, моль/л;
ρ —
плотность раствора, г/мл;
M1 —
молярная масса растворенного вещества,
г/моль.
От
моляльности к мольной доле:
![]() ,
,
где:
mi —
моляльность, моль/кг;
M2 —
молярная масса растворителя, г/моль.
Эквивалентная
масса окислителя(восстановителя)
равна его
мольной массе,деленной на число
электронов,которое присоединяет(отдает)
одна молекула окислителя(восстановителя)в
данной реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
27.03.2015104.12 Кб44WW.doc
