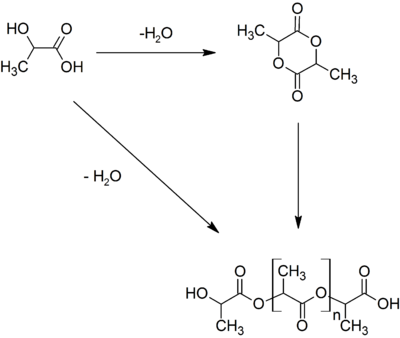| Молочная кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
2-гидроксипропановая кислота | |
| Традиционные названия | Молочная кислота | |
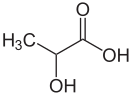
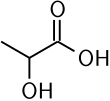
| Хим. формула | CH3CH(OH)COOH | |
| Рац. формула | C3H6O3 | |
| Физические свойства | ||
| Молярная масса | 90,08 г/моль | |
| Плотность | 1,225 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 18 °C[1] | |
| • кипения | 122 °C | |
| Химические свойства | ||
Константа диссоциации кислоты  |
3,86 (при 25 °C) | |
| Классификация | ||
| Рег. номер CAS |
50-21-5; (R)-Молочная кислота 103226-41-7. |
|
| PubChem | 612 | |
| Рег. номер EINECS | 200-018-0 | |
| SMILES |
CC(O)C(=O)O |
|
| InChI |
InChI=1S/C3H6O3/c1-2(4)3(5)6/h2,4H,1H3,(H,5,6) JVTAAEKCZFNVCJ-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E270 | |
| ChEBI | 78320 | |
| ChemSpider | 592 | |
| Безопасность | ||
| Краткие характер. опасности (H) |
H315, H318 |
|
| Меры предостор. (P) |
P280, P305+P351+P338 |
|
| Сигнальное слово | Опасно | |
| Пиктограммы СГС |
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Моло́чная кислота́ (химическая формула — C3H6O3) — cлабая химическая органическая кислота, относящаяся к классу предельных карбоновых кислот.
При стандартных условиях молочная кислота — это одноосновная карбоновая оксикислота белого цвета с характерным запахом. Соли и эфиры молочной кислоты называются лактатами.
Малотоннажная химия производит молочную кислоту различных квалификаций: «фармакопейную», «техническую», «пищевую» и др.
История[править | править код]
Молочную кислоту открыл шведский химик Карл Шееле. В 1780 году он выделил её из прокисшего молока в виде коричневого сиропа. Французский химик Анри Браконно обнаружил, что она образуется при молочнокислом брожении[2].
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Производство молочной кислоты в Советском Союзе было организовано в 1930 г. на основе работ Сергея Павловича Костычева и Владимира Степановича Буткевича.[3]
Физические свойства[править | править код]
Молочная кислота является простейшей хиральной карбоновой кислотой и может существовать в виде двух энантиомеров: L-(+)-молочной кислоты, D-(-)-молочной кислоты или их рацемической смеси — DL-молочной кислоты. Если в смеси энантиомеров один находится в избытке, его можно выделить дробными перекристаллизациями из смеси диэтилового эфира и диизопропилового эфира[2]. Чистые энантиомеры имеют температуру плавления 52,7—52,8 °С[2].
Энантиомеры молочной кислоты: L-(-)-молочная кислота (слева) и D-(+)-молочная кислота (справа)
Молочная кислота очень гигроскопична и обычно существует в виде водного раствора с концентрацией до 90 мас. %. В связи с этим очень сложно установить её температуру плавления; литература приводит значения от 18 до 33 °С. Кроме того, в таких растворах присутствует значительное количество лактоилмолочной кислоты и других олигомеров молочной кислоты[2].
Молочная кислота растворима в воде, этаноле и других органических растворителях, смешивающихся с водой, а также в диэтиловом эфире. Она практически нерастворима в бензоле и хлороформе[4].
Химические свойства[править | править код]
При взаимодействии с окислителями молочная кислота разлагается. При окислении кислородом воздуха или азотной кислотой в присутствии железа или меди она превращается в муравьиную кислоту, уксусную кислоту, щавелевую кислоту, уксусный альдегид, углекислый газ и пировиноградную кислоту. Молочную кислоту можно восстановить до пропионовой кислоты действием иодоводорода[5]
Промышленный интерес представляет дегидратация молочной кислоты до акриловой кислоты и её восстановление до пропиленгликоля[6].
Поскольку молочная кислота является одновременно карбоновой кислотой и спиртом, она вступает в межмолекулярную этерификацию, давая лактоилмолочную кислоту. При дальнейшей конденсации образуется лактид — циклический сложный эфир. Также при конденсации могут образовываться линейные полилактиды. Эти соединения являются примесями в молочной кислоте. Так, в 6,5%-й молочной кислоте содержится около 0,2 % лактоилмолочной кислоты, 88%-я молочная кислота содержит меньше 60 % свободной молочной кислоты, а 100%-я — только 32 %[4].
Получение[править | править код]
Ферментативное получение[править | править код]
В промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом[6].
Для ферментативного производства молочной кислоты необходимо иметь углеводное сырьё, питательные вещества и соответствующие микроорганизмы. В качестве сырья используют глюкозу, кукурузные сиропы, мелассу, сок сахарной свёклы, сыворотку и крахмал. Питательными веществами являются пептиды и аминокислоты, фосфаты, соли аммония и витамины. Здесь находят применение дрожжевой экстракт, кукурузный ликёр[en], кукурузная глютеновая мука[en], солодовые ростки, соевый или мясной пептон. Молочную кислоту из углеводов вырабатывают культуры Lactobacillus, Bacillus и Rhizopus. Последняя из них является грибной и не требует сложных источников азота, хотя и даёт более низкий выход, чем бактериальные культуры[6].
Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0—6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей[6].
После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование этой побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну[7].
Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации[7].
Выход молочной кислоты в процессе ферментации составляет 85—95 %. Побочными продуктами являются муравьиная и уксусная кислота.[6].
Синтетическое получение[править | править код]
С 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Важнейшим крупным производителем синтетической молочной кислоты является фирма «Musashino»[7].
Экономические аспекты[править | править код]
Годовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3—4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты[8].
Молочная кислота в организме человека и животных[править | править код]
Дополнительные сведения: Гликолиз
Молочная кислота формируется при анаэробном распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным источником углеводов в нашем организме. Глюкоза — это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Аэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления[9][10]. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) повышено[11].
Регулятор обмена[править | править код]
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны.
Анализ[править | править код]
Количественный анализ молочной кислоты обычно проводят титрованием гидроксидом натрия в присутствии фенолфталеина. Этот способ не подходит для концентрированных растворов, потому что в них молочная кислота частично находится в виде лактоилмолочной кислоты. Если такой раствор нужно оттитровать, используют приём обратного титрования: молочную кислоту обрабатывают избытком щёлочи (лактоилмолочная кислота при этом гидролизуется), а затем остаток щёлочи оттитровывают соляной кислотой[8].
В промышленности и исследовательских лабораториях молочную кислоту анализируют методом ВЭЖХ. Содержание энантиомерных форм в молочной кислоте можно определить ферментативным методом либо ВЭЖХ на хиральной колонке. Такие колонки, как и образцы высокочистых энантиомеров молочной кислоты коммерчески доступны[8].
Молочную кислоту можно обнаружить по следующим качественным реакциям:
- Взаимодействие с n-оксидифенилом и серной кислотой:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается:
CH3CH(OH)COOH → CH3CHO + HCOOH (→ H2O + CO)
Уксусный альдегид взаимодействует с n-оксидифенилом, причём, по-видимому, происходит конденсация в o-положении к OH-группе с образованием 1,1-ди(оксидифенил)этана:
В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции:
В сухой пробирке нагревают в течение 2 минут на водяной бане при 85 °C каплю исследуемого раствора с 1 мл концентрированной серной кислоты. После этого охлаждают под краном до 28 °C, добавляют небольшое количество твёрдого n-оксидифенила и, перемешав несколько раз, дают постоять 10-30 минут. Фиолетовое окрашивание появляется постепенно и через некоторое время становится более глубоким. Открываемый минимум: 1,5⋅10−6 г молочной кислоты.
- Взаимодействие с подкисленным серной кислотой раствором перманганата калия
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты.
С3Н6О3 + [O] = C3Н4O3 + H2O↑
Продуктом данной реакции может быть пировиноградная кислота С3Н4О3, которая тоже имеет запах уксусной кислоты.
С3Н6О3 + [O] = C3Н4O3 + H2O↑
Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению:
С3Н6О3 + 2[O] = CH3COOH + CO2↑ + H2O
- Взаимодействие с фенолятом железа
Описание реакции: Эта реакция называется реакцией Уффельмана и используется, например, в клинической медицине для определения присутствия молочной кислоты в желудочном соке, открыта Юлиусом Уффельманом[de] в 1880-х гг. Для проведения реакции нужно растворить одну каплю хлорида железа и 0,4 грамма фенола в 50 см3 воды. Затем добавить тестируемую жидкость, если в ней есть молочная кислота, то синий цвет раствора сменится жёлтым[12][13], поскольку образуется лактат железа.
Применение[править | править код]
Молочная кислота используется преимущественно в двух сферах: пищевой промышленности и производстве полимеров, а также в других промышленных целях[14].
В пищевой промышленности молочная кислота используется как консервант и подкислитель. Благодаря тому, что её соли хорошо растворимы в воде, их также можно использовать в тех продуктах, где важно значение pH. Молочная кислота и её соли используются в напитках, конфетах, мясных изделиях и соусах. Лактат кальция добавляется в продукты как источник кальция.[14]
В полимерной промышленности из молочной кислоты получают полилактид. Производится он из лактида полимеризацией с раскрытием цикла. Сам же лактид получают конденсацией молочной кислоты[14].
Также молочная кислота используется в покрытии металлов, косметике, текстильной и кожевенной промышленности. Её эфиры находят применение в производстве красок и чернил, электроники и чистке металлов[14].
Безопасность[править | править код]
Молочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов[15].
Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг[15].
См. также[править | править код]
- Цикл Кори
- Крепатура
- Яблочно-молочная ферментация
Примечания[править | править код]
- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // (unknown type) — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ 1 2 3 4 Ullmann, 2014, p. 1.
- ↑ rsl.ru. Дата обращения: 5 февраля 2020. Архивировано 5 февраля 2020 года.
- ↑ 1 2 Ullmann, 2014, p. 2.
- ↑ Трегер Ю. А. Молочная кислота // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 130—131. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ 1 2 3 4 5 Ullmann, 2014, p. 3.
- ↑ 1 2 3 Ullmann, 2014, p. 4.
- ↑ 1 2 3 Ullmann, 2014, p. 6.
- ↑ Dr. George A. Brooks Архивная копия от 5 сентября 2008 на Wayback Machine (англ.)
- ↑ George A. Brooks. What does glycolysis make and why is it important? // Journal of Applied Physiology. — 2010. — Вып. 108, № 6. — С. 1450-1451. — doi:10.1152/japplphysiol.00308.2010.
- ↑ Надежда Маркина. Старость заполняет мозг солями молочной кислоты. Infox.ru (7 ноября 2010). Дата обращения: 7 ноября 2010. Архивировано 23 августа 2011 года.
- ↑ Handbuch der Lebensmittelchemie. — Springer, 1935. — Vol. 2. Allgemeine Untersuchungsmethoden. Zweiter Teil: Chemische und Biologische Methoden. — С. 1099. — ISBN 9783662019481.
- ↑ Uffelmann: Pharmazeutische Zentralhalle für Deutschland. 1887, 28, 582.
- ↑ 1 2 3 4 Ullmann, 2014, p. 5.
- ↑ 1 2 Ullmann, 2014, p. 7.
Литература[править | править код]
- Starr J. N., Westhoff G. Lactic Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a15_097.pub3.
- Graham D. Lamb and D. George Stephenson. Point:Counterpoint: Lactic acid accumulation is an advantage/disadvantage during muscle activity // Journal of Applied Physiology. — 2006. — Вып. 100, № 4. — С. 1410-1412. — doi:10.1152/japplphysiol.00023.2006.
- ГОСТ 490-2006 Кислота молочная пищевая. Технические условия
Ссылки[править | править код]
- ИК-спектр в конденсированной фазе. Sigma-Aldrich. Дата обращения: 1 апреля 2019.
- Спектр КР. Sigma-Aldrich. Дата обращения: 1 апреля 2019.
Молочная кислота – это один из химических реактивов, образующийся в результате распада на составляющие глюкозы и ее производных. Молочная кислота принадлежит к карбоновой группе. Вещество содержится в клетках мозга, сердца, в мышечной ткани, в тканях других органов. Соединение представляет собой корень практически всех проблем спортсменов: именно оно вызывает ухудшение самочувствия, боль в мышцах, судороги, кислородное голодание и травмы. Многие рассматривают лактат как продукт, которого необходимо избегать всеми силами. Однако, на самом деле, эта кислота играет важную роль в выработке энергии, которая требуется для поддержания мышц в тонусе. Особенно она важна во время активных тренировок.
Молекула молочной кислоты
Содержание
- Что такое молочная кислота?
- Формула молочной кислоты и ее свойства
- Виды молочной кислоты
- Получение молочной кислоты
- История молочной кислоты
- Функции молочной кислоты в организме человека
- Концентрация молочной кислоты в организме
- Суточная норма молочной кислоты
- Как вывести излишек молочной кислоты?
- Как проявляется присутствие излишнего количества кислоты в мышцах?
- Почему молочная кислота не выводится из организма самостоятельно?
- Как нейтрализовать молочную кислоту?
- Полезные свойства молочной кислоты
- Вред молочной кислоты и противопоказания к ее употреблению
- Естественные источники молочной кислоты
- Сферы применения молочной кислоты
- Косметические средства, содержащие молочную кислоту
- Пилинг с молочной кислотой в домашних условиях
- Пилинг молочной кислотой – отзывы
- Где можно приобрести молочную кислоту и сколько она стоит?
- Заключение
Что такое молочная кислота?
Молочная кислота представляет собой бесцветную или окрашенную в слабый желтый цвет жидкость с едва выраженным запахом и отчетливым кислым вкусом. Вещество легко растворяется в разных средах: в спирте, глицерине и обычной воде. Первые сведения о лактате датируются 80-ми годами 18 века. Основная сфера использования соединения – пищевая промышленность. В производстве продуктов питания молочная кислота известна под индексом Е270, а ее производные – под индексом Е271.
Молочная кислота – это натуральное биологическое вещество, играющее важную роль в процессе обмена веществ.
На протяжении долгого времени химики считали, что лактат может становиться причиной апатии, упадка сил, усталости, судорог, потери чувствительности конечностей и сильной боли в мышцах. Однако со временем это утверждение было опровергнуто, и молочная кислота восстановила свою репутацию. Исследователи доказали, что вещество отвечает за выработку энергии при занятиях спортом. Оно способствует более качественному усваиванию углеводов, снабжает энергией многие органы, в частности – печень, мозг и сердце.
Формула молочной кислоты и ее свойства
Формула молочной кислоты выглядит следующим образом:
C3H6O3
Как видно по формуле, в состав вещества входят 3 молекулы атома углерода, шесть атомов водорода и три атома кислорода.
Молочная кислота представляет собой простейшее органическое соединение, существующее в виде двух энантиомеров. Соединение гигроскопично и, как правило, существует в формате бесцветного или еле-еле желтого водного раствора. В связи с этим достаточно проблематично установить температуру, при которой молочная кислота начинает плавиться. В специализированных источниках указывают температуру плавления молочной кислоты в диапазоне от 18 до 33 градусов.
Лактат прекрасно растворяется в воде и спирте, которые способны смешиваться с водой. Соединение практически не подлежит воздействию в бензоле и хлороформе.
Вещество разлагается при вступлении в реакцию с окисляющими веществами. При взаимодействии с кислородом или азотной кислотой в присутствии железа или меди соединение преобразуется в муравьиную, уксусную и щавелевую кислоту, углекислый газ и пировиноградную кислоту.
Виды молочной кислоты
В зависимости от степени очистки выделяют две основные разновидности молочной кислоты:
- техническую – применяется в непищевом производстве;
- пищевую – применяется в производстве продуктов питания.
Получение молочной кислоты
В промышленности лактат получают двумя способами: ферментативным и синтетическим. Большей популярностью пользуется первый способ, поскольку благодаря ему получается более чистое соединение. Для него применяют углеродное сырье, питательные вещества и ряд микроорганизмов. В качестве основного сырья задействуют глюкозу, сиропы, приготовленные на основе кукурузы, мелассу, сок сахарной свеклы, сыворотку и картофельный крахмал. По завершению процедуры ферментации получившуюся кислоту подвергают тщательной процедуре очистки. Нежелательные включения отделяют флокуляцией, протекающей в щелочной среде или ультрафильтрацией.
В фармацевтической промышленности применяются способы получения молочной кислоты с очисткой в несколько ступеней. Наиболее часто прибегают к экстракции молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратной экстракции в воду.
Существует синтетический способ получения молочной кислоты. Он основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила.
История молочной кислоты
Впервые молочная кислота была произведена искусственным путем на заре 18 века в Швеции фармацевтом Карлом Шееле. Ученый в ходе продолжительных экспериментов выделил соединение из коричневого сиропа и прокисшего молока. Позже уже другой химик из другой страны – Анри Браконно из Франции – подтвердил, что кислота образуется при молочнокислом брожении.
Опыт коллег перенял шведский химик Йенс Якоб Берцелиус, выделивший в 1807 году цинковую соль молочной кислоты, которая находится в мышцах.
Изучению молочной кислоты посвятили свою деятельность и отечественные ученые – химики из Советского Союза. Их опыты были крайне успешны. В 30 году 20 века они получили лактат высокого качества. Она не включает в свой состав следы железа, а в ее производстве применяют специальную аппаратуру, препятствующую попаданию примесей железа в кислоту.
Функции молочной кислоты в организме человека
Молочная кислота необходима организму как источник энергетического ресурса, как сырье для синтеза глюкозы и гликогена. Особенно сильно в соединении нуждаются мышцы. Во время интенсивных физических нагрузок молочная кислота, скопившаяся в быстро сокращающихся мышечных волокнах, переходит в «медленные» волокна, сердце и дыхательные мышцы, где применяется в качестве энергетического топлива.
Но в качестве топлива используется только 75% вещества, остальная часть транспортируется кровью в печень и почки, где преобразуется в глюкозу. Излишков лактата в организме не остается, зато в крови безостановочно поддерживается достаточный уровень глюкозы, что особенно важно для проведения длительных тренировок.
Концентрация молочной кислоты в организме
Концентрация молочной кислоты определяет качество углеводного обмена и степень насыщения тканей кислородом. В организме здорового человека содержание лактата в крови варьируется в диапазоне от 0,6 до 1,3 ммоль/литр. Судороги и прочие неприятные ощущения в мышечных тканях объясняются повышением этого показателя.
Превышение концентрации молочной кислоты в организме свидетельствует о недостатке кислорода. А нехватка кислорода, в свою очередь, является одним из симптомов сердечной недостаточности, анемии и нарушения работы легких. В онкологии превышение концентрации молочной кислоты может быть индикатором роста злокачественных образований. Повышение уровня кислоты может стать причиной болезней цирроза, гепатита и сахарного диабета.
Превышение концентрации молочной кислоты может наблюдаться в здоровом организме – сразу после активных занятий спортом.
Суточная норма молочной кислоты
Четкого определения суточной нормы молочной кислоты не существует. Впрочем, существуют рекомендации от специалистов для людей, ведущих малоподвижный образ жизни, по употреблению пищи с молочной кислотой. Для восстановления баланса молочной кислоты в организме достаточно всего двух стаканов кефира в стуки. Этого будет достаточно для полного усвоения молекул кислоты организмом.
Особенную потребность в лактате испытывают дети в период активного роста, а также взрослые люди, чья работа связана с интеллектуальной деятельностью. А вот пожилой организм не нуждается в больших объемах молочной кислоты.
Как вывести излишек молочной кислоты?
Как проявляется присутствие излишнего количества кислоты в мышцах?
Лактат образуется в мышечных тканях в результате активных тренировок. Она является следствием распада глюкозы и состоит из водорода и аниона лактата.
Водород препятствует свободной передаче нервных импульсов, значительно снижает скорость сокращения мышечных волокон. Накопление большого количества лактата в мышцах сопровождается рядом симптомов, среди которых:
- ощущение жжения в задействуемых в процессе тренировок мышцах;
- дискомфорт во всем теле;
- общая слабость и ощутимый упадок сил, отсутствие интереса к окружающей среде;
- дискомфорт при движении;
- боль при последующих тренировках;
- при особенно большом избытке лактата может наблюдаться повышение температуры.
Неприятные ощущения могут сохраняться на протяжении нескольких дней, после чего проходить без каких-либо манипуляций с вашей стороны. А вот при особенно большом излишке молочной кислоты восстановление мышечных волокон может затянуться на более продолжительный период. При возникновении сильного жжения рекомендуется на некоторое время снизить интенсивность тренировок.
Почему молочная кислота не выводится из организма самостоятельно?
Во время работы мышечных тканей требуется постоянное поступление кислорода для непрерывного пополнения запаса энергии. Но при особенно интенсивных сокращениях мышечных волокон, скорость кровообращения в них снижается, а поступление кислорода блокируется. Тело, вместе с этим, не перестает функционировать, соответственно, организм ищет другие пути для получения необходимой ему энергии, посредством синтеза гликогена в АТФ. В мышцах по итогу образуется лактат. Организм не способен сразу вывести ее всю, поэтому вещество скапливается, в теле возникают неприятные ощущения.
Продолжительное пребывание молочной кислоты в мышечных тканях может вызвать следующие реакции организма:
- недостаточное количество энергетического ресурса;
- нехватку креатина в мышечных волокнах;
- остановка синтеза белка;
- активация кортизола;
- снижение производства инсулина.
Как нейтрализовать молочную кислоту?
Единого мнения относительно выведения лактата из организма у врачей нет. Одни специалисты утверждают, что способа, который позволил бы вывести соединение из организма, не существует. Они говорят о том, что единственное, что можно сделать – снизить неприятные ощущения:
- правильное сбалансированное питание;
- употребление фрешей из свежих фруктов и ягод, насыщенных антиоксидантами;
- употребление травяных чаев и отваров, в частности – на основе крапивы, боярышника и шиповника;
- обильное питье как во время, так и после физической активности;
- принятие горячих ванн – вода обязательно должна быть горячей: это поможет ускорить процесс кровообращения;
- использование согревающей мази;
- соблюдение режима отдыха – здоровый сон способствует восстановлению организма;
- сауна и баня.
В снижении дискомфорта могут помочь: контрастный душ, массаж, употребление травяного отвара сразу после тренировки и введение большого количества овощей, фруктов и зелени в свой ежедневный рацион.
Есть определенные правила насчет того, чего делать не рекомендуется. Так, например, специалисты не советуют употреблять быстрые углеводы и алкогольные напитки, поскольку они ощутимо замедляют процесс восстановления мышечных тканей. Не стоит употреблять обезболивающие препараты, поскольку они тормозят процесс выведения молочной кислоты.
Если вы не хотите ощущать боль в мышцах после тренировки, прекращать употребление вышеназванных продуктов необходимо заранее. А перед началом занятий спортом очень важно тщательно разогреться и выполнить растяжку по завершению тренировки. Не рекомендуется резко изменять программу тренировок и не особенно усердствовать, не имя достаточного опыта для этого.
Полезные свойства молочной кислоты
Молочная кислота, как уже было сказано выше, обеспечивает организм необходимым ему энергетическим ресурсом. Она принимает участие в метаболических процессах и в выработке глюкозы. Это органическое соединение требуется для исправной работы сердечной мышцы, правильного функционирования нервной системы, мозга и перечня других органов.
Лактат входит в состав косметических средств, применяемых для удаления кутикулы. Она при этом не оказывает никакого воздействия на обычную кожу, а воздействует исключительно на ороговевшие ее слои. Благодаря этим особенностям, средства, в составе которых присутствует рассматриваемое вещество, используют также для удаления мозолей и бородавок.
Кроме того, лактат благоприятно сказывается на состоянии волос. Благодаря ему они становятся более мягкими и послушными, приобретают красивый здоровый блеск. Средство хорошо взаимодействует как с сухими, так и с нормальными волосами. Маску с лактатом выдерживают на волосах в течение получала, после чего смывают ее теплой водой.
Молочную кислоту применяют для продления молодости кожи. Ежедневные умывания кислым молоком способствуют ее очищению и повышению упругости.
Вред молочной кислоты и противопоказания к ее употреблению
Избыток любого вещества в человеческом организме не является нормой и точное не несет пользу. Лактат в избытке негативным образом сказывается на состоянии крови: она изменяет ее состав и ведет к развитию лактацидоза. В результате заболевания в организме резко понижается уровень рН, что приводит к нарушению функционирования практически всех органов.
Однако стоит отметить, что такое заболевание не возникнет даже при самых интенсивных тренировках – оно, как правило, сопутствует лейкозу, диабету, острым потерям крови и сепсису.
Естественные источники молочной кислоты
Как несложно догадаться, молочная кислота в больших количествах содержится в молочных продуктах, в частности в:
- кефире;
- ацидофилине;
- ряженке;
- сыворотке;
- простокваше;
- сметане;
- сыре;
- айране;
- твороге;
- мороженном;
- натуральном йогурте;
- кислой капусте;
- черном хлебе;
- квасе;
- пиве.
Сферы применения молочной кислоты
Пищевая промышленность
В первую очередь молочная кислота получила широкое распространение в пищевой промышленности. В производстве продуктов питания она известна под индексом Е270. Соединение используют как в качестве окислителя, так и в качестве консерванта. Благодаря молочной кислоте значительно увеличивается срок хранения продуктов питания: в процессе длительного хранения продукция не приобретает неприятного запаха и вкуса.
Лактат как пищевая добавка разрешена к применению во всех странах.
Встретить молочную кислоту можно в следующих продуктах:
- сладости;
- соки и газированные напитки;
- соусы на растительной основе;
- пиво;
- консервы – как овощные, так и мясные;
- жиры растительного происхождения;
- алкогольные напитки;
- сыр и молочные продукты;
- рыбные полуфабрикаты.
Молочная кислота способна не только продлевать их срок годности, но и улучшать вкус, цвет, консистенцию, а также защищать от бактерий.
Косметология
В современной косметологии средства на основе кислот пользуются большой популярностью. Особенно популярны средства на основе молочной кислоты. Она имеет безопасное естественное происхождение, а значит более безопасна для человека.
Так, кислота способствует отшелушиванию отмерших клеток, сужению пор, отбеливанию пигментных пятен и улучшению тона кожи лица, устранению несовершенств и воспалений, избавлению от рубцов.
Молочная кислота популярна в гинекологических продуктах. Ее часто используют как регулятор кислотности в средствах интимной гигиены.
Фармацевтика
Безопасность молочной кислоты позволяет вводить ее в состав лечебных препаратов. Соединение, применяемое в медикаментах, характеризуется высокой чистотой и производится исключительно на высококачественном оборудовании с дополнительной защитой от включения примесей железа.
Среди аптечных препаратов особенной популярностью пользуются средства, помогающие избавиться от грибка кожи и ногтевой пластины. Лактат нередко включают в состав противомикробных средств, применяющихся для поддержания микрофлоры желудка. Вещество способствует расслаблению желудочных и кишечных сфинктеров и предотвращению развития патогенной микрофлоры.
Ветеринария
В ветеринарии молочную кислоту применяют в качестве противобродильного продукта, применяемого для лечения желудочных заболеваний. Свойства соединения используются для профилактики развития заболеваний органов дыхательных путей. Средства на основе молочной кислоты дают лошадям, жвачным животным, лисицам и крупному рогатому скоту для лечения заболеваний желудка.
На птицефабриках соединение применяют для повышения яйценоскости и прочности кислоты. Ее используют как дополнительный метаболит.
Косметические средства, содержащие молочную кислоту
Наиболее часто молочную кислоту включают в состав шампуней и прочих средств для волос, а также в состав пилингов. Кислота способствует улучшению качества шевелюры: волосы приобретают здоровое сияние, становятся более мягкими и послушными. Их становится легко расчесывать и укладывать.
В составе пилингов молочная кислота способствует отшелушиванию отмерших клеток кожи, улучшению тона лица, удалению пигментных пятен и улучшению структуры кожи. Молочная кислота способствует сужению и очищению пор.
Пилинг с молочной кислотой в домашних условиях
Использование пилинга с домашней кислотой приводит к следующему эффекту:
- удалению жирного блеска;
- снижению интенсивности покраснений и воспалительных процессов;
- разглаживанию неглубоких морщин;
- улучшению рельефа лица;
- удалению пятен от прыщей;
- устранению нежелательной пигментации;
- кожа становится более свежей.
Не рекомендуется использовать пилинги на основе молочной кислоты при лактации, в период беременности, при злокачественных новообразованиях, склонности к образованию рубцовых тканей, сосудистым звездочкам на лице и чрезмерно чувствительной коже.
Для приготовления пилинга вам понадобится, собственно, лактат – 0,5 г. и очищенная вода – 9,5 г. Косметологи рекомендуют позаботиться о средстве для нейтрализации молочной кислоты. Его можно приготовить из соды и дистиллированной воды, смешанных в одинаковых пропорциях.
Для более легкого пилинга можно использовать следующий рецепт:
- жирная сметана – 1 ст.л.;
- желток – 1 шт.;
- измельченные овсяные хлопья – 1 ч.л.;
- лимонный сок – 1 ч.л.
Перед началом процедуры как в домашних условиях, так и в условиях салона, рекомендуется провести тест на степень чувствительности кожного покрова к кислоте.
Перед началом самой процедуры необходимо тщательно очистить кожу от жировых загрязнений и остатков макияжа. Наилучшим образом для этих целей подойдет тоник. Наносить пилинг лучше всего кисточкой, но за неимением таковой можно использовать и обычные ватные диски. Начинать нанесение необходимо со лба, постепенно опускаясь на подбородок. Сразу после завершения процедуры необходимо нанести на лицо увлажняющую маску.
Пилинг молочной кислотой – отзывы
Александра, 30 лет
Молочная кислота для лица – это средство, которое я использую регулярно в осенне-зимний период и весной. Кислотные пилинги при солнечной активности делать нельзя. Пилинг молочной кислотой на регулятной основе освежает кожу, удаляет отмирающие слои эпидермиса и помогает добавить свежести. Люблю использовать это средство для ног, чтобы убрать отвердевшую кожу со ступней.
Анжела, 33 года
Пилинг молочной кислотой решила попробовать из-за проблемной кожи лица – боролась с акне. Результат очень обрадовал, кожа разглаживается, количество прыщей заметно уменьшается. Немного дискомфортно на следующий день, кожа шелушится, но это длится всего день. Использую кислоты невысокой концентрации. Молочная кислота для лица – оптимальное на данный момент средство, которое подходит моей коже. Кроме уменьшения акне кожа омолаживается и выглядит гораздо свежее.
Елена, 41 год
По моему мнению пилинг молочной кислотой – это лучшая процедура для омоложения кожи! Несмотря на то, что такая процедура считается косметологами одной из самых щадящих, результат превзошел все мои ожидания! Возрастные морщины разглаживаются, при регулярных пилингах ощущается накопительный эффект! Всем рекомендую!
Где можно приобрести молочную кислоту и сколько она стоит?
Молочную кислоту найти не так просто: в аптеке она не продается, да и в обычном супермаркете – тоже. Зато ее можно обнаружить в ветеринарных аптеках. Реализуется молочная кислота как в стеклянных, так и в пластиковых флаконах самого разного объема. Цена за литр вещества составляет 400 рублей.
Заключение
Молочная кислота – это весьма популярное вещество в самых разных сферах. Она представляет собой бесцветную водичку со слабо выраженным запахом и ярким кислым вкусом. В естественном виде она содержится практически во всех молочных продуктах. Получают соединение и искусственным путем.
Особенно близко с молочной кислотой знакомы те, кто активно занимаются спортом: именно лактат провоцирует болезненные ощущения в мышцах после интенсивных тренировок. Снижению дискомфорта могут помочь горячие ванны, травяные чаи и качественный здоровый сон.
Молочную кислоту применяют в разных отраслях: она используется в пищевой промышленности, фармацевтике, косметологии и ветеринарии.
Читайте также:
- Гликолевая кислота: что это, плюсы и минусы, отзывы, применение для кожи лица
- Маски от морщин в домашних условиях, более 30-ти рецептов!
- Маски для лица в домашних условиях: от морщин, от прыщей, увлажняющие, питательные, для проблемной, сухой, жирной кожи, от черных точек
- 7 рецептов масок для лица в домашних условиях с куркумой против прыщей и акне
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Загрузка…
Где взять молочную кислоту?
Молочную кислоту за очень скромные деньги и практически в неограниченном объеме можно купить в ветеринарной аптеке. Там она продается без всяких рецептов и ужимок. Прямо как спирт на заводах Брынцалова у охранников. Только совершенно легально.
Есть еще один выход — правда довольно дорогой. Выход этот называется ХИЛАК ФОРТЕ. Вы не ослышались, то самое средство для восстановления микрофлоры желудка после приема антибиотиков. Оно содержит изрядную порцию молочной кислоты.
Есть еще способ — купить ее у разнообразных домашних мыловаров. Способ весьма печальный. Там она будет из ветеринарной аптеки и много раз перелитая из одной емкости в другую. Не советуем.
С чем можно сочетать молочную кислоту?
Молочная кислота это основной компонент пиллингов. Именно там она и должна находиться. Можно использовать не только натуральные масла типа Ши или какао. В принципе «замечательная» косметика Loreal или Рецепты бабушки Агафьи на основе минерального ( машинного ) масла тоже могут быть хорошей основой.
Хотя рекомендовать вам минеральные масла мы, конечно не можем.
В каких косметических продуктах можно встретить молочную кислоту?
– антивозрастная
– пилинг
– крем
– маски
– тоник
– лосьон
– мазь для проблемной кожи
– косметика для волос
Допустимое процентное содержание молочной кислоты в косметике?
– 1-5% — для возрастной, пересушенной и увядающей кожи
– 5-20% — смягчающее действие
– 20-50% — прижигающее действие, для проблемной жирной кожи
В кремах молочная кислота может иметь концентрацию от 1 до 50%.
Можно ли использовать в домашних условиях?
Молочную кислоту можно использовать в домашних условиях — приобретите в аптеке раствор молочной кислоты, медицинский спирт и ватные диски.
Перед нанесением молочной кислоты хорошо очистите кожу. На первом этапе используйте раствор с 30% содержанием молочной кислоты. В дальнейшем концентрацию можно увеличить до 50-70%. Также со временем увеличивайте продолжительность процедуры — с 2 до 25 минут.
На что обратить внимание?
Молочная кислота хорошо отшелушивает частички кожи, но при частом применении может ускорить процессы старения из-за воздействия солнечных лучей. Для того, чтобы избежать негативного воздействия — после процедуры применяйте защитные средства.
Возможна индивидуальная непереносимость — учитывайте этот факт. Аккуратно применяйте при куперозе, чувствительной коже, воспалительных заболеваниях кожи.
Подписывайтесь на наш канал и не забывайте ставить лайк!
Многие люди любят вкусный и полезный кефир, ряженку, йогурт.
Они имеют приятный, слегка кисловатый вкус и являются не только
вкусной, но и полезной пищей для нашего организма. Ведь в них присутствует
молочная кислота, которая необходима нам для здоровья и энергичности.
Молочная кислота активно вырабатывается организмом в результате интенсивных
спортивных тренировок. Ее избыток в теле знаком каждому из нас по
ощущениям крепатуры в мышцах после школьных уроков физкультуры.
Молочная кислота используется организмом для важных химических реакций.
Она необходима для протекания обменных процессов. Напрямую используется
сердечной мышцей, мозгом и нервной системой.
Продукты богатые молочной кислотой:
Ацидофильное молоко
Ряженка
Простокваша
Сыр
Айран
Мороженое
Йогурт (без наполнителя)
Хлеб «Бородинский»
Общая характеристика молочной кислоты
Молочная кислота была открыта в 1780 году шведским химиком и аптекарем Карлом Шееле.
Именно благодаря этому выдающемуся человеку миру стали известны многие органические и неорганические вещества – хлор,
глицерин, синильная и молочная кислоты. Был доказан сложный состав воздуха.
Впервые молочную кислоту нашли в мышцах животных, затем в семенах растений.
В 1807 году шведский минеролог и химик Йенс Якоб Берцелиус выделил из мышц соли молочной кислоты – лактаты.
Молочная кислота вырабатывается нашим организмом в процессе гликолиза
– расщепления углеводов под воздействием ферментов. В большом количестве
кислота вырабатывается в мозге, мышцах, печени, сердце и некоторых других органах.
В продуктах питания при воздействии молочнокислых бактерий, также образуется молочная кислота.
Ее много в простокваше, кефире, ряженке, сметане, квашеной капусте, пиве, сырах и вине.
Молочная кислота также производится на предприятиях химическим путем. Она используется как пищевая добавка и консервант Е-270,
которая для большинства людей считается безопасной при употреблении в пищу.
Она добавляется в детские молочные смеси, заправки для салатов и некоторые кондитерские изделия.
Суточная потребность в молочной кислоте
Суточная потребность организма в этом веществе четко нигде не указывается. Известно, что при недостаточной физической активности, молочная кислота в организме вырабатывается хуже.
В этом случае, для обеспечения организма молочной кислотой, рекомендуется выпивать до двух стаканов простокваши или кефира в день.
Потребность в молочной кислоте возрастает при:
- интенсивных физических нагрузках, когда активность увеличивается в 2 раза;
- при высоких умственных нагрузках;
- во время активного роста и развития организма.
Потребность в молочной кислоте снижается:
- в пожилом возрасте;
- при заболеваниях печени и почек;
- при высоком содержании аммиака в крови.
Усваиваемость молочной кислоты
Молекула молочной кислоты почти в 2 раза меньше молекулы глюкозы.
Именно благодаря этому она очень быстро усваивается организмом. Минуя
всевозможные преграды, она легко проникает сквозь мембраны клеток нашего тела.
Полезные свойства молочной кислоты и ее влияние на организм
Молочная кислота участвует в обеспечении организма энергией, играет важную роль в обменных процессах и в создании глюкозы.
Необходима для полноценной работы миокарда, нервной системы, мозга и некоторых других органов. Оказывает на организм противовоспалительное и антимикробное действие.
Взаимодействие с другими элементами:
Молочная кислота взаимодействует с водой,
кислородом, медью и железом.
Признаки нехватки молочной кислоты в организме:
- недостаток сил;
- проблемы с пищеварением;
- слабая мозговая активность.
Признаки избытка молочной кислоты в организме:
- судороги различного происхождения;
- тяжелые поражения печени (гепатит,
цирроз); - пожилой возраст;
- декомпенсация сахарного диабета;
- большое количество аммиака в крови.
Молочная кислота для красоты и здоровья
Молочная кислота входит в состав средств для удаления кутикулы. Она не повреждает обычную кожу, а действует лишь на ороговевшие слои эпидермиса.
Это ее свойство используется для выведения мозолей и даже бородавок.
Маски для волос из прстокваши неплохо зарекомендовали себя при выпадении волос. Кроме того, волосы становятся блестящими и шелковистыми. Средство хорошо работает на сухих и нормальных волосах.
После 30-минутного выдерживания на волосах, маску смывают теплой водой без применения шампуня.
В секретах красоты наших бабушек можно найти чудодейственный рецепт для сохранения молодости и здоровья кожи – ежедневные умывания кислым молоком.
Старинные рукописи утверждают, что такие умывания способствуют очищению кожи от веснушек и пигментных пятен, делают кожу более гладкой и нежной.
Внимание! Информация носит ознакомительный характер и не предназначена для постановки диагноза и назначения лечения. Всегда консультируйтесь с профильным врачом!
Другие популярные нутриенты:
From Wikipedia, the free encyclopedia
|
||
| Names | ||
|---|---|---|
| Preferred IUPAC name
2-Hydroxypropanoic acid[1] |
||
Other names
|
||
| Identifiers | ||
|
CAS Number |
|
|
|
3D model (JSmol) |
|
|
| 3DMet |
|
|
|
Beilstein Reference |
1720251 | |
| ChEBI |
|
|
| ChEMBL |
|
|
| ChemSpider |
|
|
| ECHA InfoCard | 100.000.017 |
|
| EC Number |
|
|
| E number | E270 (preservatives) | |
|
Gmelin Reference |
362717 | |
|
IUPHAR/BPS |
|
|
| KEGG |
|
|
|
PubChem CID |
|
|
| RTECS number |
|
|
| UNII |
|
|
| UN number | 3265 | |
|
CompTox Dashboard (EPA) |
|
|
|
InChI
|
||
|
SMILES
|
||
| Properties | ||
|
Chemical formula |
C3H6O3 | |
| Molar mass | 90.078 g·mol−1 | |
| Melting point | 18 °C (64 °F; 291 K) | |
| Boiling point | 122 °C (252 °F; 395 K) at 15 mmHg | |
|
Solubility in water |
Miscible[2] | |
| Acidity (pKa) | 3.86,[3] 15.1[4] | |
| Thermochemistry | ||
|
Std enthalpy of |
1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | |
| Pharmacology | ||
|
ATC code |
G01AD01 (WHO) QP53AG02 (WHO) | |
| Hazards | ||
| GHS labelling: | ||
|
Pictograms |
 [5] [5]
|
|
|
Hazard statements |
H315, H318[5] | |
|
Precautionary statements |
P280, P305+P351+P338[5] | |
| Related compounds | ||
|
Other anions |
Lactate | |
|
Related carboxylic acids |
|
|
|
Related compounds |
|
|
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lactic acid is an organic acid. It has a molecular formula CH3CH(OH)COOH. It is white in the solid state and it is miscible with water.[2] When in the dissolved state, it forms a colorless solution. Production includes both artificial synthesis as well as natural sources. Lactic acid is an alpha-hydroxy acid (AHA) due to the presence of a hydroxyl group adjacent to the carboxyl group. It is used as a synthetic intermediate in many organic synthesis industries and in various biochemical industries. The conjugate base of lactic acid is called lactate (or the lactate anion). The name of the derived acyl group is lactoyl.
In solution, it can ionize by loss of a proton to produce the lactate ion CH
3CH(OH)CO−
2. Compared to acetic acid, its pKa is 1 unit less, meaning lactic acid is ten times more acidic than acetic acid. This higher acidity is the consequence of the intramolecular hydrogen bonding between the α-hydroxyl and the carboxylate group.
Lactic acid is chiral, consisting of two enantiomers. One is known as L-lactic acid, (S)-lactic acid, or (+)-lactic acid, and the other, its mirror image, is D-lactic acid, (R)-lactic acid, or (−)-lactic acid. A mixture of the two in equal amounts is called DL-lactic acid, or racemic lactic acid. Lactic acid is hygroscopic. DL-Lactic acid is miscible with water and with ethanol above its melting point, which is about 16 to 18 °C (61 to 64 °F). D-Lactic acid and L-lactic acid have a higher melting point. Lactic acid produced by fermentation of milk is often racemic, although certain species of bacteria produce solely D-lactic acid.[citation needed] On the other hand, lactic acid produced by anaerobic respiration in animal muscles has the (L) enantiomer and is sometimes called “sarcolactic” acid, from the Greek sarx, meaning “flesh”.
In animals, L-lactate is constantly produced from pyruvate via the enzyme lactate dehydrogenase (LDH) in a process of fermentation during normal metabolism and exercise.[6] It does not increase in concentration until the rate of lactate production exceeds the rate of lactate removal, which is governed by a number of factors, including monocarboxylate transporters, concentration and isoform of LDH, and oxidative capacity of tissues.[6] The concentration of blood lactate is usually 1–2 mM at rest, but can rise to over 20 mM during intense exertion and as high as 25 mM afterward.[7][8] In addition to other biological roles, L-lactic acid is the primary endogenous agonist of hydroxycarboxylic acid receptor 1 (HCA1), which is a Gi/o-coupled G protein-coupled receptor (GPCR).[9][10]
In industry, lactic acid fermentation is performed by lactic acid bacteria, which convert simple carbohydrates such as glucose, sucrose, or galactose to lactic acid. These bacteria can also grow in the mouth; the acid they produce is responsible for the tooth decay known as caries.[11][12][13][14] In medicine, lactate is one of the main components of lactated Ringer’s solution and Hartmann’s solution. These intravenous fluids consist of sodium and potassium cations along with lactate and chloride anions in solution with distilled water, generally in concentrations isotonic with human blood. It is most commonly used for fluid resuscitation after blood loss due to trauma, surgery, or burns.
History[edit]
Swedish chemist Carl Wilhelm Scheele was the first person to isolate lactic acid in 1780 from sour milk.[15] The name reflects the lact- combining form derived from the Latin word lac, meaning “milk”. In 1808, Jöns Jacob Berzelius discovered that lactic acid (actually L-lactate) also is produced in muscles during exertion.[16] Its structure was established by Johannes Wislicenus in 1873.
In 1856, the role of Lactobacillus in the synthesis of lactic acid was discovered by Louis Pasteur. This pathway was used commercially by the German pharmacy Boehringer Ingelheim in 1895.
In 2006, global production of lactic acid reached 275,000 tonnes with an average annual growth of 10%.[17]
Production[edit]
Lactic acid is produced industrially by bacterial fermentation of carbohydrates, or by chemical synthesis from acetaldehyde.[18] As of 2009, lactic acid was produced predominantly (70–90%)[19] by fermentation. Production of racemic lactic acid consisting of a 1:1 mixture of D and L stereoisomers, or of mixtures with up to 99.9% L-lactic acid, is possible by microbial fermentation. Industrial scale production of D-lactic acid by fermentation is possible, but much more challenging.
Fermentative production[edit]
Fermented milk products are obtained industrially by fermentation of milk or whey by Lactobacillus bacteria: Lactobacillus acidophilus, Lacticaseibacillus casei (Lactobacillus casei), Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus), Lactobacillus helveticus, Lactococcus lactis , Bacillus amyloliquefaciens, and Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus).
As a starting material for industrial production of lactic acid, almost any carbohydrate source containing C
5 (Pentose sugar) and C
6 (Hexose sugar) can be used. Pure sucrose, glucose from starch, raw sugar, and beet juice are frequently used.[20] Lactic acid producing bacteria can be divided in two classes: homofermentative bacteria like Lactobacillus casei and Lactococcus lactis, producing two moles of lactate from one mole of glucose, and heterofermentative species producing one mole of lactate from one mole of glucose as well as carbon dioxide and acetic acid/ethanol.[21]
Chemical production[edit]
Racemic lactic acid is synthesized industrially by reacting acetaldehyde with hydrogen cyanide and hydrolysing the resultant lactonitrile. When hydrolysis is performed by hydrochloric acid, ammonium chloride forms as a by-product; the Japanese company Musashino is one of the last big manufacturers of lactic acid by this route.[22] Synthesis of both racemic and enantiopure lactic acids is also possible from other starting materials (vinyl acetate, glycerol, etc.) by application of catalytic procedures.[23]
Biology[edit]
Molecular biology[edit]
L-Lactic acid is the primary endogenous agonist of hydroxycarboxylic acid receptor 1 (HCA1), a Gi/o-coupled G protein-coupled receptor (GPCR).[9][10]
Exercise and lactate[edit]
During power exercises such as sprinting, when the rate of demand for energy is high, glucose is broken down and oxidized to pyruvate, and lactate is then produced from the pyruvate faster than the body can process it, causing lactate concentrations to rise. The production of lactate is beneficial for NAD+ regeneration (pyruvate is reduced to lactate while NADH is oxidized to NAD+), which is used up in oxidation of glyceraldehyde 3-phosphate during production of pyruvate from glucose, and this ensures that energy production is maintained and exercise can continue. During intense exercise, the respiratory chain cannot keep up with the amount of hydrogen ions that join to form NADH, and cannot regenerate NAD+ quickly enough.
The resulting lactate can be used in two ways:
- Oxidation back to pyruvate by well-oxygenated muscle cells, heart cells, and brain cells
- Pyruvate is then directly used to fuel the Krebs cycle
- Conversion to glucose via gluconeogenesis in the liver and release back into circulation; see Cori cycle[24]
- If blood glucose concentrations are high, the glucose can be used to build up the liver’s glycogen stores.
However, lactate is continually formed at rest and during all exercise intensities. Lactate serves as a metabolic fuel being produced and oxidatively disposed in resting and exercising muscle. Some causes of this are metabolism in red blood cells that lack mitochondria, and limitations resulting from the enzyme activity that occurs in muscle fibers having high glycolytic capacity.[24] Lactic acidosis is a physiological condition characterized by accumulation of lactate (especially L-lactate), with formation of an excessively low pH in the tissues – a form of metabolic acidosis.
Lactic acidosis during exercise may occur due to the H+ from ATP hydrolysis (ATP4− + H2O → ADP3− + HPO2−
4 + H+), and that reducing pyruvate to lactate (pyruvate− + NADH + H+ → lactate− + NAD+) actually consumes H+.[25] The causative factors of the increase in [H+] result from the production of lactate− from a neutral molecule, increasing [H+] to maintain electroneutrality.[26] A contrary view is that lactate− is produced from pyruvate−, which has the same charge. It is pyruvate− production from neutral glucose that generates H+:
| C6H12O6 + 2 NAD+ + 2 ADP3− + 2 HPO2− 4 |
→ | 2 CH 3COCO− 2 + 2 H+ + 2 NADH + 2 ATP4− + 2 H2O |
|
| Subsequent lactate− production absorbs these protons: | |||
| 2 CH 3COCO− 2 + 2 H+ + 2 NADH |
→ | 2 CH 3CH(OH)CO− 2 + 2 NAD+ |
|
| Overall: | |||
| C6H12O6 + 2 NAD+ + 2 ADP3− + 2 HPO2− 4 |
→ | 2 CH 3COCO− 2 + 2 H+ + 2 NADH + 2 ATP4− + 2 H2O |
|
| → | 2 CH 3CH(OH)CO− 2 + 2 NAD+ + 2 ATP4− + 2 H2O |
Although the reaction glucose → 2 lactate− + 2 H+ releases two H+ when viewed on its own, the H+ are absorbed in the production of ATP. On the other hand, the absorbed acidity is released during subsequent hydrolysis of ATP: ATP4− + H2O → ADP3− + HPO2−
4 + H+. So once the use of ATP is included, the overall reaction is
- C6H12O6 → 2 CH
3COCO−
2 + 2 H+
The generation of CO2 during respiration also causes an increase in [H+].
Neural tissue energy source[edit]
Although glucose is usually assumed to be the main energy source for living tissues, there are a few reports that indicate that it is lactate, and not glucose, that is preferentially metabolized by neurons in the brain of several mammalian species (the notable ones being mice, rats, and humans).[27][28][non-primary source needed] According to the lactate-shuttle hypothesis, glial cells are responsible for transforming glucose into lactate, and for providing lactate to the neurons.[29][30] Because of this local metabolic activity of glial cells, the extracellular fluid immediately surrounding neurons strongly differs in composition from the blood or cerebrospinal fluid, being much richer with lactate, as was found in microdialysis studies.[27]
Brain development metabolism[edit]
Some evidence suggests that lactate is important at early stages of development for brain metabolism in prenatal and early postnatal subjects, with lactate at these stages having higher concentrations in body liquids, and being utilized by the brain preferentially over glucose.[27] It was also hypothesized that lactate may exert a strong action over GABAergic networks in the developing brain, making them more inhibitory than it was previously assumed,[31] acting either through better support of metabolites,[27] or alterations in base intracellular pH levels,[32][33] or both.[34]
Studies of brain slices of mice show that β-hydroxybutyrate, lactate, and pyruvate act as oxidative energy substrates, causing an increase in the NAD(P)H oxidation phase, that glucose was insufficient as an energy carrier during intense synaptic activity and, finally, that lactate can be an efficient energy substrate capable of sustaining and enhancing brain aerobic energy metabolism in vitro.[35] The study “provides novel data on biphasic NAD(P)H fluorescence transients, an important physiological response to neural activation that has been reproduced in many studies and that is believed to originate predominantly from activity-induced concentration changes to the cellular NADH pools.”[36]
Lactate can also serve as an important source of energy for other organs, including the heart and liver. During physical activity, up to 60% of the heart muscle’s energy turnover rate derives from lactate oxidation.[15]
Blood testing[edit]
Blood tests for lactate are performed to determine the status of the acid base homeostasis in the body. Blood sampling for this purpose is often arterial (even if it is more difficult than venipuncture), because lactate levels differ substantially between arterial and venous, and the arterial level is more representative for this purpose.
| Lower limit | Upper limit | Unit | |
|---|---|---|---|
| Venous | 4.5[37] | 19.8[37] | mg/dL |
| 0.5[38] | 2.2[38] | mmol/L | |
| Arterial | 4.5[37] | 14.4[37] | mg/dL |
| 0.5[38] | 1.6[38] | mmol/L |
During childbirth, lactate levels in the fetus can be quantified by fetal scalp blood testing.
Uses[edit]
Polymer precursor[edit]
Two molecules of lactic acid can be dehydrated to the lactone lactide. In the presence of catalysts lactide polymerize to either atactic or syndiotactic polylactide (PLA), which are biodegradable polyesters. PLA is an example of a plastic that is not derived from petrochemicals.
Pharmaceutical and cosmetic applications[edit]
Lactic acid is also employed in pharmaceutical technology to produce water-soluble lactates from otherwise-insoluble active ingredients. It finds further use in topical preparations and cosmetics to adjust acidity and for its disinfectant and keratolytic properties.
Lactic acid containing bacteria have shown promise in reducing oxaluria with its descaling properties on calcium compounds.[39]
Foods[edit]
Fermented food[edit]
Lactic acid is found primarily in sour milk products, such as kumis, laban, yogurt, kefir, and some cottage cheeses. The casein in fermented milk is coagulated (curdled) by lactic acid. Lactic acid is also responsible for the sour flavor of sourdough bread.
In lists of nutritional information lactic acid might be included under the term “carbohydrate” (or “carbohydrate by difference”) because this often includes everything other than water, protein, fat, ash, and ethanol.[40] If this is the case then the calculated food energy may use the standard 4 kilocalories (17 kJ) per gram that is often used for all carbohydrates. But in some cases lactic acid is ignored in the calculation.[41] The energy density of lactic acid is 362 kilocalories (1,510 kJ) per 100 g.[42]
Some beers (sour beer) purposely contain lactic acid, one such type being Belgian lambics. Most commonly, this is produced naturally by various strains of bacteria. These bacteria ferment sugars into acids, unlike the yeast that ferment sugar into ethanol. After cooling the wort, yeast and bacteria are allowed to “fall” into the open fermenters. Brewers of more common beer styles would ensure that no such bacteria are allowed to enter the fermenter. Other sour styles of beer include Berliner weisse, Flanders red and American wild ale.[43][44]
In winemaking, a bacterial process, natural or controlled, is often used to convert the naturally present malic acid to lactic acid, to reduce the sharpness and for other flavor-related reasons. This malolactic fermentation is undertaken by lactic acid bacteria.
While not normally found in significant quantities in fruit, lactic acid is the primary organic acid in akebia fruit, making up 2.12% of the juice.[45]
Separately added[edit]
As a food additive it is approved for use in the EU,[46] United States[47] and Australia and New Zealand;[48] it is listed by its INS number 270 or as E number E270. Lactic acid is used as a food preservative, curing agent, and flavoring agent.[49] It is an ingredient in processed foods and is used as a decontaminant during meat processing.[50] Lactic acid is produced commercially by fermentation of carbohydrates such as glucose, sucrose, or lactose, or by chemical synthesis.[49] Carbohydrate sources include corn, beets, and cane sugar.[51]
Forgery[edit]
Lactic acid has historically been used to assist with the erasure of inks from official papers to be modified during forgery.[52]
Cleaning products[edit]
Lactic acid is used in some liquid cleaners as a descaling agent for removing hard water deposits such as calcium carbonate, forming the lactate, calcium lactate. Owing to its high acidity, such deposits are eliminated very quickly, especially where boiling water is used, as in kettles. It is used in some antibacterial soaps and dish detergents as a replacement for triclosan.
See also[edit]
- Category: Salts of lactic acid
- Category:Lactate esters
- Acids in wine
- Alanine cycle
- Biodegradable plastic
- Dental caries
- MCT1, a lactate transporter
- Thiolactic acid
- Methacrylic acid
References[edit]
- ^ a b “CHAPTER P-6. Applications to Specific Classes of Compounds”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 748. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ a b Record in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ Dawson RM, et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ^ Silva AM, Kong X, Hider RC (October 2009). “Determination of the pKa value of the hydroxyl group in the alpha-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems”. Biometals. 22 (5): 771–8. doi:10.1007/s10534-009-9224-5. PMID 19288211. S2CID 11615864.
- ^ a b c Sigma-Aldrich Co., DL-Lactic acid.
- ^ a b Summermatter S, Santos G, Pérez-Schindler J, Handschin C (May 2013). “Skeletal muscle PGC-1α controls whole-body lactate homeostasis through estrogen-related receptor α-dependent activation of LDH B and repression of LDH A”. Proceedings of the National Academy of Sciences of the United States of America. 110 (21): 8738–43. Bibcode:2013PNAS..110.8738S. doi:10.1073/pnas.1212976110. PMC 3666691. PMID 23650363.
- ^ “Lactate Profile”. UC Davis Health System, Sports Medicine and Sports Performance. Retrieved 23 November 2015.
- ^ Goodwin ML, Harris JE, Hernández A, Gladden LB (July 2007). “Blood lactate measurements and analysis during exercise: a guide for clinicians”. Journal of Diabetes Science and Technology. 1 (4): 558–69. doi:10.1177/193229680700100414. PMC 2769631. PMID 19885119.
- ^ a b Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (June 2011). “International Union of Basic and Clinical Pharmacology. LXXXII: Nomenclature and Classification of Hydroxy-carboxylic Acid Receptors (GPR81, GPR109A, and GPR109B)”. Pharmacological Reviews. 63 (2): 269–90. doi:10.1124/pr.110.003301. PMID 21454438.
- ^ a b Offermanns S, Colletti SL, IJzerman AP, Lovenberg TW, Semple G, Wise A, Waters MG. “Hydroxycarboxylic acid receptors”. IUPHAR/BPS Guide to Pharmacology. International Union of Basic and Clinical Pharmacology. Retrieved 13 July 2018.
- ^ Badet C, Thebaud NB (2008). “Ecology of lactobacilli in the oral cavity: a review of literature”. The Open Microbiology Journal. 2: 38–48. doi:10.2174/1874285800802010038. PMC 2593047. PMID 19088910.
- ^ Nascimento MM, Gordan VV, Garvan CW, Browngardt CM, Burne RA (April 2009). “Correlations of oral bacterial arginine and urea catabolism with caries experience”. Oral Microbiology and Immunology. 24 (2): 89–95. doi:10.1111/j.1399-302X.2008.00477.x. PMC 2742966. PMID 19239634.
- ^ Aas JA, Griffen AL, Dardis SR, Lee AM, Olsen I, Dewhirst FE, Leys EJ, Paster BJ (April 2008). “Bacteria of dental caries in primary and permanent teeth in children and young adults”. Journal of Clinical Microbiology. 46 (4): 1407–17. doi:10.1128/JCM.01410-07. PMC 2292933. PMID 18216213.
- ^ Caufield PW, Li Y, Dasanayake A, Saxena D (2007). “Diversity of lactobacilli in the oral cavities of young women with dental caries”. Caries Research. 41 (1): 2–8. doi:10.1159/000096099. PMC 2646165. PMID 17167253.
- ^ a b Parks, Scott K.; Mueller-Klieser, Wolfgang; Pouysségur, Jacques (2020). “Lactate and Acidity in the Cancer Microenvironment”. Annual Review of Cancer Biology. 4: 141–158. doi:10.1146/annurev-cancerbio-030419-033556.
- ^ Roth SM. “Why does lactic acid build up in muscles? And why does it cause soreness?”. Scientific American. Retrieved 23 January 2006.
- ^ “NNFCC Renewable Chemicals Factsheet: Lactic Acid”. NNFCC.
- ^ H. Benninga (1990): “A History of Lactic Acid Making: A Chapter in the History of Biotechnology”. Volume 11 of Chemists and Chemistry. Springer, ISBN 0792306252, 9780792306252
- ^ Endres H (2009). Technische Biopolymere. München: Hanser-Verlag. p. 103. ISBN 978-3-446-41683-3.
- ^ Groot W, van Krieken J, Slekersl O, de Vos S (19 October 2010). “Chemistry and production of lactic acid, lactide and poly(lactic acid)”. In Auras R, Lim L, Selke SE, Tsuji H (eds.). Poly(Lactic acid). Hoboken: Wiley. p. 3. ISBN 978-0-470-29366-9.
- ^ König H, Fröhlich J (2009). Lactic acid bacteria in Biology of Microorganisms on Grapes, in Must and in Wine. Springer-Verlag. p. 3. ISBN 978-3-540-85462-3.
- ^ Westhoff, Gerrit; Starr, John N. (2012). “Lactic Acids”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_097.pub3.
- ^ Shuklov IA, Dubrovina NV, Kühlein K, Börner A (2016). “Chemo-Catalyzed Pathways to Lactic Acid and Lactates”. Advanced Synthesis and Catalysis. 358 (24): 3910–3931. doi:10.1002/adsc.201600768.
- ^ a b McArdle WD, Katch FI, Katch VL (2010). Exercise Physiology: Energy, Nutrition, and Human Performance. Wolters Kluwer/Lippincott Williams & Wilkins Health. ISBN 978-0-683-05731-7.
- ^ Robergs RA, Ghiasvand F, Parker D (September 2004). “Biochemistry of exercise-induced metabolic acidosis”. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 287 (3): R502–R516. doi:10.1152/ajpregu.00114.2004. PMID 15308499. S2CID 2745168.
- ^ Lindinger MI, Kowalchuk JM, Heigenhauser GJ (September 2005). “Applying physicochemical principles to skeletal muscle acid-base status”. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 289 (3): R891–4, author reply R904–910. doi:10.1152/ajpregu.00225.2005. PMID 16105823.
- ^ a b c d Zilberter Y, Zilberter T, Bregestovski P (September 2010). “Neuronal activity in vitro and the in vivo reality: the role of energy homeostasis”. Trends in Pharmacological Sciences. 31 (9): 394–401. doi:10.1016/j.tips.2010.06.005. PMID 20633934.
- ^ Wyss MT, Jolivet R, Buck A, Magistretti PJ, Weber B (May 2011). “In vivo evidence for lactate as a neuronal energy source” (PDF). The Journal of Neuroscience. 31 (20): 7477–85. doi:10.1523/JNEUROSCI.0415-11.2011. PMC 6622597. PMID 21593331.
- ^ Gladden LB (July 2004). “Lactate metabolism: a new paradigm for the third millennium”. The Journal of Physiology. 558 (Pt 1): 5–30. doi:10.1113/jphysiol.2003.058701. PMC 1664920. PMID 15131240.
- ^ Pellerin L, Bouzier-Sore AK, Aubert A, Serres S, Merle M, Costalat R, Magistretti PJ (September 2007). “Activity-dependent regulation of energy metabolism by astrocytes: an update”. Glia. 55 (12): 1251–62. doi:10.1002/glia.20528. PMID 17659524. S2CID 18780083.
- ^ Holmgren CD, Mukhtarov M, Malkov AE, Popova IY, Bregestovski P, Zilberter Y (February 2010). “Energy substrate availability as a determinant of neuronal resting potential, GABA signaling and spontaneous network activity in the neonatal cortex in vitro”. Journal of Neurochemistry. 112 (4): 900–12. doi:10.1111/j.1471-4159.2009.06506.x. PMID 19943846. S2CID 205621542.
- ^ Tyzio R, Allene C, Nardou R, Picardo MA, Yamamoto S, Sivakumaran S, Caiati MD, Rheims S, Minlebaev M, Milh M, Ferré P, Khazipov R, Romette JL, Lorquin J, Cossart R, Khalilov I, Nehlig A, Cherubini E, Ben-Ari Y (January 2011). “Depolarizing actions of GABA in immature neurons depend neither on ketone bodies nor on pyruvate”. The Journal of Neuroscience. 31 (1): 34–45. doi:10.1523/JNEUROSCI.3314-10.2011. PMC 6622726. PMID 21209187.
- ^ Ruusuvuori E, Kirilkin I, Pandya N, Kaila K (November 2010). “Spontaneous network events driven by depolarizing GABA action in neonatal hippocampal slices are not attributable to deficient mitochondrial energy metabolism”. The Journal of Neuroscience. 30 (46): 15638–42. doi:10.1523/JNEUROSCI.3355-10.2010. PMC 6633692. PMID 21084619.
- ^ Khakhalin AS (September 2011). “Questioning the depolarizing effects of GABA during early brain development”. Journal of Neurophysiology. 106 (3): 1065–7. doi:10.1152/jn.00293.2011. PMID 21593390. S2CID 13966338.
- ^ Ivanov A, Mukhtarov M, Bregestovski P, Zilberter Y (2011). “Lactate Effectively Covers Energy Demands during Neuronal Network Activity in Neonatal Hippocampal Slices”. Frontiers in Neuroenergetics. 3: 2. doi:10.3389/fnene.2011.00002. PMC 3092068. PMID 21602909.
- ^ Kasischke K (2011). “Lactate fuels the neonatal brain”. Frontiers in Neuroenergetics. 3: 4. doi:10.3389/fnene.2011.00004. PMC 3108381. PMID 21687795.
- ^ a b c d Blood Test Results – Normal Ranges Archived 2 November 2012 at the Wayback Machine Bloodbook.Com
- ^ a b c d Derived from mass values using molar mass of 90.08 g/mol
- ^ Campieri, C.; Campieri, M.; Bertuzzi, V.; Swennen, E.; Matteuzzi, D.; Stefoni, S.; Pirovano, F.; Centi, C.; Ulisse, S.; Famularo, G.; De Simone, C. (September 2001). “Reduction of oxaluria after an oral course of lactic acid bacteria at high concentration”. Kidney International. 60 (3): 1097–1105. doi:10.1046/j.1523-1755.2001.0600031097.x. ISSN 0085-2538. PMID 11532105.
- ^ “USDA National Nutrient Database for Standard Reference, Release 28 (2015) Documentation and User Guide” (PDF). 2015. p. 13.
- ^ For example, in this USDA database entry for yoghurt the food energy is calculated using given coefficients for carbohydrate, fat, and protein. (One must click on “Full report” to see the coefficients.) The calculated value is based on 4.66 grams of carbohydrate, which is exactly equal to the sugars.
- ^ Greenfield H, Southgate D (2003). Food Composition Data: Production, Management and Use. Rome: FAO. p. 146. ISBN 9789251049495.
- ^ “Brewing With Lactic Acid Bacteria”. MoreBeer.
- ^ Lambic (Classic Beer Style) – Jean Guinard
- ^ Li, Li; Yao, Xiaohong; Zhong, Caihong; Chen, Xuzhong (January 2010). “Akebia: A Potential New Fruit Crop in China”. HortScience. 45 (1): 4–10. doi:10.21273/HORTSCI.45.1.4.
- ^ “Current EU approved additives and their E Numbers”. UK Food Standards Agency. Retrieved 27 October 2011.
- ^ “Listing of Food Additives Status Part II”. US Food and Drug Administration. Retrieved 27 October 2011.
- ^ “Standard 1.2.4 – Labelling of ingredients”. Australia New Zealand Food Standards Code. Retrieved 27 October 2011.
- ^ a b “Listing of Specific Substances Affirmed as GRAS:Lactic Acid”. US FDA. Retrieved 20 May 2013.
- ^ “Purac Carcass Applications”. Purac. Archived from the original on 29 July 2013. Retrieved 20 May 2013.
- ^ “Agency Response Letter GRAS Notice No. GRN 000240”. FDA. US FDA. Retrieved 20 May 2013.
- ^ Druckerman P (2 October 2016). “If I Sleep for an Hour, 30 People Will Die”. The New York Times.
External links[edit]
- Corn Plastic to the Rescue Archived 21 November 2013 at the Wayback Machine
- Lactic Acid: Information and Resources
- Lactic Acid Is Not Muscles’ Foe, It’s Fuel
- Fitzgerald M (26 January 2010). “The Lactic Acid Myths”. Competitor Running. Archived from the original on 25 August 2018.