поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,904 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
|
74 / 74 / 13 Регистрация: 21.10.2010 Сообщений: 376 |
|
|
1 |
|
Определить молярность соляной кислоты.01.03.2012, 20:43. Показов 25217. Ответов 9
Решил, но не уверен. Можете расписать подробно, пожалуйста?) 3) Определить молярность соляной кислоты (p=1,18г/мл), содержащей 36,5% хлористого водорода.
0 |
|
Programming Эксперт 94731 / 64177 / 26122 Регистрация: 12.04.2006 Сообщений: 116,782 |
01.03.2012, 20:43 |
|
9 |
|
Модератор 35198 / 19414 / 4063 Регистрация: 12.02.2012 Сообщений: 32,432 Записей в блоге: 13 |
|
|
17.07.2012, 10:55 |
2 |
|
Берем 1 л такого раствора. Его масса равна 1000*1.18=1180 г. В нем содержится 36.5% HCl т.е. 1180*0.365=430.7 г HCl. Молекулярная масса HCl = 1+35.5=36.5 Делим 430.7 на 36.5 и получаем 11.8. Молярность раствора = 11.8
2 |
|
5 / 5 / 0 Регистрация: 16.07.2012 Сообщений: 51 |
|
|
23.08.2012, 14:19 |
3 |
|
не могу сдержаться, чтоб не восхититься умами народа!
0 |
|
Модератор 35198 / 19414 / 4063 Регистрация: 12.02.2012 Сообщений: 32,432 Записей в блоге: 13 |
|
|
23.08.2012, 14:42 |
4 |
|
позволю себе засомневаться , что министр медицины или близких сфер такое решит.. – я где-то ошибся?
0 |
|
5 / 5 / 0 Регистрация: 16.07.2012 Сообщений: 51 |
|
|
23.08.2012, 14:45 |
5 |
|
нет ну что вы..
0 |
|
Модератор 35198 / 19414 / 4063 Регистрация: 12.02.2012 Сообщений: 32,432 Записей в блоге: 13 |
|
|
23.08.2012, 15:22 |
6 |
|
Спасибо, тогда дополню свой ответ: Министру здравоохранения такие задачи решать и не надо. У него другие функции.
0 |
|
5 / 5 / 0 Регистрация: 16.07.2012 Сообщений: 51 |
|
|
23.08.2012, 15:24 |
7 |
|
ахххах
0 |
|
555 / 509 / 25 Регистрация: 23.07.2009 Сообщений: 2,359 Записей в блоге: 1 |
|
|
23.08.2012, 15:48 |
8 |
|
под ником Hi4ko как раз и зарегистрирован министр здравоохранения. когда у него возникает потребность решить школьную задачу, он просто открывает тему и через 5 минут получает ответ. “настоящий полковник!”
0 |
|
5 / 5 / 0 Регистрация: 16.07.2012 Сообщений: 51 |
|
|
27.08.2012, 12:27 |
9 |
|
0 |
|
vetvet |
|||||
|
27.08.2012, 13:26
|
|||||
0 |
Ученик
(90),
закрыт
13 лет назад
Н.М.
Просветленный
(23726)
13 лет назад
Молярность- это количество моль в 1 литре раствора, массовая доля- это количество г вещества в 100 г раствора, поэтому:
В 100 г раствора – 36,2 г вещества ( НС1)
в 1000 *1,18 г – Х г вещества Х=427,16 г
1 моль НС1 – 36,5 г
Х моль НС1 – 427,16 г Х=11,7 молей в 1 л – молярность
Артур Ханнанов
Мастер
(1531)
13 лет назад
Молярность значит содержание количество моль растворенного вещества на литр раствора.
Молярная масса HCl 35,5+1= 36,5 г/моль
В одном литре раствора HCl содержится (1000*1,18*36,2%)/36,5=11,7 моль
Значит, молярность раствора 11,7 М
| Соляная кислота | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
Хлороводородная кислота |
| Хим. формула | HCl |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 48 °C |
| Энтальпия | |
| • образования | -605.22 кДж/моль |
| Давление пара | 190 гПа[3] |
| Химические свойства | |
Константа диссоциации кислоты  |
-10 |
| Растворимость | |
| • в воде | Растворима |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| Рег. номер EINECS | 933-977-5 |
| Кодекс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| Предельная концентрация | 5 мг/м³[1] |
| Токсичность | 3 класс опасности[2] |
| Пиктограммы СГС |
|
| NFPA 704 |
0 3 1 ACID |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Соля́ная кислота́ (также хлороводоро́дная, или хлористоводоро́дная кислота, химическая формула — HCl) — сильная химическая неорганическая кислота. Раствор хлороводорода в воде.
При стандартных условиях — это сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
История[править | править код]
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII веке получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[4].
Физические свойства[править | править код]
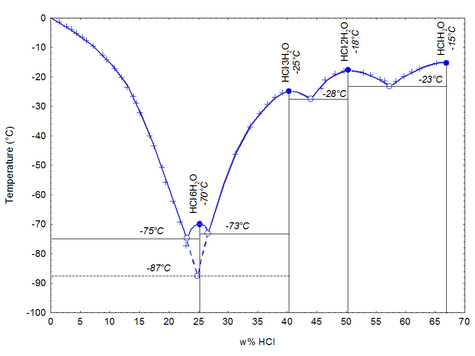
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Концентрация (вес), мас. % | Концентрация (г/л), кг HCl/м³ | Плотность, кг/л | Молярность, M, или моль/л | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, кПа | Температура кипения, °C | Температура плавления, °C |
|---|---|---|---|---|---|---|---|---|---|
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 1,95 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 1,40 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 2,13 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,73 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 7,24 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,50 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,30 | 48 | −26 |
При 20 °C, 1 атм (101,325 кПа)
При низкой температуре хлороводород с водой даёт кристаллогидраты составов 




Химические свойства[править | править код]
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
-
,
,
.
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
-
,
,
.
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
-
,
,
.
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например, с угольной кислотой:
-
.
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
-
.
Соляная кислота (в стакане) взаимодействует с аммиаком
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристаллов хлорида аммония[6]:
-
.
- Качественная реакция на соляную кислоту и её соли — взаимодействие кислоты с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[7]:
-
.
Получение[править | править код]
Соляную кислоту получают растворением газообразного хлороводорода (HCl) в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный алхимиками способ, заключающийся в действии концентрированной серной кислоты на твёрдую поваренную соль:
-
.
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
-
.
Получение путём гидролиза хлоридов магния, алюминия (производится нагревание гидратированной соли):
-
,
.
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
-
[8]
В промышленности хлороводород получают реакцией горения водорода в хлоре:
Хлороводород хорошо растворим в воде. Так, при 0 °C один объём воды может поглотить 507 объёмов 

Применение[править | править код]
Промышленность[править | править код]
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления сельтерской (содовой) воды.
Медицина[править | править код]
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения[править | править код]
Соляная кислота относится к веществам III класса опасности[2]. Рекомендуемая ПДК в рабочей зоне — 5 мг/м³[1].
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно пищевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия), образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[9].
Примечания[править | править код]
- ↑ 1 2 ГОСТ 12.1.005-76 “Воздух рабочей зоны. Санитарно-гигиенические требования”.
- ↑ 1 2 ГОСТ 12.1.007-76 “Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности”.
- ↑ https://gestis.dguv.de/data?name=520030
- ↑ Ullmann, 2000, p. 191.
- ↑ Ullmann, 2000, p. 194.
- ↑ Дым без огня: взаимодействие аммиака с хлороводородом Архивная копия от 4 марта 2016 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Ходаков Ю.В., Эпштейн Д. А., Глориозов П. А. § 82. Соляная кислота // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 195—196. — 240 с. — 1 630 000 экз.
- ↑ page-book.ru — Реми Г. Курс неорганической химии (Том 1): Стр.301. Дата обращения: 23 августа 2012. Архивировано из оригинала 11 мая 2013 года.
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398 Архивировано 30 июня 2016 года.
Ссылки[править | править код]
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
В уроке 15 «Моляльность и молярность» из курса «Химия для чайников» рассмотрим понятия растворитель и растворенное вещество научимся выполнять расчет молярной и моляльной концентрации, а также разбавлять растворы. Невозможно объяснить что такое моляльность и молярность, если вы не знакомы с понятием моль вещества, поэтому не поленитесь и прочитайте предыдущие уроки. Кстати, в прошлом уроке мы разбирали задачи на выход реакции, посмотрите если вам интересно.
Химикам нередко приходится работать с жидкими растворами, так как это благоприятная среда для протекания химических реакций. Жидкости легко смешивать, в отличие от кристаллических тел, а также жидкость занимает меньший объем, по сравнению с газом. Благодаря этим достоинствам, химические реакции могут осуществляться гораздо быстрее, так как исходные реагенты в жидкой среде часто сближаются и сталкиваются друг с другом. В прошлых уроках мы отмечали, что вода относится к полярным жидкостям, и потому является неплохим растворителем для проведения химических реакций. Молекулы H2O, а также ионы H+ и OH—, на которых вода диссоциирована в небольшой степени, могут способствовать запуску химические реакций, благодаря поляризации связей в других молекулах или ослаблению связи между атомами. Вот почему жизнь на Земле зародилась не на суше или в атмосфере, а именно в воде.
Содержание
- Растворитель и растворенное вещество
- Расчет концентрации раствора
- Молярная концентрация
- Моляльная концентрация
- Разбавление растворов
Растворитель и растворенное вещество
Раствор может быть образован путем растворения газа в жидкости или твердого тела в жидкости. В обоих случаях жидкость является растворителем, а другой компонент — растворенное вещество. Когда раствор образован путем смешивания двух жидкостей, растворителем считается та жидкость, которая находится в большем количестве, иначе говоря имеет бОльшую концентрацию.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
- cx, Смx, [x], где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
- См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
- 264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
- 1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
- 264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
- 2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
- m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
- 5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
- 1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
- 0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Разбавление растворов
В химической практике часто занимаются разбавлением растворов, т.е добавлением растворителя. Просто нужно запомнить, что число молей растворенного вещества при разбавлении раствора остается неизменным. И еще запомните формулу правильного разбавления раствора:
- Число молей растворенного вещества = c1V1 = c2V2
где с1 и V1 — молярная концентрация и объем раствора до разбавления, с2 и V2 — молярная концентрация и объем раствора после разбавления. Рассмотрите задачи на разбавление растворов:
Пример 3. Определите молярность раствора, полученного разбавлением 175 мл 2,00 М раствора до 1,00 л.
Решение:
В условие задача указаны значения с1, V1 и V2, поэтому пользуясь формулой разбавления растворов, выразим молярную концентрацию полученного раствора с2
- с2 = c1V1 / V2 = (2,00 М × 175 мл) / 1000 мл = 0,350 М
Пример 4 самостоятельно. До какого объема следует разбавить 5,00 мл 6,00 М раствора HCl, чтобы его молярность стала 0,1 М?
Ответ: V2 = 300 мл
Без сомнения, вы и сами догадались, что урок 15 «Моляльность и молярность» очень важный, ведь 90% все лабораторных по химии связаны с приготовлением растворов нужной концентрации. Поэтому проштудируйте материал от корки до корки. Если у вас возникли вопросы, пишите их в комментарии.




















![{displaystyle {ce {NaCl +H2SO4->[150~^{circ }{text{C}}]NaHSO4 +HCluparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31c500c5efd09073bccc057fd23c8deb9d6fc626)
![{displaystyle {ce {2NaCl +H2SO4->[550~^{circ }{text{C}}]Na2SO4 +2HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abc573c441548e6d496e060dcdb41811744f5651)
![{displaystyle {ce {MgCl2.6H2O->[t,~^{circ }{text{C}}]MgO +2HCl +5H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/24925dc7c0762665130fe80c78ff44d845e9b6da)
![{displaystyle {ce {AlCl3.6H2O->[t,~^{circ }{text{C}}]Al(OH)3 +3HCl +3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7fb3020a9dede930d68ce1259759acbf733375d)









