-

n (BaCl2) = 25 г / 208 г/моль = 0.12 моль
с=0,12 моль / 0,3 л = 0,4 моль/л
Ответ: 0,4 моль/л.
- Комментировать
- Жалоба
- Ссылка
-

Найди верный ответ на вопрос ✅ «Определите молярную концентрацию раствора флорида бария BaCl2, если 300 мл его раствора содержат 25 грамм данной соли. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Определите молярную концентрацию раствора флорида бария BaCl2, если 300 мл его раствора содержат 25 грамм данной соли.
Ученик
(105),
закрыт
11 лет назад
Lili4ka
Профи
(531)
11 лет назад
Молярность=(Масса вещества*1000)/(Молярная масса*Объем)
Процентная концентрация= (Масса вещества*100)/(Плотность*Объем)
Из второй формулы находим: (если не указан объем, расчет делается на 1000 мл)
Масса вещества=0,1*1*1000/100=1 г
Молярная масса=137+35,5*2=208 г/моль
Молярность=1*1000/208*1000=0,005 моль/л
2022-08-16 ![]()
В 1 л раствора хлорида бария содержится 2,64 моль ионов $Ba^{2+}$ и $Cl^{-}$. Рассчитайте молярную концентрацию (моль/л) хлорида бария в растворе, если степень диссоциации соли равна 88 %.
Решение:
Способ 1
1. Необходимо помнить, что степень диссоциации $alpha$ – это отношение числа молекул, распавшихся на ионы $n$, к общему числу растворенных молекул $N$:
$alpha = frac{n}{N} cdot 100 text{ %}$.
Степень диссоциации можно выразить и через количество вещества:
$alpha = frac{n_{дис}}{n_{общ} } cdot 100 text{ % }$.
$BaCl_{2}$ – сильный электролит, однако в данном растворе диссоциирует не полностью, степень диссоциации не 100, а 88 %.
Напишем уравнение диссоциации:
$BaCl_{2} = Ba^{2+} + 2Cl^{-}$.
Оно показывает, что ионов хлора образуется в 2 раза больше, чем ионов бария, следовательно, из суммарного числа ионов (2,64 моль по условию) 2/3 приходится на ионы хлора, а 1/3 – на ионы бария:
$n(Ba^{2+}) = 2,64 cdot frac{1}{3} = 0,88 (моль)$;
$n(Cl^{-}) = 2,64 cdot frac{2}{3} = 1,76 (моль)$.
По уравнению диссоциации $n(BaCl_{2}) = n(Ba^{2+}) = 0,88 моль$, следовательно, $n_{дис} = 0,88 моль$.
Количество вещества исходной соли выражаем через степень диссоциации:
$n_{общ} = frac{n_{дис} cdot 100 text{ % }}{ alpha }; n_{общ} = frac{0,88 моль cdot 100 text{ % }}{88 text{ % } } = 1,0 моль$.
Определим молярную концентрацию хлорида бария:
$c = frac{n}{V}; c(BaCl_{2}) = frac{1,0 моль}{1 л} = 1,0 моль/л$.
Способ 2
Пусть количество вещества продиссоциировавшей соли равно $x$ моль, тогда $n(Ba^{2+}) = x$ моль, а $n(Cl^{-}) = 2x$ моль.
По условию задачи суммарное количество ионов бария и хлора 2,64 моль, следовательно, $2,64 = x + 2x$, отсюда $x = 0,88 моль$. Таким образом, мы нашли количество вещества продиссоцииро-вавшей соли.
Дальнейшее решение одинаково для обоих способов.
Ответ: $c(BaCl_{2}) = 1,0 моль/л$.
Вычисление приближенного значения ионной силы аствора электролита
Задача 532.
Вычислить ионную силу и активность ионов в растворе содержащем 0,01 моль/л Сa(NO3)2 и 0,01 моль/л CaCl2.
Решение:
В водных растворах электролитов коэффициент активности зависит от концентрации и заряда всех
присутствующих в растворе ионов. Для количественного выражения этой зависимости введено понятие об ионной силе раствора I, которая численно равна полусумме произведений концентрации (CM) каждого иона на квадрат его заряда Z:
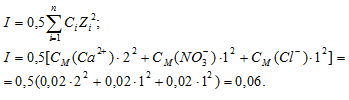
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:
 (ион) = fCM,
(ион) = fCM,
где f – коэффициент активности иона.
Значение коэффициента активности иона рассчитаем по формуле:
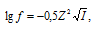
получим:
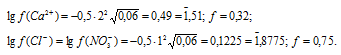
Определяем активность ионов Ca2+, NO3– и Cl–, учитывая, что концентрации ионов одинаковы и равны 0,02моль/л:
 (Ca2+) = f(Ca2+) . CM(Ca2+) = 0,32 . 0,02 = 6,4 . 10-3 моль/л;
(Ca2+) = f(Ca2+) . CM(Ca2+) = 0,32 . 0,02 = 6,4 . 10-3 моль/л;
 (NO3–) =
(NO3–) =  (Cl–) = f(Cl–) . CM(Cl–) = 0,75 . 0,02 = 1,5 . 10-2 моль/л.
(Cl–) = f(Cl–) . CM(Cl–) = 0,75 . 0,02 = 1,5 . 10-2 моль/л.
Ответ:  (Ca2+) = 6,4 . 10-3 моль/л;
(Ca2+) = 6,4 . 10-3 моль/л;  (NO3–) =
(NO3–) =  (Cl-) = 1,5 . 10-2 моль/л.
(Cl-) = 1,5 . 10-2 моль/л.
Задача 533.
Вычислить ионную силу и активность ионов в 0,1%-ном (по массе) растворе BaCl2. Плотность раствора принять равной единице.
Решение:
Находим массу соли в 1л раствора из пропорции:
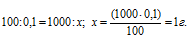
Рассчитаем молярную концентрацию раствора BaCl2:
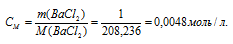
В водных растворах электролитов коэффициент активности зависит от концентрации и заряда всех присутствующих в растворе ионов. Для количественного выражения этой зависимости введено понятие об ионной силе раствора I, которая численно равна полусумме произведений концентрации CM каждого иона на квадрат его заряда Z:
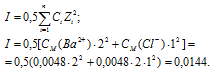
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:
 (ион) = fCM, где f – коэффициент активности иона.
(ион) = fCM, где f – коэффициент активности иона.
Значение коэффициента активности иона рассчитаем по формуле:
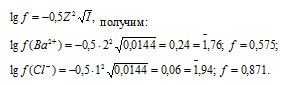
Определяем активность ионов Ba2+ и Cl– из соотношения  (ион) = fCM:
(ион) = fCM:
 (Ba2+) = f(Ba2+) . CM(Ba2+) = 0,575 . 0,0048 = 2,76 . 10-3 моль/л;
(Ba2+) = f(Ba2+) . CM(Ba2+) = 0,575 . 0,0048 = 2,76 . 10-3 моль/л;
 (Cl-) = f(Cl–) . CM(Cl-) = 0,871 . 2(0,0048) = 8,36 . 10-3 моль/л.
(Cl-) = f(Cl–) . CM(Cl-) = 0,871 . 2(0,0048) = 8,36 . 10-3 моль/л.
Ответ:  (Ba2+) = 2,76 . 10-3 моль/л;
(Ba2+) = 2,76 . 10-3 моль/л;  (Cl–) = 8,36 . 10-3 моль/л.
(Cl–) = 8,36 . 10-3 моль/л.
Задача 534.
Рассчитать активность иона водорода в 0,005 н. раствора НСI, содержащем, кроме того, 0,15 моль/л NaС1.
Решение:
В водных растворах электролитов коэффициент активности зависит от концентрации и заряда всех присутствующих в растворе ионов. Для количественного выражения этой зависимости введено понятие об ионной силе раствора I, которая численно равна полусумме произведений концентрации CM каждого иона на квадрат его заряда Z:
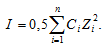
Отсюда
I = 0,5[CM(H+) . 12 + CM(Na+) . 12 + CM(Cl–) . 12] =
= 0,5[(0,005 . 12) + (0,015 . 12) + (0,005 + 0,015) . 12] = 0,155.
Здесь концентрация ионов хлора складывается из суммы концентраций HCl и NaCl, получим:
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:
C(Cl–) = С(HCl) + C(NaCl) = 0,005 + 0,015 = 0,0155 моль/л.
Активность концентрации иона в растворе электролита пропорциональна его концентрации CM, моль/л:
 (ион) = fCM, где f – коэффициент активности иона.
(ион) = fCM, где f – коэффициент активности иона.
Значение коэффициента активности иона водорода рассчитаем по формуле:
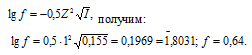
Теперь, пользуясь уравнением  (ион) = fCM, рассчитаем активность иона водорода, получим:
(ион) = fCM, рассчитаем активность иона водорода, получим:
 (H+) = 0,005 . 0,64 = 3,2 . 10-3 моль/л.
(H+) = 0,005 . 0,64 = 3,2 . 10-3 моль/л.
Ответ:  (H+) = 3,2 . 10-3 моль/л.
(H+) = 3,2 . 10-3 моль/л.
fedoy
Вопрос по химии:
Определите молярную концентрацию раствора флорида бария BaCl2 , если 300 мл его раствора содержат 25 грамм данной соли.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 2
cously566
n(BaCl2)=25/208=0.12моль
с=0,12/0,3=0,4моль/л
strede338
n(BaCl2)=25г / 208г/моль = 0.12моль
с=0,12 моль / 0,3 л = 0,4моль/л
Ответ: 0,4моль/л.
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
