Вычислить молярную концентрацию и молярную концентрацию эквивалента раствора ортофосфорной кислоты с массовой долей H3PO4 10% (r = 1,05).
Решение:
Определяем массу одного литра раствора:
m(р-ра) = 1000×1,05 = 1050 г.
Определяем массу H3PO4, которая содержится в 1050 г раствора:
В 100 г р-ра содержится 10 гH3PO4
1050 г р-ра х г
m(H3PO4) = х = 1050×10/100 = 105 г
Определяем молярную концентрацию раствора
с(H3PO4) = ![]() =
= ![]() = 1,07 моль/л
= 1,07 моль/л
Определяем молярную концентрацию эквивалента раствора
с(![]() H3PO4) =
H3PO4) =  =
=  = 3,21 моль/л
= 3,21 моль/л
Молярная концентрация фосфорной кислоты
В 500 миллилитрах раствора содержится 12 грамм фосфорной кислоты (H3PO4). Найти молярную концентрацию и молярную концентрацию эквивалента фосфорной кислоты для реакции образования гидрофосфата натрия (Na2HPO4).
Решение задачи
Запишем уравнение реакции образования гидрофосфата натрия (Na2HPO4), происходит путём нейтрализации разбавленной фосфорной кислоты разбавленным раствором едкого натра (NaOH):
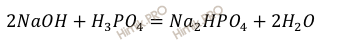
Напомню, что под молярной концентрацией понимают количество (число моль) данного вещества, содержащегося в единице объема раствора. Молярную концентрацию выражают в моль/л или используют сокращение «M».
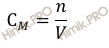
Найдем молярную концентрацию фосфорной кислоты (H3PO4) в 500 мл раствора с массой 12 грамм. Для расчета будем использовать формулу нахождения молярной концентрации раствора:
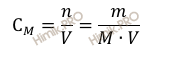
где:
CM –
молярная концентрация раствора;
n –
химическое количество растворенного вещества;
M – молярная масса растворенного вещества;
m –
масса растворенного вещества;
V – объем раствора.
Учитывая, что молярная масса фосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Д.И. Менделеева), получаем, что молярная концентрация фосфорной кислоты (H3PO4) равна:
CM (H3PO4) = 12/ 98 ∙
0,5 = 0,2 (моль/л).
Напомню, что под молярной концентрацией эквивалента понимают количество грамм-эквивалентов данного вещества, содержащегося в 1 л раствора. Нормальную концентрацию выражают в моль-экв/л или используют сокращение «N».
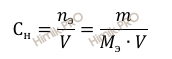
Найдём молярную массу эквивалента фосфорной кислоты (H3PO4) по формуле:
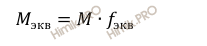
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Фактор эквивалентности (fэкв)– число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности и
эквивалентная масса вещества определяются той реакцией в которой данное вещество
принимает участие, так как у одного и того же вещества в различных реакциях
различны фактор эквивалентности и эквивалентная масса.
Учитывая, что молярная масса молярная масса фосфорной кислоты (H3PO4) равна 98 г/моль и в реакции нейтрализации принимает участие 2 иона водорода (2H+), получаем:
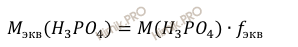
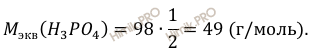
Найдём молярную массу эквивалента фосфорной кислоты (H3PO4):
CН (H3PO4) = 12/ 49 ∙
0,5 = 0,5 (моль-экв/л).
Ответ:
молярная концентрация фосфорной кислоты (H3PO4) равна 0,2 моль/л;
молярная масса эквивалента фосфорной кислоты (H3PO4) равна 0,5 моль-экв/л.
Пример
2. Вычислите
молярную концентрацию эквивалентов
ортофосфорной кислоты в 20%-ном растворе
H3PO4,
плотность которого 1,020 г/см3,
учитывая уравнение
H3PO4
+
3KOH = K3PO4
+ 3H2O.
Решение.
Молярная
концентрация эквивалентов вещества х
(символ Сэкв
(х), единица
измерения моль/м3
или моль/л) определяется количеством
вещества эквивалентов nэкв(х),
находящихся в 1 л раствора.
Молярная
концентрация эквивалентов зависит от
реакции, так как одно и то же вещество
в различных реакциях может иметь разные
значения эквивалентного числа.
-
Рассчитываем
фактор эквивалентности H3PO4
в данной реакции.
Реагент
КОН обменивает с одной формульной
единицей 1 ФЕ (H3PO4)
три гидроксильные группы ОН–,
каждая их которых эквивалентна иону
Н+.
Следовательно, эквивалентное число Z
(H3PO4)
= 3, фактор эквивалентности f(H3PO4)
=
![]()
.
-
Рассчитываем
молярную массу эквивалентов.
Молярная
масса эквивалентов H3PO4
равна произведению фактора эквивалентности
H3PO4
на молярную массу H3PO4
(98 г/моль):
Мэкв(H3PO4)
= f(H3PO4)
·
![]()
=
1/3 · 98 = 32,66 г/моль
-
Вычислим массу 1
л раствора, исходя из значений плотности:
m
= υ
· ρ
= 1000 мл · 1,020 г/см3
= 1020 г.
Содержание
H3PO4
в 1 л раствора найдем из пропорции:
в
100 г раствора H3PO4
содержится 20 г H3PO4;
в
1020 г раствора H3PO4
содержится х г H3PO4,
х
=
![]()
г.
4.
Определим количество вещества эквивалентов
H3PO4
в 1 л раствора.
Количество вещества
эквивалентов показывает количество
вещества (в молях), в котором частицами
являются эквивалентны (реальные или
условные частицы вещества).
Количество
вещества эквивалентов H3PO4
в 1 л раствора получим делением числа
граммов H3PO4
в 1 л раствора на молярную массу
эквивалентов H3PO4:
nэкв(Н3PO4)
=
![]()
моль,
т.е. получим 6,25
моль вещества.
Значит
Сэкв
(H3PO4,
Н2О,
f
=
)
= 6,25 моль/л или 6,25Н H3PO4,
т.е. 1 л этого раствора содержит 6,25 моль
эквивалентов ортофосфорной кислоты.
Пример
3. Учитывая
уравнение реакции
KOH
+ H2SO4
= KHSO4
+ H2O,
Рассчитайте
фактор эквивалентности f(KOH)
и f(H2SO4).
Определите молярную концентрацию
эквивалентов раствора серной кислоты
H2SO4,
если на нейтрализацию 24,5 мл кислоты
потребовалось 23,0 мл раствора гидроксида
калия KOH,
Сэкв(KOH)
= 0,15 моль/л.
Решение.
Растворы
различной молярной концентрации
эквивалентов взаимодействуют в объемах,
обратно пропорциональных их молярным
концентрациям эквивалентов.
Зная молярную
концентрацию эквивалентов одного из
двух реагирующих растворов и их объемы,
определяем молярную концентрацию
эквивалентов второго раствора:
![]()
или
Сэкв(А)
· Vp(A)
= Cэкв(В)
· Vp(B),
-
Рассчитаем
фактор эквивалентности f(KOH)
и f(H2SO4).
Реагент KOH
обменивается с одной формульной единицей
1 ФЕ H2SO4
одну гидроксильную группу ОН–,
которая эквивалентна иону Н+.
Следовательно, эквивалентное число
Z(H2SO4)
= 1, фактор
эквивалентности f(H2SO4)
= 1.
Эквивалентное
число Z(KOH)
= 1, f(KOH)
= 1.
-
Вычислим
молярную концентрацию эквивалентов
раствора H2SO4.
![]()
,
отсюда
Сэкв(Н2SO4,
Н2О,
f
= 1) =
![]()
=
=0,14
моль/л или 0,14Н H2SO4.
Пример
4. Определить
массу (г) перманганата калия KMnO4,
необходимую для приготовления 0,5 л 0,2н
раствора, предназначенного для изучения
окислительных свойств вещества в кислой
среде
MnO4–
+ 8H+
+ 5e–
= Mn2+
+ 4H2O.
Решение.
-
Определим
фактор эквивалентности f(KMnO4).
Ионно-электронное
уравнение полуреакции показывает, что
степень окисления марганца изменяется
от +7 до +2. Одна формульная единица MnO4–
присоединяет пять электронов, поэтому
эквивалентное число Z(MnO4–)
= 5. Следовательно, эквивалентное число
KMnO4
равно Z(KMnO4)
= 5, фактор эквивалентности f(KMnO4)
=
![]()
.
Молярная масса KMnO4
равна
![]()
=
158 г/моль.
-
Вычислим
массу KMnO4
необходимую для приготовления 0,5 л 0,2н
раствора.
Молярная
концентрация эквивалентов Сэкв(х)
равна отношению количества вещества
эквивалентов nэкв(х)
к объему раствора Vp:
![]()
,
где
mx
– масса вещества (г);
f(x)
– фактор эквивалентности;
Мх
– молярная масса вещества, г/моль;
Vp
– объем раствора (л).
Отсюда можно
рассчитать массу вещества:
![]()
,
![]()
г.
Ответ:
Для приготовления 0,5 л 0,2н раствора
необходимо взять 3,16 г KMnO4.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Фактор эквивалентности и эквивалентная масса вещества определяются реакцией, в которой принимает участие вещество. У одного и того же вещества фактор эквивалентности и эквивалентная масса в различных реакциях могут быть различны.
Молярная масса эквивалента кислоты зависит от числа замещаемых атомов водорода.
Запишем уравнения реакций образования:
– дигидрофосфата калия:
H3PO4 + КOH = КH2PO4+H2O
Так как в молекуле ортофосфорной кислоты H3PO4 замещается 1 атом водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1:
f экв. (H3PO4) = 1.
Молярная масса ортофосфорной кислоты H3PO4 равна 97,995 г/моль. Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Мэ (Н3РО4) = 97,995/1 = 97,995 г-э/моль.
– гидрофосфата калия:
H3PO4 + 2КOH = К2HPO4 + 2H2O
В этой реакции в молекуле ортофосфорной кислоты H3PO4 замещается 2 атома водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1/2:
f экв. (H3PO4) = 1/2.
Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Mэ = 97,995/2 = 48,998 г-экв/моль
— ортофосфата калия:
H3PO4 + 3КOH = К3PO4 + 3H2O
В этой реакции в молекуле ортофосфорной кислоты H3PO4 замещается 3 атома водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1/3:
f экв. (H3PO4) = 1/3
Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Мэ = 97,995/3 = 32,665 г-экв/моль
Ответ:
фактор эквивалентности ортофосфорной кислоты в реакции образования дигидрофосфата равен 1, молярная масса эквивалента равна 97,995 г-э/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования гидрофосфата равен 1/2, молярная масса эквивалента равна 48,998 г-экв/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования ортофосфата равен 1/3, молярная масса эквивалента равна 32,665 г-экв/моль.
rermireyst
Вопрос по химии:
Определите молярную концентрацию эквивалента фосфорной кислоты, если в 300 мл раствора содержится 2,94 г, а продуктом реакции нейтрализации является гидрофосфат натрия?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
qunthea421
1) В р-ии образ-я NaHPO4 М экв. H3PO4 = 98/2 = 49 г/моль;
2) т.о. в 0.3 л р-ра сод-ся 2.94/49 = 0.06 моль эквив-в H3PO4;
3) Сн. р-ра H3PO4 = 0.06/0.3 = 0.2 моль/л (0.2 Н).
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
