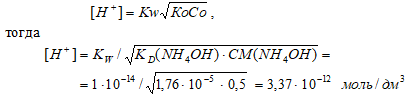pH раствора 4,4. Определить концентрацию ионов водорода в этом растворе.
Решение задачи
Перед решением данной задачи хочу напомнить, водородный показатель (pH) раствора численно равен десятичному логарифму концентрации ионов водорода в этом растворе.
Пусть искомая концентрация . Тогда, учитывая, что pH раствора 4,4, найдем концентрацию ионов водорода в этом растворе:
Таким образом,концентрация ионов водорода в растворе равна 4 ∙ 10-5 моль/л.
Ответ: концентрация ионов водорода = 4 ∙ 10-5 моль/л.
Уравнение
диссоциации бинарного электролита в
общем виде:
AaBb
aAz+
+ bBz−
Степень диссоциации,
по определению, равна отношению числа
моль AaBb,
распавшегося на ионы, к общему числу
моль AaBb.
Пусть объём раствора
равен одному литру. Тогда общее число
моль AaBb
− это молярная концентрация электролита
c.
При распаде одного
моля AaBb
образуется «a»
моль ионов Az+.
Следовательно, число моль электролита
AaBb,
распавшегося на ионы, в «a»
раз меньше, чем молярная концентрация
ионов Az+,
т.е. равна
(концентрацию ионов принято обозначать
в квадратных скобках).
Используя определение
степени диссоциации, получаем:
;
.
Поскольку, по
определению, степень диссоциации равна
отношению числа моль электролита,
распавшегося на ионы, к общему числу
моль электролита, а для одного литра
раствора это, как мы установили, величины,
соответственно равные
иc,
то:
;
.
Таким образом,
концентрация
ионов связана с молярной концентрацией
электролита следующим
образом:
;
.
Эти формулы
применимы и к слабым, и к сильным
электролитам.
Рассмотрим примеры.
Найдём
концентрацию ионов в 0,1 М растворе
Cr2(SO4)3,
если степень диссоциации 60 %.
Cr2(SO4)3
2Cr3+
+ 3SO42−
[Cr3+]
= 2c
= 2∙0,1∙0,6 = 0,12 моль/л.
[SO42−]
= 3c
= 3∙0,1∙0,6 = 0,18 моль/л.
В указанные
соотношения входит именно молярная
концентрация. Если в условии задачи
приведены другие способы выражения
концентрации раствора, то необходимо
сначала определить молярную концентрацию.
Например, в условии
данной задачи могла быть дана нормальность
раствора сульфата хрома (III),
равная 0,6 г-экв/л, или же сказано, что
концентрация составляет 39,2 г/л (проверьте
самостоятельно, что это 0,1 М раствор).
Для
растворов кислот и оснований
приведённые соотношения особенно важны
для определения молярных концентраций
соответственно ионов водорода и
гидроксид-ионов.
Например, для
раствора серной кислоты
H2SO4
2H+
+ SO42−
[H+]
= 2c;
Для раствора
аммиака
NH3∙H2O
NH4+
+ OH−
[OH−]
= c;
Рассмотрим пример
ещё одного задания.
Найдем
степень диссоциации гидрата аммиака в
его 0,23 М растворе, если в трех литрах
раствора содержится 0,0045 моль ионов
аммония.
В формуле
известно значениеc.
Молярную концентрацию ионов NH+
найдем, составив пропорцию:
в
3 л содержится 0,0045 моль NH4+
в
1 л » x
моль NH4+
[NH4+]
= x
= 0,0015 моль/л
Вычислим:
,
или 0,65 %.
3) Водородный показатель (рН) растворов, ионное произведение воды, шкала рН.
Ионное
произведение воды Kв
− постоянная при данной температуре
величина. При стандартной температуре
Kв
= [H+][OH−]
= 10−14.
Произведение
концентраций ионов H+
и OH−
не меняется, следовательно, во сколько
раз увеличивается концентрация ионов
H+,
во столько же раз уменьшается концентрация
OH−,
и наоборот.
Водородный
показатель рН = −lg[H+].
В нейтральной
среде, когда [H+]
= [OH−],
[H+]
= 10−7
и рН = 7;
В кислой среде
[H+]
> 10−7
и рН < 7;
В щелочной среде
[H+]
< 10−7
и рН > 7.
Пусть рН = 10. Тогда
[H+]
= 10−10 моль/л,
а
.
В данном растворе
концентрация ионов OH−
больше
концентрации ионов H+
в
раз, или в миллион раз. Концентрация
ионовOH−
больше, чем в нейтральной среде в
раз, или в тысячу раз.
Рассмотрим схему
решения задач,
в которых требуется найти
рН в растворах кислоты или основания.
Не забывайте, что в растворах оснований
рН > 7.
I.
В условии даны «c»
и
«».
а) Написать уравнения
диссоциации.
б) Вычислить для
кислоты [H+]
= a∙c;
для основания
[OH−]
= b∙c.
Здесь «a»
− число ионов водорода и «b»
число гидроксид-ионов, которые образуются
при диссоциации одной молекулы
соответственно кислоты и основания
(см. примеры в пункте 2).
в) Для основания
вычислить
.
г) Зная [H+],
определить рН.
II.
В условии нет значения «».
Тогда для слабых электролитов «»
определяется через константу диссоциации
,
а для разбавленных растворов сильных
электролитов принимается, что
равно 1.
Например, определим
рН в 0,001 М растворе NaOH.
Концентрация гидроксид-ионов совпадает
с молярной концентрацией щелочи:
[OH−]
= c
= c∙1=
c
= 0,001 = 10−3
моль/л.
Найдём:
;
рН = −lg[H+]
= −lg10−11
= 11.
III.
Если в условии задачи нет значения «c»,
то там содержится вся необходимая
информация для определения молярной
концентрации. Например, может быть
приведена нормальность, или процентная
концентрация и плотность раствора, или
число моль электролита в известном
объёме раствора (см. комментарии к
решению задач №1 ВКР-2).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как правильно рассчитать концентрацию ионов водорода и рН в растворе серной кислоты
Задача 101.
Вычислите [Н+] и рН 0,01 М и 0,05 Н растворов Н2SO4.
Решение:
CM(Н2SO4) = 0,01 М;
CH(Н2SO4) = 0,05 М;
a) Вычисление [Н+] и рН 0,01 М раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,01) = 2 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg2 · 10-2 = 2 – lg2 = 2 – 0,30 = 1,70.
б) Вычисление [Н+] и рН 0,05 Н раствора Н2SO4
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна ее нормальности.
[Н+] = СН(Н2SO4) = (1 · 0,05) = 5 · 10-2 моль/дм3;
рН = -lg[Н+] = -lg5 · 10-2 = 2 – lg5 = 2 – 0,70 = 1,30.
Ответ: а) [Н+] = 2 · 10–2 моль/дм3; рН = 1,70; б) [Н+] = 5 · 10–2 моль/дм3; рН = 1,30.
Задача 102.
Вычислите [Н+] и рН раствора Н2SO4 с массовой долей кислоты 0,5% (р = 1,00 г/см3).
Решение:
М(Н2SO4) = 98 г/моль;
w% = 0,5% или 0,005;
р = 1,00 г/см3.
1. Рассчитаем молярность раствора кислоты
CM(Н2SO4) = (w% · p · 1000)/М(Н2SO4) = (0,005 · 1,00 г/см3 · 1000 cм3)/98 г/моль = 0,05 M.
Так как Н2SO4 двухосновная кислота и является сильным электролитом, то концентрация ионов водорода будет равна удвоенному значению ее молярности.
[Н+] = 2СМ(Н2SO4) = (2 · 0,05) = 1 · 10-1 моль/дм3;
рН = -lg[Н+] = -lg1 · 10-1 = 1 – lg2 = 1 – 0,00 = 1,00.
Ответ: [Н+] = 0,1 моль/дм3;рН = 1,00.
Задача 103.
Вычислите [Н+] и рН 0,5 М раствора гидроксида аммония.
Решение:
КD(NH4OH) = 1,76 · 10–5;
CM(NH4OH) = 0,5 М.
Схема диссоциации NH4OH:
NH4OH ⇔ NН4+ + OH–
Поскольку КD(NH4OH) << CM(NH4OH) так как (1,76 · 10–5) << 0,5, то можно считать, что равновесная концентрация недиссоциированного основания равна его общей концентрации: СМ(NH4OH) = 0,5 моль/дм3.
Для слабых оснований [H+] вычисляют по формуле:
рН = -lg[Н+] = -lg3,37 · 10-12 = 12 – lg3,37 = 12 – 0,53 = 11,47.
Ответ: [Н+] = 3,37 · 10–12 моль/дм3;рН = 11,47.
Вода является слабым электролитом и только в небольшой степени диссоциирует на ионы Н+ и ОН–:
При 25 °С степень диссоциации α воды равна примерно 2 ∙ 10–9. Это означает, что из миллиарда молекул воды только две молекулы находятся в виде ионов Н+ и ОН–.
Концентрация ионов водорода с(Н+) равна 10–7 моль/дм3. Такова же концентрация гидроксильных групп с(ОН–).
Произведение концентраций ионов Н+ и OH– в воде и водных растворах является величиной постоянной при определённой температуре. Так, при 25 °C:
Растворы, в которых концентрация катионов водорода равна концентрации гидроксид-анионов, называют нейтральными. Если концентрация катионов водорода в растворе больше концентрации гидроксид-анионов, то есть c(Н+) > c(ОН–), то среда раствора кислая. Если же в растворе преобладают гидроксид-анионы, то есть c(ОН–) > c(Н+), то среда раствора щелочная.
Количественно кислотность и связанную с ней осно́вность (щёлочность) среды растворов выражают с помощью водородного показателя рH (читается «пэ-аш»). Водородный показатель представляет собой десятичный логарифм концентрации ионов водорода в растворе, взятый со знаком «минус»:
рH = –lgc(H+).
Водородный показатель pH — это мера концентрации в растворе катионов водорода H+, количественно выражающая кислотность раствора.
Водородный показатель является безразмерной величиной.
Например, при молярной концентрации катионов H+ c(H+) = 10–5 моль/дм3 рН равен 5, а при c(H+) = 10–3 моль/дм3 рН равен 3.
Пример 1. Определите рН раствора серной кислоты, молярная концентрация которой равна 0,005 моль/дм3.
Дано:
с(H2SO4) = 0,005 моль/дм3
pH — ?
Решение
Пусть V(р-ра) = 1 дм3.
Тогда
n(H2SO4) = 0,005 моль/дм3 · 1 дм3 = 0,005 моль.
Определим количество ионов водорода по уравнению диссоциации кислоты:
, откуда х = 0,01 моль, то есть n(Н+) = 0,01 моль.
Молярная концентрация ионов водорода равна:
Рассчитаем водородный показатель:
рН = –lgс(Н+) = –lg10–2 = 2.
Ответ: рН = 2.
Рассчитаем водородный показатель в щелочном растворе.
Пример 2. Определите pH раствора NaOH c молярной концентрацией 0,01 моль/дм3.
Дано:
с(NaOH) = 0,01 моль/дм3
pH — ?
Решение
Концентрация анионов OH– в таком растворе равна 10–2 моль/дм3. Рассчитаем концентрацию ионов водорода, зная, что с(Н+) ∙ с(ОН)– = 10–14 (моль/дм3)2., откуда
следовательно,
рН = –lgc(H+) = –lg10–12 = 12 (щелочная среда).
Ответ: рН = 12.
Обратите внимание на то, что и в щелочной среде катионы H+ продолжают присутствовать в водном растворе.
Поскольку в воде при 20–25 °С концентрации ионов H+ и OH– одинаковы и равны 10–7 моль/дм3, то для чистой воды рН = –lgc(H+) = –lg10–7 = 7. Такое значение рН соответствует нейтральной среде. Значению рН < 7 соответствует бо́льшая кислотность раствора, а рН > 7 соответствует бо́льшая щёлочность раствора (рис. 59).
Итак, значение рН можно рассчитать, а также оценить с помощью отдельных индикаторов (лакмуса, фенолфталеина, метилоранжа), универсального индикатора cо шкалой рН и приборов — рН-метров (рис. 59, 60).
Измерение рН необходимо в медицине, сельском хозяйстве, науке, на производстве. В организме здорового человека рН крови составляет 7,4, желудочного сока — 1,7, слюны — 6,9, слёз — 7,3–7,5. При консервировании добавление уксусной кислоты в маринад до pH < 4,5 подавляет деятельность большинства бактерий. С аналогичной целью в состав прохладительных напитков вводят лимонную кислоту для понижения значения рН до 3. Для нормального развития растений чаще всего необходимо уменьшать повышенную кислотность почв известкованием с помощью мела CaCO3, доломитовой муки CaMg(CO3)2 или некоторых удобрений до рН = 6,0–6,5 (табл. 16).
Таблица 16. Классификация диапазонов рH почвы
| Кислотность почвы | Диапазон рH |
| Кислая | 3,5–6,0 |
| Нейтральная и близкая к нейтральной | 6,1–7,8 |
| Щелочная | 7,9–9,0 и выше |
Выбрать другой вопрос
Смотреть ответ
Перейти к выбору ответа
Вопрос от пользователя
Найти молярную концентрацию ионов OH- в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а) 10 в -3 степени, б) 6,5* 10 в -8 степени.
Ответ от эксперта
[H+] ∙ [OH-] = 10^-14
а) [OH-]=10^-14 /10^-3 = 10^-11 моль/л
б) [OH-]=10^-14 /(6,5∙10^-8) = 1,54 ∙ 10^-7 моль/л