Способы выражения концентрации растворов
Существуют
различные способы выражения состава раствора. Наиболее часто используют
массовую долю растворённого вещества, молярную и нормальную
концентрацию.
Массовая доля растворённого вещества w(B) – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2
в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция
массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Решение
m(Na2SO4) = w(Na2SO4) / 100 = (5300) / 100 = 15 г
где w(Na2SO4) – массовая доля в %,
m – масса раствора в г
m(H2O) = 300 г – 15 г = 285 г.
Таким образом, для приготовления 300 г 5% раствора сульфата натрия надо взять 15 г Na2SO4 и 285 г воды.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B)V),
где М(B) – молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в
моль/л и обозначается “M”. Например, 2 MNaOH – двухмолярный раствор
гидроксида натрия. Один литр такого раствора содержит 2 моль вещества
или 80 г (M(NaOH) = 40 г/моль).
Пример
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Решение M(K2CrO4) = C(K2CrO4)
V M(K2CrO4) = 0,1 моль/л 1,2 л 194 г/моль = 23,3 г.
Таким образом, для приготовления 1,2 л 0,1 М раствора нужно взять 23,3 г K2CrO4 и растворить в воде, а объём довести до 1,2 литра.
Концентрацию раствора можно выразить
количеством молей растворённого вещества в 1000 г растворителя. Такое
выражение концентрации называют моляльностью раствора.
Нормальность
раствора обозначает число грамм-эквивалентов данного вещества в одном
литре раствора или число миллиграмм-эквивалентов в одном миллилитре
раствора.
Грамм – эквивалентом вещества
называется количество граммов вещества, численно равное его
эквиваленту. Для сложных веществ – это количество вещества,
соответствующее прямо или косвенно при химических превращениях 1 грамму
водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (23) = 342 / 2= 57 г
Величины нормальности обозначают буквой “Н”. Например, децинормальный раствор серной кислоты обозначают “0,1 Н раствор H2SO4“.
Так как нормальность может быть определена только для данной реакции,
то в разных реакциях величина нормальности одного и того же раствора
может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (r = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 701000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной
концентрации в молярную и наоборот, необходимо помнить, что процентная
концентрация рассчитывается на определенную массу раствора, а молярная
и нормальная – на объем, поэтому для пересчета необходимо знать
плотность раствора. Если мы обозначим: с – процентная концентрация; M –
молярная концентрация; N – нормальная концентрация; э – эквивалентная
масса, r – плотность раствора; m – мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (cp 10) / m
N = (cp 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Пример 1
Какова молярная и нормальная концентрация 12%-ного раствора серной кислоты, плотность которого р = 1,08 г/см3?
Решение
Мольная масса серной кислоты равна 98. Следовательно,
m(H2SO4) = 98 и э(H2SO4) = 98 : 2 = 49.
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (121,08 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (121,08 10) / 49 = 2,64 H.
Иногда в лабораторной практике
приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (Например, для
HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором.
Однако для большинства соединений эквивалентная масса не равна мольной
и, следовательно, нормальная концентрация растворов этих веществ не
равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (NЭ) / m
N = (Mm) / Э
Пример
Нормальная концентрация 1 М раствора серной кислоты N = (198) / 49 = 2 H.
Пример
Молярная концентрация 0,5 н. Na2CO3
M = (0,553) / 106 = 0,25 M.Упаривание, разбавление, концентрирование,
смешивание растворов
Имеется mг исходного раствора с массовой долей растворенного вещества w1 и плотностью r1.
Упаривание раствора
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 – масса растворенного вещества в исходном растворе)
m1 = w1m
w2 = m1 / (m – Dm) = (w1m) / (m – Dm)
Пример
Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
m = 60 г; Dm = 60 – 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,0560) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Концентрирование раствора
Какую массу вещества (X г) надо
дополнительно растворить в исходном растворе, чтобы приготовить раствор
с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2, (где m1 – масса вещества в исходном растворе).
m1 = w1m
w2 = (m1+x) / (m + x) = (w1m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2m + w2 x = w1 m + x
w2m – w1 m = x – w2 x
(w2 – w1)
m = (1 – w2) x
x = ((w2 – w1)m) / (1 – w2)
Пример
Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 – 0,08) 90) / (1 – 0,1) = (0,02 90) / 0,9 = 2 г
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1
m1, в растворе №2 – w2 m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1m1 + w 2 m2 = w3 (m1 + m2)
w1m1 + w 2 m2 = w3 m1 + w3 m2
w 1m1 – w 3 m1 = w3 m2 – w2 m2
(w1– w3)m1 = (w3– w2) m2
m1 / m2 = (w3– w2 ) / (w1– w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
| w1 | (w3 – w2) / |
m1 | |
| w3 | |||
| / w2 |
(w1 – w3) | m2 |
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов
с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании
образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
| 40% | 5% / |
m1 | |
| 10% | |||
| / 5% |
30% | m2=210-m1 |
5 / 30 = m1 / (210 – m1)
1/6 = m1 / (210 – m1)
210 – m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли,
получим выражения для значений массовых долей растворенного вещества в
исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1V1) откуда V1= m1 /( w1 r1)
w2 = m2 / (r2V2)
m2 = w2r2 V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2r2 V2) / (w1 r1)
m2 = w2 • r2 • V2
или
| w1 • r1 • V1 | = | w2 • r2 • V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример
Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2 / w1
50 / x = 3 / 30
3x = 50
30 = 1500
x = 500 г
Последнюю задачу можно также решить, используя “правило креста”:
| 30% | 3% / |
50 | |
| 3% | |||
| / 0% |
27% | X |
3 / 27 = 50 / x
x = 450 г воды
450 г + 50 г = 500 г
Определение молярности раствора
Молярность (molarity) – способ выражения концентрации, показывающей количество растворенного вещества (n, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
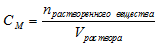
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
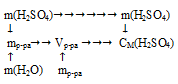
1. Определим количество вещества серной кислоты:
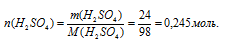
2. Определим объем раствора:
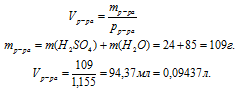
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
CМ = n(H2SO4)/V(p-pa) = 0,245/0,09437 = 2,6 моль/л.
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.
Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
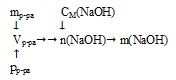
1. Определим объем 700 г раствора
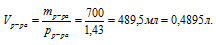
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
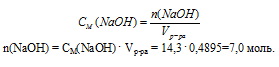
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 . 40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
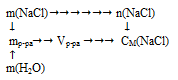
1 . Определяем количество вещества NаС1:
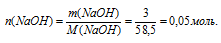
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН2О) = 3 + 200 = 203 г.
3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
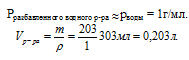
Определим молярную концентрацию NаС1 в растворе:
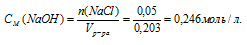
Ответ: 0,24моль/л.
Комментарии:
1Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2Справочное значение плотности данного раствора равно 1,009 г/мл.
В реальности, химики редко работают с чистыми веществами. В большинстве своем для работы, при проведении химических реакций, расчетов по ним используются различные растворы.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
Подробнее о процессе растворения мы поговорим в следующих статьях.
При решении расчетных задач нам нудно уметь находить количество чистого вещества, находящегося в растворе. Это необходимо затем, что, как правило, в химическое взаимодействие вступает вещество, а не дополнительные продукты, которое оно содержит: примеси, если это не чистое вещество, компоненты растворителя, или инертные для данного химического процесса компоненты смеси (если это смесь веществ).
Если мы работаем с 500 граммами раствора, в котором всего 10 грамм чистого вещества, то в расчеты мы берем 10 грамм, а не 500! – пример, почему необходимо уметь вычислять количественные характеристики чистого вещества.
Способы выражения концентрации растворов
Существуют различные способы выражения концентраций растворов. В задачах могут встретиться любые из них. Рассмотрим основные из них более подробно.
I. Массовая доля вещества
Массовая доля – отношение массы чистого вещества к массе всего раствора. Данная величина безразмерная (говорят доля от единицы, всегда меньше 1, или равна единице для чистого вещества), или выражается в %.
Очень часто можно встретить запись запись, например NaOH, 15% – это значит, что из всей массы раствора на долю гидроксида натрия (NaOH) приходится только 15 %.
Следует не забывать, что масса раствора = масса растворителя + масса чистого вещества.
Зная массовую долю вещества, нетрудно выразить формулу для расчета массы чистого вещества:
В некоторых задачах масса раствора может быть не дана в условии. В этом случае мы сами можем её задать. Как правило в таких случаях, мы задаём массу раствора как 100 г. Дальнейший расчет ведется уже исходя из заданной массы (если требуется перевести одну концентрацию в другую).
Приведем примеры задач:
Мы специально делаем подробное решение, чтобы отследить ход мыслей.
Решим аналогичную задачу:
Более часто встречаются задачи, в которых требуется приготовить раствор из другого раствора путем добавления чистого вещества (в этом случае концентрация увеличится), растворителя (концентрация уменьшится) или другого раствора (концентрация займёт промежуточное значение).
Рассчитайте массу соли, которую необходимо добавить к 150 г 10% -го раствора, чтобы концентрация полученного раствора стала 15%?
Данную задачу можно решать различными способами. В настоящий момент приведем только один (более длинный, но более понятный). Для решения таких задач другим способом мы подготовим видео.
Задачи, в которых добавляется растворитель – решаются проще.
Какое количество воды необходимо добавить к 200 г 15%-го раствора, чтобы его концентрация стала 10%?
Для решения задач, в которых смешиваются два раствора, имеющих различные концентрации, можно использовать следующий алгоритм:
1. Рассчитать количество чистого вещества в обоих растворах и сложить их.
2. Поделить полученное число на сумму масс растворов. Домножить на 100 %.
Решим для примера следующую задачу
Смешали 200 г 10%-го раствора серной кислоты и 100 г 20-% го. Какая массовая доля стала у получившегося раствора?
II. Молярная концентрация вещества
Молярная концентрация вещества – отношение количества вещества к объему раствора. Данная величина показывает нам, сколько (моль) вещества растворено в 1 литре раствора. Единица измерения – моль/л.
Обозначается молярная концентрация заглавной буквой C
В химической лаборатории очень часто для обозначения концентрации используется именно данная величина.
Очень часто, на химических склянках можно увидеть следующие обозначения:
Таким способом также обозначается молярная концентрация. Число перед буквой М обозначает концентрацию: 1 моль/л; 0,1 моль/л; 0,02 моль/л; 3 моль/л; 0,5 моль/л.
Можно также встретить в задачах такое обозначение, связанное с данной формой записи: молярный раствор (1 М) – раствор, концентрация которого составляет 1 моль/л. Децимолярный раствор (0,1 М) – 0,1 моль/л; сантимолярный раствор (0,01 М) – 0,01 моль/л.
Решим некоторые задачи, в которых используется молярная концентрация:
Для приготовления раствора сульфата натрия навеску, содержащую 14,2 г соли растворили в 500 мл воды и довели до метки.
Доведение до метки обозначает, что объем приготовленного раствора составляет (в данном случае) 500 мл.
Часто требуется рассчитать количество вещества:
Прежде чем проводить расчет по уравнению химических реакций, необходимо найти количество вещества.
III. Моляльная концентрация
Моляльная концентрация – отношение количества (моль) растворенного вещества к массе растворителя. Данная концентрация показывает нам, сколько моль вещества необходимо добавить к 1 кг растворителя (воды, например), чтобы получить нужную концентрации. Обозначается данная концентрация См, а измеряется в моль/кг(растворителя).
IV. Мольная доля
Мольная доля – отношение количества вещества к сумме количеств всех компонентов раствора. Данная физическая величина не имеет размерности.
Сумма всех мольных долей раствора равна “1”.
Данная физическая величина нашла широкое применение в химической химии для описания равновесных термодинамических процессов.
V. Титр
Титр – отношение массы вещества к единице объема (выраженного в миллилитрах). Титр показывает, сколько грамм вещества находится в каждом миллилитре раствора. обозначается как “Т” и измеряется в г/мл.
Титр – очень маленькая величина, так как в в 1 миллилитре раствора может находиться незначительное количество вещества.
Титр нашел широкое применение в аналитической химии.
В заключении
По данной теме существует огромное количество расчетных задач. Многие из них мы рассмотрим в следующих статьях. О пока…
Проверьте, как Вы усвоили материал.
Задание №1. Перейдите к гугл-форме и ответьте на вопросы (базовый уровень):
https://forms.gle/7u32uLfxRk1Yug7a8
Задание №2. Решите расчетные задачи: https://vk.com/page-205267346_56951920 (повышенный уровень)
Задание №3. Решите следующую задачу:
Какова молярная концентрация 12%-ного раствора серной кислоты (H2S04) с плотностью р = 1,08 г/см3. Рассчитайте титр данного вещества, моляльную концентрацию, мольную долю.
Отчет о решении задач пришли в беседу “Учебный класс”:
https://vk.me/join/DKsyQe2p0hJ2Wdoch1XOTwi_qZEJow1udOM=
Раствор – однородная система, состоящая из растворителя и растворенного в нем вещества (или нескольких). Количественная характеристика определяется концентрацией веществ, входящих в их состав.
Массовая доля
Массовая доля – это отношение массы растворённого вещества к массе всего раствора.
ω(%)=mxmX×100%omega left(% right)= frac{m_{x}}{m_{X}} times 100%
Сколько калия хлорида (в граммах) содержится в 100г 10% раствора?
Решение:
Масса калия хлорида (молярная масса MM для KClKCl 75г/моль):
mKCl=ω×M100%=10%×75100%=7,5m_{KCl}=frac{omega times M}{100%}=frac{10% times 75}{100%}=7,5г
Ответ: 7,5г.
Сколько необходимо добавить натрия гидроксида к 120г 3% раствора этой же соли, что бы концентрация увеличилась в три раза?
Решение:
Масса натрия гироксида исходная (MNaOH=40M_{NaOH}=40 г/моль:
m1NaOH=ω×M100%=3%×40100%=1,2m_{1NaOH}=frac{omega times M}{100%}=frac{3%times 40}{100%}=1,2г
Массовая доля натрия гидроксида в необходимом растворе:
ω2%=ω%×3=3%×3=9%omega _{2}%=omega%times3=3%times3=9%
Масса NaOH в необходимом растворе:
m2NaOH=9%×40100%=3,6m_{2NaOH}=frac{9%times 40}{100%}=3,6г
Необходимое количество рассчитываем как разность:
mNaOH=m2NaOH−m1NaOH=3,6−1,2=2,4m_{NaOH}=m_{2NaOH}-m_{1NaOH}=3,6-1,2=2,4г
Ответ: 2,4г.
Молярная концентрация
Молярная концентрация – количество вещества (в молях) в объеме раствора.
Количество растворенного вещества (в молях) выражается как масса вещества (в граммах), деленная на молярную массу (г/моль).
η=mxMeta =frac{m_{x}}{M}
Молярная концентрация выражается в формуле:
Cx=ηV=η=mxM×VC_{x} = frac{eta }{V} = eta =frac{m_{x}}{M}times V
Определите молярную концентрацию калия иодида. В 120мл воды содержится 15г KI.
Решение:
Выражаем молярную концентрацию (моль/л) KI по формуле ($M_(KI)=$166г/моль):
CKI=mKIMKI×VC_{KI} =frac{m_{KI}}{M_{KI}}times V=15166×0,12=0,01=frac{15}{166}times 0,12=0,01моль/л
Т.к. молярная концентрация выражается в моль/л миллилитры переводим в литры.
Ответ: 3,61 моль/л.
Какая масса лития хлорида содержится в 200мл 3М раствора?
Решение:
Находим количество растворенного лития хлорида (моль):
η=CLiCl×V=3×0,2=0,6eta =C_{LiCl}times V=3times 0,2=0,6г
Выражаем массу M(LiCl)=M_ (LiCl)= 42,3г/моль):
mLiCl=ηLiCl×MLiCl=0,6×42.3=25,4m_{LiCl}=eta_{LiCl} times M_{LiCl}=0,6times 42.3=25,4г
Ответ: 25,4г.
Молярная (мольная) доля
Молярная (мольная) доля – отношения количества вещества в растворе к количеству всех веществ, образующих раствор.
Nx%=nx∑n×100%N_{x}%=frac{n_{x}}{sum{n}}times 100%
Концентрация бария хлорида в 100мл водного раствора равна 20%. Определите его мольную долю.
MBaCl2=208M_{BaCl_{2}}=208моль/л, MH2O=18M_{H_{2}O}=18моль/л.
Решение:
Находим содержание воды:
ωH2O=100%−ωBaCl2=100%−20%=80%omega _{H_{2}O}=100%-omega BaCl_{2}=100%-20%=80%
Т.к. объем раствора равен 100мл, то массы каждого компонента равны значениям массовой доли. Следовательно:
mBaCl2=20m_{BaCl_{2}}=20г
mH2O=80m_{H_{2}O}=80г
Определим количество ηeta для бария хлорида и воды:
ηBaCl2=mBaCl2MBaCl2=20208=0,01eta_{BaCl_{2}}=frac{m_{BaCl_{2}}}{M_{BaCl_{2}}}=frac{20}{208}=0,01моль
ηH2O=mH2OMH2O=2018=1,1eta_{H_{2}O}=frac{m_{H_{2}O}}{M_{H_{2}O}}=frac{20}{18}=1,1моль
Определяем мольную долю NBaCl2N_{BaCl_{2}}:
NBaCl2=ηBaCl2ηBaCl2+ηH2O×100%=0,010,01+0,1×100%=9%N_{BaCl_{2}}=frac{eta BaCl_{2}}{eta BaCl_{2}+eta H_{2}O}times 100%=frac{0,01}{0,01+0,1}times 100%=9%
Ответ: 9%
Молярная концентрация эквивалента
Молярная концентрация эквивалента (нормальность) – число моль эквивалентов в объеме раствора.
C1/z=mxM1/z×VC_{1/z} = frac{m_{x}}{M_{1/z}times V}моль*экв/литр
Фактор эквивалентности f1/zf_{1/z} – показывает часть реальной частицы, составляющую эквивалент.
Молярная масса эквивалента M1/zM_{1/z} – произведение молярной массы и фактора эквивалентности:
M1/z=M×f1/zM_{1/z} = M times f_{1/z}г/моль
Определите молярную концентрацию эквивалента 4.6г серной кислоты, нейтрализованной раствором гидроксида натрия. В результате реакции общий объём составил 100мл.
Решение:
MH2SO4=98M_{H_{2}SO_{4}}=98г/моль, f1/z=1/2f_{1/z=1/2}.
Находим молярную массу эквивалента для серной кислоты:
M1/zH2SO4=MH2SO4×f1/zM_{1/z H_{2}SO_{4}} = M _{H_{2}SO_{4}}times f_{1/z} = 98times 1/2=49$г/моль
Находим нормальность:
C1/zH2SO4=mH2SO4M1/zH2SO4×V=4,649×0,1=0,94C_{1/z H_{2}SO_{4}} = frac{m_{H_{2}SO_{4}}}{M_{1/z H_{2}SO_{4}}times V}=frac{4,6}{49times
0,1}=0,94моль*экв/л
Ответ: 0,94моль*экв/л.
Моляльность
Моляльность – количество вещества в килограмме растворителя.
Сm=ηxmС_{m}=frac{eta _{x}}{m}моль/кг
В 300г воды растворили 20г калия гидроксида. Определите моляльную концентрацию раствора.
Решение:
MKOH=98M_{KOH}=98г/моль.
Находим количество калия гидроксида:
ηKOH=mKOHM=2056=0,36eta _{KOH} = frac{m_{KOH}}{M}=frac{20}{56}=0,36моль
Находим моляльность (граммы переводим в килограммы):
CKOH=ηKOHm=0,360,3=1,2C_{KOH}=frac{eta _{KOH}}{m}=frac{0,36}{0,3}=1,2моль/кг
Ответ: 1,2 моль/кг.
