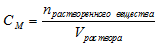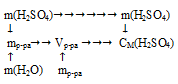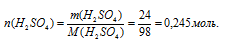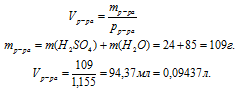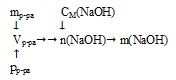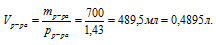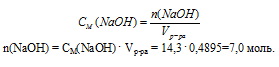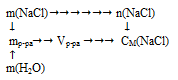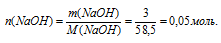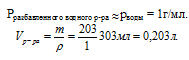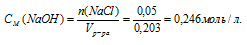Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
ν(HNO3) = m/M(HNO3) = 6,3 г/ 63 г/моль = 0,1 моль
С(HNO3) = ν(HNO3)/Vр-ра = 0,1 моль/ 0,5 л = 0,2 моль/л
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Пример
Найти
массу AlCl3,
необходимую для приготовления 2 л
раствора этой соли с массовой долей
12%. Плотность раствора ρ=1090 кг/м3
(1090 г/л). Вычислите нормалльность (молярную
концентрацию эквивалента), молярность
(молярную концентрацию), моляльность и
титр раствора.
Решение:
1.
Масса
раствора m(р-ра)
= V
∙ρ,
m(р-ра)
= 2л∙1090 г/л = 2180 г
2.
Массовая доля ω
– число граммов
растворенного вещества в 100 г раствора
Находим
массу AlCl3
для приготовления 2 л раствора с массовой
долей 12%.
3.
По таблице Менделеева находим молярную
массу AlCl3
(потребуется для расчета молярной
концентрации) и вычисляем молярную
массу эквивалента AlCl3
(потребуется для расчета нормальной
концентрации).
М(AlCl3)
= 27+3∙35,5=133,5 (г/моль) – молярная масса
AlCl3,
МЭКВ(AlCl3)
= 133,5/3 = 44,5 г/моль-экв – молярная масса
эквивалента AlCl3.
Как
найти эквивалет соли описано в главе
1.
Находим
число молей AlCl3
(количество вещества) и число
моль-эквивалентов
n(в-ва)=m(в-ва)/М(в-ва)=261,6
/ 133,5 = 1,96 (моль)
nэкв(в-ва)=m(в-ва)/Мэкв(в-ва)=
261,6 / 44,5= 5,88 моль-экв
4.
Находим молярную концентрацию СМ,
т.е. число молей AlCl3
в 1 л раствора.
См
= n
/
V
= 1,96 /2 = 0,98 моль/л
5.
Находим молярную концентрацию эквивалента
(нормальность) СH,
т.е. число эквивалентов вещества в 1 л
раствора (моль-экв/л), т.е.
|
Сн |
Сн |
|
Сн |
Сн |
6.
Находим моляльность раствора Сm,
т.е. число молей растворенного вещества
в 1 кг растворителя (моль/кг). Для этого
найдем массу воды.
m(воды)
=
m(р-ра)
– m(в-ва)
=
2180,0
г – 261,6 г = 1918,4 г=1,92
кг
=
=
1,02 моль/кг.
7. Находим
титр раствора, т.е. массу (г) растворенного
вещества, содержащегося в 1 мл раствора.
0,1308
г/мл.
Задание
6 контрольной работы
Найдите
массу соли, необходимую для приготовления
раствора объемом V
л с массовой долей .
Плотность раствора
Вычислите молярную концентрацию
эквивалента, молярную концентрацию,
моляльность и титр этого раствора.
|
Вариант |
Соль |
V, |
|
ρ, |
|
151 |
AlCl3 |
0,5 |
6 |
1052 |
|
152 |
AgNO3 |
1,5 |
8 |
1069 |
|
153 |
AgNO3 |
0,8 |
6 |
1050 |
|
154 |
Al2(SO4)3 |
0,8 |
6 |
1061 |
|
155 |
Al2(SO4)3 |
1,5 |
4 |
1040 |
|
156 |
BaCl2 |
3,0 |
4 |
1034 |
|
157 |
BaCl2 |
0,3 |
2 |
1015 |
|
158 |
CaCl2 |
0,5 |
12 |
1083 |
|
159 |
CaCl2 |
0,9 |
4 |
1031 |
|
160 |
CuSO4 |
2,5 |
8 |
1084 |
|
161 |
CuSO4 |
0,65 |
2 |
1019 |
|
162 |
FeCl3 |
0,9 |
12 |
1085 |
|
163 |
FeCl3 |
1,7 |
6 |
1049 |
|
164 |
FeSO4 |
1,5 |
4 |
1037 |
|
165 |
FeSO4 |
3,5 |
8 |
1078 |
|
166 |
K2CO3 |
2,0 |
12 |
1090 |
|
167 |
K2CO3 |
0,6 |
2 |
1016 |
|
168 |
K2Cr2O7 |
2,5 |
8 |
1055 |
|
169 |
K2Cr2O7 |
0,4 |
6 |
1040 |
|
170 |
K2SO4 |
3,0 |
6 |
1047 |
|
171 |
K2SO4 |
1,2 |
12 |
1081 |
|
172 |
MgSO4 |
4,0 |
4 |
1039 |
|
173 |
MgSO4 |
1,6 |
6 |
1060 |
|
174 |
Na2CO3 |
0,5 |
12 |
1102 |
|
175 |
Na2CO3 |
3,5 |
2 |
1019 |
|
176 |
Na2SO4 |
3,5 |
8 |
1072 |
|
177 |
Na2SO4 |
1,7 |
6 |
1053 |
|
178 |
Pb(NO3)2 |
1,5 |
6 |
1052 |
|
179 |
Pb(NO3)2 |
2,5 |
8 |
1072 |
|
180 |
Pb(NO3)2 |
0,5 |
12 |
1016 |
|
Таблица
Способы |
||||
|
Название |
Обозна-чение |
Способ |
Формула |
Единица |
|
Массовая
(процентная |
ω |
Отношение |
где |
% |
|
Мольная |
Хi |
Отношение |
где |
– |
|
Молярная |
См,
или |
Количество |
где |
моль/л, |
|
Молярная
(нормальная |
Сн,
или |
Количество |
Мэкв
fэкв |
моль-экв/л |
|
Моляльная |
Сm |
Количество |
|
моль/кг |
|
Титр |
Т |
Масса |
|
г/см3 |
Соседние файлы в папке химия
- #
- #
В реальности, химики редко работают с чистыми веществами. В большинстве своем для работы, при проведении химических реакций, расчетов по ним используются различные растворы.
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия
Подробнее о процессе растворения мы поговорим в следующих статьях.
При решении расчетных задач нам нудно уметь находить количество чистого вещества, находящегося в растворе. Это необходимо затем, что, как правило, в химическое взаимодействие вступает вещество, а не дополнительные продукты, которое оно содержит: примеси, если это не чистое вещество, компоненты растворителя, или инертные для данного химического процесса компоненты смеси (если это смесь веществ).
Если мы работаем с 500 граммами раствора, в котором всего 10 грамм чистого вещества, то в расчеты мы берем 10 грамм, а не 500! – пример, почему необходимо уметь вычислять количественные характеристики чистого вещества.
Способы выражения концентрации растворов
Существуют различные способы выражения концентраций растворов. В задачах могут встретиться любые из них. Рассмотрим основные из них более подробно.
I. Массовая доля вещества
Массовая доля – отношение массы чистого вещества к массе всего раствора. Данная величина безразмерная (говорят доля от единицы, всегда меньше 1, или равна единице для чистого вещества), или выражается в %.
Очень часто можно встретить запись запись, например NaOH, 15% – это значит, что из всей массы раствора на долю гидроксида натрия (NaOH) приходится только 15 %.
Следует не забывать, что масса раствора = масса растворителя + масса чистого вещества.
Зная массовую долю вещества, нетрудно выразить формулу для расчета массы чистого вещества:
В некоторых задачах масса раствора может быть не дана в условии. В этом случае мы сами можем её задать. Как правило в таких случаях, мы задаём массу раствора как 100 г. Дальнейший расчет ведется уже исходя из заданной массы (если требуется перевести одну концентрацию в другую).
Приведем примеры задач:
Мы специально делаем подробное решение, чтобы отследить ход мыслей.
Решим аналогичную задачу:
Более часто встречаются задачи, в которых требуется приготовить раствор из другого раствора путем добавления чистого вещества (в этом случае концентрация увеличится), растворителя (концентрация уменьшится) или другого раствора (концентрация займёт промежуточное значение).
Рассчитайте массу соли, которую необходимо добавить к 150 г 10% -го раствора, чтобы концентрация полученного раствора стала 15%?
Данную задачу можно решать различными способами. В настоящий момент приведем только один (более длинный, но более понятный). Для решения таких задач другим способом мы подготовим видео.
Задачи, в которых добавляется растворитель – решаются проще.
Какое количество воды необходимо добавить к 200 г 15%-го раствора, чтобы его концентрация стала 10%?
Для решения задач, в которых смешиваются два раствора, имеющих различные концентрации, можно использовать следующий алгоритм:
1. Рассчитать количество чистого вещества в обоих растворах и сложить их.
2. Поделить полученное число на сумму масс растворов. Домножить на 100 %.
Решим для примера следующую задачу
Смешали 200 г 10%-го раствора серной кислоты и 100 г 20-% го. Какая массовая доля стала у получившегося раствора?
II. Молярная концентрация вещества
Молярная концентрация вещества – отношение количества вещества к объему раствора. Данная величина показывает нам, сколько (моль) вещества растворено в 1 литре раствора. Единица измерения – моль/л.
Обозначается молярная концентрация заглавной буквой C
В химической лаборатории очень часто для обозначения концентрации используется именно данная величина.
Очень часто, на химических склянках можно увидеть следующие обозначения:
Таким способом также обозначается молярная концентрация. Число перед буквой М обозначает концентрацию: 1 моль/л; 0,1 моль/л; 0,02 моль/л; 3 моль/л; 0,5 моль/л.
Можно также встретить в задачах такое обозначение, связанное с данной формой записи: молярный раствор (1 М) – раствор, концентрация которого составляет 1 моль/л. Децимолярный раствор (0,1 М) – 0,1 моль/л; сантимолярный раствор (0,01 М) – 0,01 моль/л.
Решим некоторые задачи, в которых используется молярная концентрация:
Для приготовления раствора сульфата натрия навеску, содержащую 14,2 г соли растворили в 500 мл воды и довели до метки.
Доведение до метки обозначает, что объем приготовленного раствора составляет (в данном случае) 500 мл.
Часто требуется рассчитать количество вещества:
Прежде чем проводить расчет по уравнению химических реакций, необходимо найти количество вещества.
III. Моляльная концентрация
Моляльная концентрация – отношение количества (моль) растворенного вещества к массе растворителя. Данная концентрация показывает нам, сколько моль вещества необходимо добавить к 1 кг растворителя (воды, например), чтобы получить нужную концентрации. Обозначается данная концентрация См, а измеряется в моль/кг(растворителя).
IV. Мольная доля
Мольная доля – отношение количества вещества к сумме количеств всех компонентов раствора. Данная физическая величина не имеет размерности.
Сумма всех мольных долей раствора равна “1”.
Данная физическая величина нашла широкое применение в химической химии для описания равновесных термодинамических процессов.
V. Титр
Титр – отношение массы вещества к единице объема (выраженного в миллилитрах). Титр показывает, сколько грамм вещества находится в каждом миллилитре раствора. обозначается как “Т” и измеряется в г/мл.
Титр – очень маленькая величина, так как в в 1 миллилитре раствора может находиться незначительное количество вещества.
Титр нашел широкое применение в аналитической химии.
В заключении
По данной теме существует огромное количество расчетных задач. Многие из них мы рассмотрим в следующих статьях. О пока…
Проверьте, как Вы усвоили материал.
Задание №1. Перейдите к гугл-форме и ответьте на вопросы (базовый уровень):
https://forms.gle/7u32uLfxRk1Yug7a8
Задание №2. Решите расчетные задачи: https://vk.com/page-205267346_56951920 (повышенный уровень)
Задание №3. Решите следующую задачу:
Какова молярная концентрация 12%-ного раствора серной кислоты (H2S04) с плотностью р = 1,08 г/см3. Рассчитайте титр данного вещества, моляльную концентрацию, мольную долю.
Отчет о решении задач пришли в беседу “Учебный класс”:
https://vk.me/join/DKsyQe2p0hJ2Wdoch1XOTwi_qZEJow1udOM=
Определение молярности раствора
Молярность (molarity) – способ выражения концентрации, показывающей количество растворенного вещества (n, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
1. Определим количество вещества серной кислоты:
2. Определим объем раствора:
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
CМ = n(H2SO4)/V(p-pa) = 0,245/0,09437 = 2,6 моль/л.
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.
Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
1. Определим объем 700 г раствора
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 . 40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
1 . Определяем количество вещества NаС1:
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН2О) = 3 + 200 = 203 г.
3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
Определим молярную концентрацию NаС1 в растворе:
Ответ: 0,24моль/л.
Комментарии:
1Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2Справочное значение плотности данного раствора равно 1,009 г/мл.

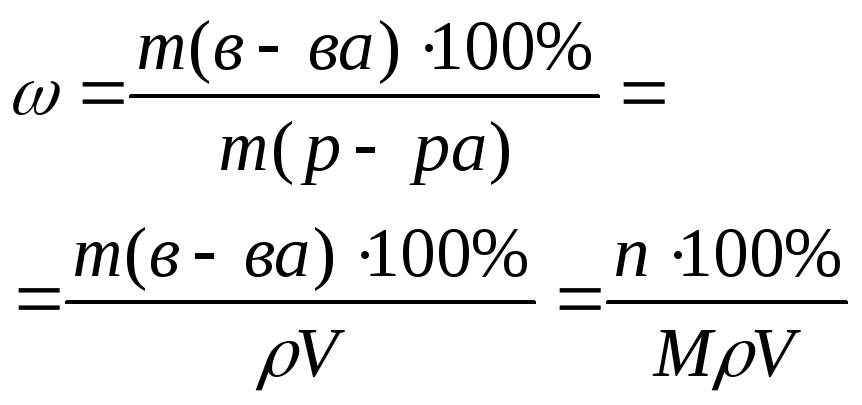 ,
,