Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
лол
Знаток
(260),
на голосовании
13 лет назад
Голосование за лучший ответ
Лариса Нечаева
Мудрец
(14248)
13 лет назад
У сложного вещества сульфата алюминия есть Относительная молекулярная и Молярная массы, которые складываются из относительных атомных масс.
М (AI2(SO4)3)=2*27+3(32+4*16)=342г/моль
Похожие вопросы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июня 2020 года; проверки требуют 11 правок.
| Сульфат алюминия | |
|---|---|
 ![{displaystyle mathrm { ! {Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)  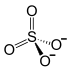 ![{displaystyle mathrm { ! {Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0) |
|
 |
|
| Общие | |
| Традиционные названия | сернокислый алюминий |
| Хим. формула | Al2O12S3 |
| Рац. формула | Al2(SO4)3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 342,15 г/моль |
| Плотность |
2,710 г/см3 (безв.) 1,690 г/см3 (18-водн.) |
| Термические свойства | |
| Температура | |
| • плавления | 700 °C[1] |
| • кипения | 1600 °C[2] |
| • разложения | 580 °C |
| Классификация | |
| Рег. номер CAS | 10043-01-3 |
| PubChem | 24850 |
| Рег. номер EINECS | 233-135-0 |
| SMILES |
O=S1(=O)O[Al]2OS(=O)(=O)O[Al](O1)OS(=O)(=O)O2 |
| InChI |
InChI=1S/2Al.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 DIZPMCHEQGEION-UHFFFAOYSA-H |
| Кодекс Алиментариус | E520 |
| RTECS | BD1700000 |
| ChEBI | 74768 |
| ChemSpider | 23233 |
| Безопасность | |
| Токсичность | малотоксично |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфа́т алюми́ния — сложное неорганическое соединение, соль алюминия и серной кислоты с химической формулой Al2(SO4)3. Выглядит как бесцветные кристаллы, может образовывать кристаллогидраты с различным содержанием воды. Применяется при очистке воды, крашении тканей, дублении кож, как реактив в фотографии, для получения квасцов.
Физические свойства[править | править код]
Бесцветные кристаллы, пластинки или порошок. Имеет орторомбическую решетку. Плотность — 2,710 г/см3, удельная теплоёмкость при постоянном давлении — 259,6 Дж/(моль К). Плохо растворим в спиртах, хорошо растворим в воде, гигроскопичен. Устойчив при обычной температуре[3][4].
Образует кристаллогидрат с формулой Al2(SO4)3·18H2O, выглядящий как бесцветные кристаллы, плавящиеся при 86,5 °C (с разложением) и с плотностью 1,690 г/см3. При длительном хранении 18-водный кристаллогидрат может частично выветриваться до содержания 14—14,5 молекул воды. 18-водный кристаллогидрат теряет воду при нагревании, образуя формы[3]:
- 150 °C — Al2(SO4)3·14 H2O,
- 160 °C — Al2(SO4)3·10 H2O,
- 250 °C — Al2(SO4)3·3 H2O,
- 420 °C — полностью безводную.
Химические свойства[править | править код]
- Сульфат алюминия разлагается при температуре выше 580 °C на γ-модификацию окиси алюминия и серный ангидрид[3]:
- Задубливает желатиновые фотослои, что используется в производстве фотографических материалов для повышения механической прочности слоев фотоэмульсии, а в цветной фотографии также для предохранения красителей от гидролитического распада. Механизм дубления обусловлен связыванием ионами алюминия ионизированных карбоксильных групп желатины[4][5].
- Гидролизуется горячей водой:
- При сплавлении со щелочами образует алюминаты:
- В холодном концентрированном растворе аммиака образует осадок гидроксида, а в горячем – метагидроксида алюминия[6]:
Получение[править | править код]
Сульфат алюминия получают взаимодействием гидроксида алюминия с серной кислотой:
Также сульфат алюминия получают взаимодействием алюминия с серной кислотой:
Применение[править | править код]
Сульфат алюминия применяется как коагулянт для очистки воды хозяйственно-питьевого и промышленного назначения и используется в бумажной, текстильной, кожевенной и других отраслях промышленности.
Используется в качестве пищевой добавки E520[7].
В фотографии входит в составы стабилизирующих растворов и дубящих фиксажей[4].
Примечания[править | править код]
- ↑ Aluminum sulfate, Aluminum sulfate (англ.)
- ↑ Aluminum sulfate, Aluminum sulfate
- ↑ 1 2 3 Волохов, 1988.
- ↑ 1 2 3 Гурлев, 1988, с. 285.
- ↑ Джеймс, 1980, с. 83.
- ↑ Лидин, 2000, с. 85.
- ↑ E-520 (Е-520) Сульфат алюминия. Дата обращения: 30 марта 2010. Архивировано 15 сентября 2011 года.
Литература[править | править код]
- Волохов Ю. А. Алюминия сульфат : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М. : Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 121. — 623 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — 335 с. — ISBN 5-335-00125-4.
- Джеймс Т. Теория фотографического процесса = The theory of the photographic process / пер. 4-го американского изд. под ред. Картужанского А. Л.. — 2-е русское изд. — Л.: «Химия». Ленинградское отделение., 1980. — 672 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Molecular formula: Al2(SO4)3 or Al2O12S3
- Relative molecular weight of Al2(SO4)3: 342.1508772
- Molar mass of Al2(SO4)3: 342.1508772 g/mol (0.34215 kg/mol)
| Element | Total atoms | Atomic mass | Total mass |
|---|---|---|---|
| Al (Aluminum) | 2 | 26.9815386 | 53.9630772 |
| O (Oxygen) | 12 | 15.9994 | 191.9928 |
| S (Sulfur) | 3 | 32.065 | 96.195 |
| 342.1508772 |
Calculation of the relative molecular and molar mass of Al2(SO4)3
- Mr[Al2(SO4)3] = Ar[Al] * 2 + Ar[O] * 12 + Ar[S] * 3 = 26.9815386 * 2 + 15.9994 * 12 + 32.065 * 3 = 342.1508772
- Molar mass (kg/mol) = Mr[Al2(SO4)3] : 1000 = 342.1508772 : 1000 = 0.34215 kg/mol
Al2(SO4)3: percent composition by element
- Aluminum (Al) = 53.9630772 : 342.1508772 * 100 = 15.772 %
- Oxygen (O) = 191.9928 : 342.1508772 * 100 = 56.113 %
- Sulfur (S) = 96.195 : 342.1508772 * 100 = 28.115 %
Molar mass calculator
Molar mass of (Al2(SO4)3) = 342.150876 g/mol
Convert grams (Al2(SO4)3) to moles
or
moles (Al2(SO4)3) to grams
Molecular weight calculation:
(26.981538*2 + (32.065 + 15.9994*4)*3)
Percent composition by element
Element: Aluminium
Symbol: Al
Atomic Mass: 26.981538
# of Atoms: 2
Mass Percent: 15.772%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 12
Mass Percent: 56.113%
Element: Sulfur
Symbol: S
Atomic Mass: 32.065
# of Atoms: 3
Mass Percent: 28.115%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.








