-
Типы задач в задании С5.
-
Необходимые теоретические сведения.
-
Определение формул веществ по массовым долям атомов, входящих в его состав.
-
Определение формул веществ по продуктам сгорания.
-
Определение формул веществ по химическим свойствам.
-
Задачи для самостоятельного решения.
-
Часть 1. Определение формулы вещества по составу.
-
Часть 2. Определение формулы вещества по продуктам сгорания.
-
Часть 3. Определение формулы вещества по химическим свойствам.
-
Ответы и комментарии к задачам для самостоятельного решения.
Задачи на определение формулы органического вещества бывают нескольких видов. Обычно решение этих задач не представляет особых сложностей, однако часто выпускники теряют баллы на этой задаче. Причин бывает несколько:
- Некорректное оформление;
- Решение не математическим путем, а методом перебора;
- Неверно составленная общая формула вещества;
- Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
к оглавлению ▴
Типы задач в задании С5.
- Определение формулы вещества по массовым долям химических элементов или по общей формуле вещества;
- Определение формулы вещества по продуктам сгорания;
- Определение формулы вещества по химическим свойствам.
Необходимые теоретические сведения.
- Массовая доля элемента в веществе.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
Например, в веществе состава С2Н4 содержится 2 атома углерода и 4 атома водорода. Если взять 1 молекулу такого вещества, то его молекулярная масса будет равна:
Мr(С2Н4) = 2 • 12 + 4 • 1 = 28 а.е.м. и там содержится 2 • 12 а.е.м. углерода.Чтобы найти массовую долю углерода в этом веществе, надо его массу разделить на массу всего вещества:
ω(C) = 12 • 2 / 28 = 0,857 или 85,7%.
Если вещество имеет общую формулу СхНуОz, то массовые доли каждого их атомов так же равны отношению их массы к массе всего вещества. Масса х атомов С равна — 12х, масса у атомов Н — у, масса z атомов кислорода — 16z.
Тогда
ω(C) = 12 • х / (12х + у + 16z)Если записать эту формулу в общем виде, то получится следующее выражение:
Массовая доля атома Э в веществе = Атомная масса атома Э • число атомов Э в молекуле Аr(Э) • z —————— Mr(вещ.) Молекулярная масса вещества - Молекулярная и простейшая формула вещества.Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.Примеры.
Вещество Молекулярная формула Соотношение атомов Простейшая формула Этанол С2Н6О С:Н:О = 2:6:1 С2Н6О Бутен С4Н8 С:Н = 1:2 СН2 Уксусная кислота С2Н4О2 С:Н:О = 1:2:1 СН2О Если в задаче даны только массовые доли элементов, то в процессе решения задачи можно вычислить только простейшую формулу вещества. Для получения истинной формулы в задаче обычно даются дополнительные данные — молярная масса, относительная или абсолютная плотность вещества или другие данные, с помощью которых можно определить молярную массу вещества.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У:
DпоУ(Х) = М(Х) / М(У)
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Относительная плотность газа Х по водороду:
Dпо H2 = M(газа Х) / M(H2) = M(газа Х) / 2
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
Поэтому:
Dпо возд. = М(газа Х) / 29 - Абсолютная плотность газа при нормальных условиях.Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
ρ = m(газа) / V(газа)
Если взять 1 моль газа, то тогда:
ρ = М / Vm,
а молярную массу газа можно найти, умножая плотность на молярный объём. - Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно кратная связь или функциональная группа.Класс органических веществ Общая молекулярная формула Формула с выделенной кратной связью и функциональной группой Алканы CnH2n+2 — Алкены CnH2n CnH2n+1–CH=CH2 Алкины CnH2n−2 CnH2n+1–C≡CH Диены CnH2n−2 — Гомологи бензола CnH2n−6 С6Н5–СnH2n+1 Предельные одноатомные спирты CnH2n+2O CnH2n+1–OH Многоатомные спирты CnH2n+2Ox CnH2n+2−x(OH)x Предельные альдегиды CnH2nO Кетоны CnH2nO O // CnH2n+1– C– O–CmH2m+1 Фенолы CnH2n−6O С6Н5(СnH2n)–OH Предельные карбоновые кислоты CnH2nO2 Сложные эфиры CnH2nO2 O // CnH2n+1– C– O–CmH2m+1 Амины CnH2n+3N СnH2n+1NH2 Аминокислоты (предельные одноосновные) CnH2n+1NO2 O // NH2– CH– C– OH C nH 2n+1
к оглавлению ▴
Определение формул веществ по массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
- сначала находят мольное соотношение атомов в веществе — оно соответствует его простейшей формуле. Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует соотношению числа их атомов в молекуле:
х : у = n(A) : n(B); - затем, используя молярную массу вещества, определяют его истинную формулу.
-
Пример 1.
Определить формулу вещества, если оно содержит 84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение примера 1.
- Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса Н — 15,79 г.
- Найдём количество вещества каждого атома:
ν(C) = m / M = 84,21 / 12 = 7,0175 моль,
ν(H) = 15,79 / 1 = 15,79 моль. - Определяем мольное соотношение атомов С и Н:
С : Н = 7,0175 : 15,79 (сократим оба числа на меньшее) = 1 : 2,25 (домножим на 4) = 4 : 9.
Таким образом, простейшая формула — С4Н9. - По относительной плотности рассчитаем молярную массу:
М = D(возд.) • 29 = 114 г/моль.
Молярная масса, соответствующая простейшей формуле С4Н9 — 57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула — С8Н18.
Есть гораздо более простой метод решения такой задачи, но, к сожалению, за него не поставят полный балл. Зато он подойдёт для проверки истинной формулы, т.е. с его помощью вы можете проверить своё решение.
Метод 2: Находим истинную молярную массу (114 г/моль), а затем находим массы атомов углерода и водорода в этом веществе по их массовым долям.
m(C) = 114 • 0,8421 = 96; т.е. число атомов С 96/12 = 8
m(H) = 114 • 0,1579 = 18; т.е число атомов Н 18/1 = 18.
Формула вещества — С8Н18.
Ответ: С8Н18.
-
Пример 2.
Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение примера 2.
Общая формула алкина СnH2n−2
Как, имея плотность газообразного алкина, найти его молярную массу? Плотность ρ — это масса 1 литра газа при нормальных условиях.
Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность ρ) • (молярный объём Vm) = 2,41 г/л • 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 • n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
-
Пример 3.
Определить формулу предельного альдегида, если известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение примера 3.
В этой задаче дано число молекул и соответствующая масса. Исходя из этих данных, нам необходимо вновь найти величину молярной массы вещества.
Для этого нужно вспомнить, какое число молекул содержится в 1 моль вещества.
Это число Авогадро: Na = 6,02•1023 (молекул).
Значит, можно найти количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль,
и молярную массу:
М = m / n = 4,3 / 0,05 = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Ответ: С5Н10О, пентаналь.
-
Пример 4.
Определить формулу дихлоралкана, содержащего 31,86 % углерода.
Решение примера 4.
Общая формула дихлоралкана: СnH2nCl2, там 2 атома хлора и n атомов углерода.
Тогда массовая доля углерода равна:
ω(C) = (число атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана)
0,3186 = n • 12 / (14n + 71)
n = 3, вещество — дихлорпропан.
Ответ: С3Н6Cl2, дихлорпропан.
к оглавлению ▴
Определение формул веществ по продуктам сгорания.
В задачах на сгорание количества веществ элементов, входящих в исследуемое вещество, определяют по объёмам и массам продуктов сгорания — углекислого газа, воды, азота и других. Остальное решение — такое же, как и в первом типе задач.
-
Пример 5.
448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение примера 5.
- Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль. - При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция — 8 г, молярная масса карбоната кальция 100 г/моль.
Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль. - Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана С4Н10.
Ответ: С4Н10.
-
Пример 6.
Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9,8 г этого соединения образуется 15,68 л углекислого газа (н. у) и 12,6 г воды. Выведите молекулярную формулу органического соединения.
Решение примера 6.
Так как вещество при сгорании превращается в углекислый газ и воду, значит, оно состоит из атомов С, Н и, возможно, О. Поэтому его общую формулу можно записать как СхНуОz.
- Схему реакции сгорания мы можем записать (без расстановки коэффициентов):
СхНуОz + О2 → CO2 + H2O
Весь углерод из исходного вещества переходит в углекислый газ, а весь водород — в воду. - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = V / Vm = 15,68 / 22,4 = 0,7 моль.
На одну молекулу CO2 приходится один атом С, значит, углерода столько же моль, сколько CO2.ν(C) = 0,7 моль
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.В одной молекуле воды содержатся два атома Н, значит количество водорода в два раза больше, чем воды.
ν(H) = 0,7 • 2 = 1,4 моль. - Проверяем наличие в веществе кислорода. Для этого из массы всего исходного вещества надо вычесть массы С и Н.
m(C) = 0,7 • 12 = 8,4 г, m(H) = 1,4 • 1 = 1,4 г
Масса всего вещества 9,8 г.
m(O) = 9,8 − 8,4 − 1,4 = 0, т.е.в данном веществе нет атомов кислорода.
Если бы кислород в данном веществе присутствовал, то по его массе можно было бы найти количество вещества и рассчитывать простейшую формулу, исходя из наличия трёх разных атомов. - Дальнейшие действия вам уже знакомы: поиск простейшей и истинной формул.
С : Н = 0,7 : 1,4 = 1 : 2
Простейшая формула СН2. - Истинную молярную массу ищем по относительной плотности газа по азоту (не забудьте, что азот состоит из двухатомных молекул N2 и его молярная масса 28 г/моль):
Mист. = Dпо N2 • M(N2) = 2 • 28 = 56 г/моль.
Истиная формула СН2, её молярная масса 14.
56 / 14 = 4.
Истинная формула С4Н8.
Ответ: С4Н8.
-
Пример 7.
Определите молекулярную формулу вещества, при сгорании 9 г которого образовалось 17,6 г CO2, 12,6 г воды и азот. Относительная плотность этого вещества по водороду — 22,5. Определить молекулярную формулу вещества.
Решение примера 7.
- Вещество содержит атомы С,Н и N. Так как масса азота в продуктах сгорания не дана, её надо будет рассчитывать, исходя из массы всего органического вещества.
Схема реакции горения:
СхНуNz + O2 → CO2 + H2O + N2 - Находим количества веществ CO2 и H2O, и определяем, сколько моль атомов С и Н в них содержится:
ν(CO2) = m / M = 17,6 / 44 = 0,4 моль.
ν(C) = 0,4 моль.
ν(Н2О) = m / M = 12,6 / 18 = 0,7 моль.
ν(H) = 0,7 • 2 = 1,4 моль. - Находим массу азота в исходном веществе.
Для этого из массы всего исходного вещества надо вычесть массы С и Н.m(C) = 0,4 • 12 = 4,8 г,
m(H) = 1,4 • 1 = 1,4 гМасса всего вещества 9,8 г.
m(N) = 9 − 4,8 − 1,4 = 2,8 г ,
ν(N) = m /M = 2,8 / 14 = 0,2 моль. - C : H : N = 0,4 : 1,4 : 0,2 = 2 : 7 : 1
Простейшая формула — С2Н7N.
Истинная молярная масса
М = Dпо Н2 • М(Н2) = 22,5 • 2 = 45 г/моль.
Она совпадает с молярной массой, рассчитанной для простейшей формулы. То есть это и есть истинная формула вещества.
Ответ: С2Н7N.
-
Пример 8.
Вещества содержит С, Н, О и S. При сгорании 11 г его выделилось 8,8 г CO2, 5,4 г Н2О, а сера была полностью переведена в сульфат бария, масса которого оказалась равна 23,3 г. Определить формулу вещества.
Решение примера 8.
Формулу заданного вещества можно представить как CxHySzOk. При его сжигании получается углекислый газ, вода и сернистый газ, который затем превращают в сульфат бария. Соответственно, вся сера из исходного вещества превращена в сульфат бария.
- Находим количества веществ углекислого газа, воды и сульфата бария и соответствующих химических элементов из исследуемого вещества:
ν(CO2) = m/M = 8,8/44 = 0,2 моль.
ν(C) = 0,2 моль.
ν(Н2О) = m / M = 5,4 / 18 = 0,3 моль.
ν(H) = 0,6 моль.
ν(BaSO4) = 23,3 / 233 = 0,1 моль.
ν(S) = 0,1 моль. - Рассчитываем предполагаемую массу кислорода в исходном веществе:
m(C) = 0,2 • 12 = 2,4 г
m(H) = 0,6 • 1 = 0,6 г
m(S) = 0,1 • 32 = 3,2 г
m(O) = mвещества − m(C) − m(H) − m(S) = 11 − 2,4 − 0,6 − 3,2 = 4,8 г,
ν(O) = m / M = 4,8 / 16 = 0,3 моль - Находим мольное соотношение элементов в веществе:
C : H : S : O = 0,2 : 0,6 : 0,1 : 0,3 = 2 : 6 : 1 : 3
Формула вещества C2H6SO3.
Надо отметить, что таким образом мы получили только простейшую формулу.
Однако, полученная формула является истинной, поскольку при попытке удвоения этой формулы (С4Н12S2O6) получается, что на 4 атома углерода, помимо серы и кислорода, приходится 12 атомов Н, а это невозможно.
Ответ: C2H6SO3.
к оглавлению ▴
Определение формул веществ по химическим свойствам.
-
Пример 9.
Определить формулу алкадиена, если г его могут обесцветить 80 г 2%-го раствора брома.
Решение примера 9.
- Общая формула алкадиенов — СnH2n−2.
Запишем уравнение реакции присоединения брома к алкадиену, не забывая, что в молекуле диена две двойные связи и, соответственно, в реакцию с 1 моль диена вступят 2 моль брома:
СnH2n−2 + 2Br2 → СnH2n−2Br4 - Так как в задаче даны масса и процентная концентрация раствора брома, прореагировавшего с диеном, можно рассчитать количества вещества прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г
ν(Br2) = m / M = 1,6 / 160 = 0,01 моль. - Так как количество брома, вступившего в реакцию, в 2 раза больше, чем алкадиена, можно найти количество диена и (так как известна его масса) его молярную массу:
0,005 0,01 СnH2n−2 + 2Br2 → СnH2n−2Br4 Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
- Находим формулу алкадиена по его общей формул, выражая молярную массу через n:
14n − 2 = 68
n = 5.Это пентадиен С5Н8.
Ответ: C5H8.
-
Пример 10.
При взаимодействии 0,74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение примера 10.
- Формула предельного одноатомного спирта — CnH2n+1OH. Здесь удобно записывать спирт в такой форме, в которой легко составить уравнение реакции — т.е. с выделенной отдельно группой ОН.
- Составим уравнения реакций (нельзя забывать о необходимости уравнивать реакции):
2CnH2n+1OH + 2Na
→
2CnH2n+1ONa + H2
C3H6 + H2→
C3H8
- Можно найти количество пропена, а по нему — количество водорода. Зная количество водорода, по реакции находим количество вещества спирта:
ν(C3H6) = V / Vm = 0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль,
νспирта = 0,005 • 2 = 0,01 моль. - Находим молярную массу спирта и n:
Mспирта = m / ν = 0,74 / 0,01 = 74 г/моль,
14n + 18 = 74
14n = 56
n = 4.Спирт — бутанол С4Н7ОН.
Ответ: C4H7OH.
-
Пример 11.
Определить формулу сложного эфира, при гидролизе 2,64 г которого выделяется 1,38 г спирта и 1,8 г одноосновной карбоновой кислоты.
Решение примера 11.
- Общую формулу сложного эфира, состоящего из спирта и кислоты с разным числом атомов углерода можно представить в таком виде:
CnH2n+1COOCmH2m+1
Соответственно, спирт будет иметь формулу
CmH2m+1OH,
а кислота
CnH2n+1COOH.
Уравнение гидролиза сложного эфира:
CnH2n+1COOCmH2m+1 + H2O → CmH2m+1OH + CnH2n+1COOH - Согласно закону сохранения массы веществ, сумма масс исходных веществ и сумма масс продуктов реакции равны.
Поэтому из данных задачи можно найти массу воды:mH2O = (масса кислоты) + (масса спирта) − (масса эфира) = 1,38 + 1,8 − 2,64 = 0,54 г
νH2O = m / M = 0,54 / 18 = 0,03 мольСоответственно, количества веществ кислоты и спирта тоже равны моль.
Можно найти их молярные массы:Мкислоты = m / ν = 1,8 / 0,03 = 60 г/моль,
Мспирта = 1,38 / 0,03 = 46 г/моль.Получим два уравнения, из которых найдём m и n:
MCnH2n+1COOH = 14n + 46 = 60, n = 1 — уксусная кислота
MCmH2m+1OH = 14m + 18 = 46, m = 2 — этанол.Таким образом, искомый эфир — это этиловый эфир уксусной кислоты, этилацетат.
Ответ: CH3COOC2H5.
-
Пример 12.
Определить формулу аминокислоты, если при действии на 8,9 г её избытком гидроксида натрия можно получить 11,1 г натриевой соли этой кислоты.
Решение примера 12.
- Общая формула аминокислоты (если считать, что она не содержит никаких других функциональных групп, кроме одной аминогруппы и одной карбоксильной):
NH2–CH(R)–COOH.
Можно было бы записать её разными способами, но для удобства написания уравнения реакции лучше выделять в формуле аминокислоты функциональные группы отдельно. - Можно составить уравнение реакции этой аминокислоты с гидроксидом натрия:
NH2–CH(R)–COOH + NaOH → NH2–CH(R)–COONa + H2O
Количества вещества аминокислоты и её натриевой соли — равны. При этом мы не можем найти массу какого-либо из веществ в уравнении реакции. Поэтому в таких задачах надо выразить количества веществ аминокислоты и её соли через молярные массы и приравнять их:M(аминокислоты NH2–CH(R)–COOH) = 74 + МR
M(соли NH2–CH(R)–COONa) = 96 + МR
νаминокислоты = 8,9 / (74 + МR),
νсоли = 11,1 / (96 + МR)
8,9 / (74 + МR) = 11,1 / (96 + МR)
МR = 15Легко увидеть, что R = CH3.
Можно это сделать математически, если принять, что R — CnH2n+1.
14n + 1 = 15, n = 1.
Это аланин — аминопропановая кислота.
Ответ: NH2–CH(CH3)–COOH.
к оглавлению ▴
Задачи для самостоятельного решения.
Часть 1. Определение формулы вещества по составу.
1–1. Плотность углеводорода при нормальных условиях равна 1,964 г/л. Массовая доля углерода в нем равна 81,82%. Выведите молекулярную формулу этого углеводорода.
1–2. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина.
1–3. Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4,07. Выведите молекулярную формулу карбоновой кислоты.
1–4. 2 л алкадиена при н.у. имеет массу, равную 4,82 г. Выведите молекулярную формулу алкадиена.
1–5. (ЕГЭ–2011) Установите формулу предельной одноосновной карбоновой кислоты, кальциевая соль которой содержит 30,77 % кальция.
к оглавлению ▴
Часть 2. Определение формулы вещества по продуктам сгорания.
2–1. Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19,2 г этого вещества образуется 52,8 г углекислого газа (н.у.) и 21,6 г воды. Выведите молекулярную формулу органического соединения.
2–2. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) СО2 и 1,26 г воды. Определите молекулярную формулу вещества, зная, что в указанной навеске вещества содержится 1,204•1022 молекул.
2–3. Углекислый газ, полученный при сгорании 3,4 г углеводорода, пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода.
2–4. При сгорании органического вещества, содержащего С, Н и хлор, выделилось 6,72 л (н.у.) углекислого газа, 5,4 г воды, 3,65 г хлороводорода. Установите молекулярную формулу сгоревшего вещества.
2–5. (ЕГЭ–2011) При сгорании амина выделилось 0,448 л (н.у.) углекислого газа, 0,495 г воды и 0,056 л азота. Определить молекулярную формулу этого амина.
к оглавлению ▴
Часть 3. Определение формулы вещества по химическим свойствам.
3–1. Определить формулу алкена, если известно, что он 5,6 г его при присоединении воды образуют 7,4 г спирта.
3–2. Для окисления 2,9 г предельного альдегида до кислоты потребовалось 9,8 г гидроксида меди (II). Определить формулу альдегида.
3–3. Одноосновная моноаминокислота массой 3 г с избытком бромоводорода образует 6,24 г соли. Определить формулу аминокислоты.
3–4. При взаимодействии предельного двухатомного спирта массой 2,7 г с избытком калия выделилось 0,672 л водорода. Определить формулу спирта.
3–5. (ЕГЭ–2011) При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определить молекулярную формулу этого спирта.
к оглавлению ▴
Ответы и комментарии к задачам для самостоятельного решения.
1–1. С3Н8
1–2. С3Н6(NH2)2
1–3. C2H4(COOH)2
1–4. C4H6
1–5. (HCOO)2Ca — формиат кальция, соль муравьиной кислоты
2–1. С8Н16О
2–2. С3Н7NO
2–3. С5Н8 (массу водорода находим, вычитая из массы углеводорода массу углерода)
2–4. C3H7Cl (не забудьте, что атомы водорода содержатся не только в воде, но и в HCl)
2–5. C4H11N
3–1. С4Н8
3–2. С3Н6О
3–3. С2Н5NO2
3–4. C4H8(OH)2
3–5. C4H9OH
Спасибо за то, что пользуйтесь нашими статьями.
Информация на странице «Химия, часть С. Задача С5. Определение формул органических веществ.» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из разделов нашего сайта.
Публикация обновлена:
08.05.2023
Random converter
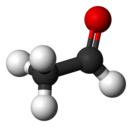
ацетальдегид: состав и молярная масса
Химическая формула
Молярная масса CH3CHO, ацетальдегид 44.05256 г/моль
12,0107+1,00794·3+12,0107+1,00794+15,9994
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Carboneum | C | 12.0107 | 2 | 54.529% |
| Hydrogenium | H | 1.00794 | 4 | 9.153% |
| Oxygenium | O | 15.9994 | 1 | 36.319% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы

Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль

Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса

Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Запишем общие формулы веществ: формула одноосновной насыщенной кислоты, которая по условию должна иметь на 2 атома С больше( значит и на 4 атома Н и на один атом О), Сn₊₂H₂₊₄nO₂ и формула альдегида СnH₂nO. Найдем на какую разницу молярная масса кислоты будет тяжелее альдегида:2(СН₂) и О=28+16=44 г/моль
Обозначим молярную массу альдегида за (х), тогда молярная масса кислоты (х+44). Составим соотношения молярных масс соответственно условию задачи: х/(х+44)=1/1,759
1,759х =х + 44; 0,759х=44; х = 58 (г/моль), тогда х + 44 = 58 +44 = 102 (г/моль)
Итак, молярная масса альдегида CnH₂nO = 58. Найдем n, подставив атомные массы элементов:
12n +2n + 16 = 58; 14n = 42; n = 3, (С₃Н₆О пропаналь)
формула кислоты содержит на 2 атома С больше С₄Н₉СООН ( пентановая кислота)
| Ацетальдегид | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Этаналь | |
| Традиционные названия | Ацетальдегид, метилформальдегид, уксусный альдегид, “альдоцит” | |
| Хим. формула |
С2H4O |
|
| Рац. формула | СH3СHO | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 44,0526 ± 0,0022 г/моль | |
| Плотность | 0,784 г/см³ | |
| Динамическая вязкость | ~0,215 при 20 °C | |
| Энергия ионизации | 10,22 ± 0,01 эВ[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −123,37 °C | |
| • кипения | 20,2 °C | |
| • вспышки | −36 ± 1 ℉[1] | |
| • воспламенения | 234,15 K (−39 °C) °C | |
| • самовоспламенения | 458,15 K (185 °C) °C | |
| Пределы взрываемости | 4-60 % | |
| Критическая точка | 192,85 | |
| Энтальпия | ||
| • образования | -166 кДж/моль | |
| Давление пара | 2,7650; 4,8670; 10,0100 [2] атм | |
| Химические свойства | ||
Константа диссоциации кислоты  |
13,57 (25 °C) | |
| Растворимость | ||
| • в воде | С водой и этанолом смешивается во всех соотношениях. | |
| Оптические свойства | ||
| Показатель преломления | 1,3316 | |
| Структура | ||
| Дипольный момент | 2,750 ± 0,006 Д | |
| Классификация | ||
| Рег. номер CAS | 75-07-0 | |
| PubChem | 177 | |
| Рег. номер EINECS | 200-836-8 | |
| SMILES |
O=CC |
|
| InChI |
InChI=1S/C2H4O/c1-2-3/h2H,1H3 IKHGUXGNUITLKF-UHFFFAOYSA-N |
|
| RTECS | AB1925000 | |
| ChEBI | 15343 | |
| Номер ООН | 1089 | |
| ChemSpider | 172 | |
| Безопасность | ||
| Предельная концентрация | 5 мг/м3 | |
| ЛД50 |
1232 мг/кг (мыши, внутрижелудочно), 900 мг/кг (мыши, перорально), 661 мг/кг (крысы, перорально) |
|
| Токсичность | умеренно токсичен, ирритант, опасен для окружающей среды | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
4 3 3 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Ацетальдеги́д (у́ксусный альдегид, этана́ль, в просторечии – альдоцит, химическая формула — С2H4O или СH3СHO) — органическое соединение, относящееся к классу альдегидов. Является альдегидом этанола и уксусной кислоты.
При стандартных условиях, ацетальдегид — это бесцветная жидкость с резким запахом. Умеренно токсичен, является ирритантом и опасен для окружающей среды.
Нахождение в природе[править | править код]
Ацетальдегид широко встречается в природе, например, он встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями в процессе их метаболизма.[источник?]
Физические свойства[править | править код]
Вещество представляет собой бесцветную ядовитую жидкость при стандартных условиях (0°C), бесцветный газ с резким запахом, похожим на запах прелых яблок при комнатной температуре (25°C), хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Химические свойства[править | править код]
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила.
Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10−5 при комнатной температуре[3]):
Реакция конденсации[править | править код]
Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе[4]. Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера[5] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин[6]. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация[7].
Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»)[8]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
Производные ацеталя[править | править код]
Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь»[9], хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR’)2.
Получение[править | править код]
В 2003 году, глобальное производство ацетальдегида составляло около миллиона тонн в год.
Ацетальдегид получают следующими способами:
1) Окисление этилена (Вакер-процесс):
В качестве окислителя в Вакер-процессе используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
2) Гидратация ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, изомеризующегося в альдегид:
3) Окисление или дегидрирование этилового спирта, на медном или серебряном катализаторе (данный способ получения доминировал до открытия Вакер-процесса):
Применение[править | править код]
Ацетальдегид применяют для получения уксусной кислоты, бутадиена, некоторых органических веществ и альдегидных полимеров.
Ранее ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте.
Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производилась из метанола при помощи процессов Монсанто[10] и Катива[11]. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата.
Биохимия[править | править код]
В печени имеется фермент алкогольдегидрогеназа, который окисляет этанол в ацетальдегид, который затем окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH[12]. В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза.
Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируватдекарбоксилазы, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Табачная зависимость[править | править код]
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи.[13][14]
Болезнь Альцгеймера[править | править код]
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают, что отсутствие ALDH2 — это фактор риска для поздно возникающей болезни Альцгеймера.»[15]
Проблема алкоголя[править | править код]
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов.[16]
Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Канцероген[править | править код]
Ацетальдегид является канцерогеном первой группы.[17][18] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК[19] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма.[20] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени.[21]
Безопасность[править | править код]
Ацетальдегид[22] токсичен при действии на кожу, ирритант, канцероген[нет в источнике]. Однако токсичность ацетальдегида намного ниже, чем у формальдегида, например, потому что ацетальдегид в организме быстро окисляется до безвредной уксусной кислоты. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Кроме того, этаналь образуется при термической обработке полимеров и пластиков.[23]
При длительном контакте с воздухом могут образоваться перекиси, и произойти взрыв, который может разрушить ёмкость[24]
Санитарно-гигиенические рекомендации[24][править | править код]
- Кожа: Использование адекватной защитной одежды для предотвращения контакта с кожей.
- Глаза: Использование адекватных средств индивидуальной защиты (СИЗ) глаз
- Переодевание: При намокании (из-за пожароопасности)
- Рекомендации: Установить фонтанчики для промывки глаз, оборудовать места для быстрого переодевания
По данным[25] ПДК ацетальдегида в воздухе рабочей зоны 5 мг/м3 , в атмосферном воздухе 0,01 мг/м3 [26]В то же время, по данным[27] порог восприятия запаха этого вещества может достигать, например, 1800 мг/м3.
Врожденная непереносимость алкоголя[править | править код]
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
Примечания[править | править код]
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0001.html
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8.
- ↑ Sowin, T. J.; Melcher, L. M. «Acetaldehyde» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289
- ↑ en:Strecker amino acid synthesis
- ↑ Kendall, E. C. McKenzie, B. F. (1941), «dl-Alanine», Org. Synth.; Coll. Vol. 1: 21
- ↑ Wittig, G.; Hesse, A. (1988), «Directed Aldol Condensations: β-Phenylcinnamaldehyde», Org. Synth.; Coll. Vol. 6: 901
- ↑ Frank, R. L.; Pilgrim, F. J.; Riener, E. F. (1963), «5-Ethyl-2-Methylpyridine», Org. Synth.; Coll. Vol. 4: 451
- ↑ Adkins, H.; Nissen, B. H. (1941), «Acetal», Org. Synth.; Coll. Vol. 1: 1
- ↑ en:Monsanto process
- ↑ en:Cativa process
- ↑ NAD+ to NADH Hipolito, L.; Sanchez, M. J.; Polache, A.; Granero, L. Brain metabolism of ethanol and alcoholism: An update. Curr. Drug Metab. 2007, 8, 716—727
- ↑ Study Points to Acetaldehyde-Nicotine Combination in Adolescent Addiction. Дата обращения: 10 апреля 2010. Архивировано из оригинала 25 августа 2009 года.
- ↑ Nicotine’s addictive hold increases when combined with other tobacco smoke chemicals, UCI study finds Архивировано 9 февраля 2011 года.
- ↑ «Mitochondrial ALDH2 Deficiency as an Oxidative Stress». Annals of the New York Academy of Sciences 1011: 36-44. April 2004. doi:10.1196/annals.1293.004. PMID 15126281. Retrieved 2009-08-13.
- ↑ Nakamura, K.; Iwahashi, K.; Furukawa, A.; Ameno, K.; Kinoshita, H.; Ijiri, I.; Sekine, Y.; Suzuki, K.; Iwata, Y.; Minabe, Y.; Mori, N. Acetaldehyde adducts in the brain of alcoholics. Arch. Toxicol. 2003, 77, 591.
- ↑ IARC: IARC STRENGTHENS ITS FINDINGS ON SEVERAL CARCINOGENIC PERSONAL HABITS AND HOUSEHOLD EXPOSURES (Press release). International Agency for Research on Cancer (IARC). — «November 2, 2009 ‐‐ IARC has updated the cancer assessments of several personal habits and household exposures that cause cancer, including tobacco, areca nut, alcohol, and household coal smoke. The update was conducted with the advice of 30 scientists from 10 countries who met at IARC in October 2009. […] The Working Group concluded that acetaldehyde associated with alcohol consumption is carcinogenic to humans (Group 1) and confirmed the classification in Group 1 of alcohol consumption and of ethanol in alcoholic beverages.» Дата обращения: 1 августа 2014. Архивировано 16 мая 2018 года.
- ↑ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ↑ DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro. Дата обращения: 10 апреля 2010. Архивировано 23 июля 2011 года.
- ↑ ^ Nicholas S. Aberle, II, Larry Burd, Bonnie H. Zhao and Jun Ren (2004). «Acetaldehyde-induced cardiac contractile dysfunction may be alleviated by vitamin В1 but not by vitamins B6 or B12». Alcohol & Alcoholism 39 (5): 450—454. doi:10.1093/alcalc/agh085.
- ↑ Nils Homann, Felix Stickel, Inke R. König, Arne Jacobs, Klaus Junghanns, Monika Benesova, Detlef Schuppan, Susanne Himsel, Ina Zuber-Jerger, Claus Hellerbrand, Dieter Ludwig, Wolfgang H. Caselmann, Helmut K. Seitz Alcohol dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in heavy drinkers International Journal of Cancer Volume 118, Issue 8, Pages 1998—2002
- ↑ Климов А.Н., Иоффе Д.В., Будковская Н.Г. Уксусный алдегид // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1985. — Т. 26. Углекислые воды – Хлор. — 560 с. — 150 000 экз.
- ↑ Smoking. (2006). Encyclopædia Britannica. Accessed 27 Oct 2006.
- ↑ 1 2 NIOSH Pocket guide to chemical hazards / Michael E. Barsan (technical Editor). — NIOSH. — Cincinnati, Ohio, 2007. — С. 2. — 454 с. — (DHHS (NIOSH) Publication No. 2005-149). Архивная копия от 22 сентября 2017 на Wayback Machine
- ↑ (Роспотребнадзор). № 206. Ацетальдегид // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 18. — 170 с. — (Санитарные правила). Архивная копия от 12 июня 2020 на Wayback Machine
- ↑ СанПиН 1.2.3685-21 “Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания”
- ↑ Pliska V. and G. Janicek. Die Veranderungen der Wahrnehmungsschwellen – Konzentration der Riechstoffe in Einiger Homologischen Serien (нем.) // Heymans Institute of Pharmacology Archives internationales de pharmacodynamie et de thérapie. — Gent (Belgium), 1960. — Vol. 156. — S. 211-216. — ISSN 0003-9780.
Molar mass of CH3CHO = 44.05256 g/mol
Convert grams Acetaldehyde to moles
or
moles Acetaldehyde to grams
Molecular weight calculation:
12.0107 + 1.00794*3 + 12.0107 + 1.00794 + 15.9994
Percent composition by element
Element: Hydrogen
Symbol: H
Atomic Mass: 1.00794
# of Atoms: 4
Mass Percent: 9.152%
Element: Carbon
Symbol: C
Atomic Mass: 12.0107
# of Atoms: 2
Mass Percent: 54.529%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 1
Mass Percent: 36.319%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
CH3CHO
CH3CHo
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.









![{displaystyle {mathsf {C_{2}H_{2}+H_{2}O{xrightarrow[{}]{Hg^{2+},H^{+}}}CH_{3}CHO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a182f66624c2c00dce96a4b175c3d2deb68bb8f8)
![{mathsf {C_{2}H_{5}OH{xrightarrow[ {}]{Ag,^{o}C}}CH_{3}CHO+H_{2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e7aa9638121dda4cf1eb3f0f44d887d3fa91dbb)
![{mathsf {2C_{2}H_{5}OH+O_{2}{xrightarrow[ {}]{Ag,^{o}C}}2CH_{3}CHO+2H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33a80be048d2a2f469b931d82ebcfc2fe9539c5c)
