- Формула: HNO3 или HONO2
- Относительная молекулярная масса HNO3: 63.01284
- Молярная масса HNO3: 63.01284 г/моль (0.06301 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| H (водород) | 1 | 1.00794 | 1.00794 |
| N (азот) | 1 | 14.0067 | 14.0067 |
| O (кислород) | 3 | 15.9994 | 47.9982 |
| 63.01284 |
Расчёт молярной и относительной молекулярной массы HNO3
- Mr[HNO3] = Ar[H] + Ar[N] + Ar[O] * 3 = 1.00794 + 14.0067 + 15.9994 * 3 = 63.01284
- Молярная масса (в кг/моль) = Mr[HNO3] : 1000 = 63.01284 : 1000 = 0.06301 кг/моль
Расчёт массовых долей элементов в HNO3
- Массовая доля водорода (H) = 1.00794 : 63.01284 * 100 = 1.6 %
- Массовая доля азота (N) = 14.0067 : 63.01284 * 100 = 22.228 %
- Массовая доля кислорода (O) = 47.9982 : 63.01284 * 100 = 76.172 %
Калькулятор массы
Эта статья включает описание термина «Меланж»; см. также другие значения.
| Азотная кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Традиционные названия | азотная кислота | |
| Хим. формула | HNO3 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 63,012 г/моль | |
| Плотность | 1,513 г/см³ | |
| Энергия ионизации | 11,95 ± 0,01 эВ[2] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −41,59 °C | |
| • кипения | +82,6 °C | |
| • разложения | +260 °C | |
| Мол. теплоёмк. | 109,9 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −174,1 кДж/моль | |
| • плавления | 10,47 кДж/моль | |
| • кипения | 39,1 кДж/моль | |
| • растворения | −33,68 кДж/моль | |
| Давление пара | 56 гПА | |
| Химические свойства | ||
Константа диссоциации кислоты  |
−1,64 [1] | |
| Растворимость | ||
| • в воде | Растворима | |
| Оптические свойства | ||
| Показатель преломления | 1,397 | |
| Структура | ||
| Дипольный момент | 2,17 ± 0,02 Д | |
| Классификация | ||
| Рег. номер CAS | 7697-37-2 | |
| PubChem | 944 | |
| Рег. номер EINECS | 231-714-2 | |
| SMILES |
O[N+](=O)[O-] |
|
| InChI |
InChI=1S/HNO3/c2-1(3)4/h(H,2,3,4) GRYLNZFGIOXLOG-UHFFFAOYSA-N |
|
| RTECS | QU5775000 | |
| ChEBI | 48107 | |
| Номер ООН | 2031 | |
| ChemSpider | 919 | |
| Безопасность | ||
| ЛД50 | 430 мг/кг | |
| Токсичность | 3 класс (умеренноопасная) | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 4 0 COR |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Азо́тная кислота́ (химическая формула — HNO3), — сильная химическая неорганическая кислота, отвечающая высшей степени окисления азота (+5). Ядовита.
При стандартных условиях азотная кислота — это одноосновная кислота, в чистом виде — бесцветная жидкость с резким удушливым запахом. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип 120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Азотная кислота не является канцерогеном, однако пары сильных неорганических кислот, к которым относится азотная, могут провоцировать рак. Она, а также её соли – нитраты являются сильными окислителями.
Исторические сведения[править | править код]
Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по-видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру.
Во времена М. В. Ломоносова и вплоть до середины XX века азотная кислота в обиходе именовалась крепкой водкой[3].
Физические и физико-химические свойства[править | править код]
Плотность раствора азотной кислоты в зависимости от концентрации
Фазовая диаграмма водного раствора азотной кислоты
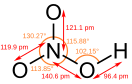
Азот в азотной кислоте имеет степень окисления +5.
Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95—0,98 называют «дымящей азотной кислотой», с массовой долей 0,6—0,7 — концентрированной азотной кислотой.
С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см3, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- моногидрат HNO3·H2O, Tпл = −37,62 °C;
- тригидрат HNO3·3H2O, Tпл = −18,47 °C.
Твёрдая азотная кислота образует две кристаллические модификации:
- моноклинная сингония, пространственная группа P 21/a, параметры ячейки a = 1,623 нм, b = 0,857 нм, c = 0,631 нм, β = 90°, Z = 16;
- ромбическая
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, параметры ячейки a = 0,631 нм, b = 0,869 нм, c = 0,544 нм, Z = 4.
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
где d — плотность в г/см3, c — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства[править | править код]
1. Высококонцентрированная HNO3 имеет бурую окраску вследствие происходящего на свету процесса разложения:
2. При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
3. Золото, платина, иридий, родий и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
4. HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
5. При кипении или под действием света азотная кислота частично разлагается:
6. Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в электрохимическом ряду напряжений левее водорода:
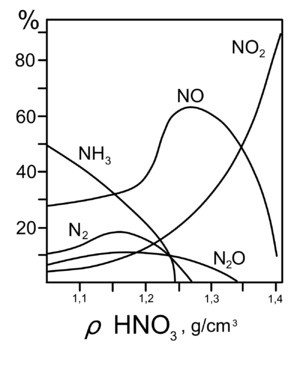
Все приведённые выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
7. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты
увеличение активности металла
Продукты, полученные при взаимодействии железа с HNO3, разной концентрации
8. С золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причём в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
9. Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
10. Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
11. Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
12. Смесь трёх объёмов соляной кислоты и одного объёма азотной называется «царской водкой». При комнатной температуре в реакции устанавливается равновесие. Оно смещается вправо при нагревании. Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила, который тоже разлагается и выделяет хлор:


Итого:

Эта же реакция также идёт с бромоводородной кислотой:

13. Взаимодействие концентрированных азотной и соляной кислот с благородными металлами:
14. Азотная кислота, растворяясь в воде, частично и обратимо с ней реагирует с образованием ортоазотной кислоты, которая не существует в свободном виде:
Нитраты[править | править код]
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
1. Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий):
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий):
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
2. Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твёрдом состоянии являются сильными окислителями, например, при сплавлении твёрдых веществ:
3. Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
4. С азотной кислотой не реагируют стекло, фторопласт-4.
5. Нитраты металлов при спекании с оксидами металлов образуют соли ортоазотной кислоты — ортонитраты.
Промышленное производство, применение и действие на организм[править | править код]
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты[править | править код]
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой:
Все три реакции — экзотермические, первая — необратимая, остальные — обратимые[4]. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется[5].
В России масштабное производство азотной кислоты (10000 тонн в год) по этому методу началось в 1917 г. в Юзовке, сырьём служил аммиак из коксового газа по способу И. И. Андреева.[источник не указан 797 дней]
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
Дымящую кислоту высокой концентрации можно получить действием концентрированной хлорной кислоты на аммиак:

Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Применение[править | править код]
- Пищевая промышленность – разбавленная – безразборная мойка оборудования (трубы, насосы, теплообменники, емкости и прочее);
- Производство минеральных удобрений;
- Военная промышленность (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
- Плёночная фотография (крайне редко) — разбавленная — подкисление некоторых тонирующих растворов[6];
- Станковая графика — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише);
- Производство красителей и лекарств (нитроглицерин);
- Ювелирное дело — основной способ определения золота в золотом сплаве;
- Основной органический синтез (нитроалканы, анилин, нитроцеллюлоза, тротил)
Действие на организм[править | править код]
Азотная кислота ядовита. По степени воздействия на организм относится к веществам 3-го класса опасности.
Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3[7].
Рейтинг NFPA 704 для концентрированной азотной кислоты:
- Опасность для здоровья: 4
- Огнеопасность: 0
- Нестабильность: 0
- Специальное: СOR[8]
Юникод[править | править код]
В Юникоде есть алхимический символ азотной кислоты (лат. Aqua fortis).
| Графема | Unicode | HTML | |||
|---|---|---|---|---|---|
| Код | Название | Шестнадцатеричное | Десятичное | Мнемоника | |
| 🜅 | U+1F705 | ALCHEMICAL SYMBOL FOR AQUAFORTIS | 🜅
|
🜅
|
— |
См. также[править | править код]
- Красная дымящая азотная кислота
Примечания[править | править код]
- ↑ Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.,Л.: Химия, 1965. — Т. 3. — 1008 с.
- ↑ http://www.cdc.gov/niosh/npg/npgd0447.html
- ↑ Крепкая водка // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.;
Крепкая водка // Корзинка — Кукунор. — М. : Советская энциклопедия, 1953. — С. 337. — (Большая советская энциклопедия : [в 51 т.] / гл. ред. Б. А. Введенский ; 1949—1958, т. 23). - ↑ Ходаков, 1976, pp. 43,60—61.
- ↑ Ходаков, 1976, p. 61.
- ↑ Азотная кислота // Фотокинотехника: Энциклопедия / Гл. ред. Е. А. Иофис. — М.: Советская энциклопедия, 1981. — 447 с.
- ↑ Межгосударственный стандарт ГОСТ 12.1.005-88, Приложение 2, стр. 1
- ↑ Fisher Scientific.
Литература[править | править код]
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — 2 350 000 экз.
- Энциклопедический словарь юного химика, Сост. В. А. Крицман, В. В. Станцо. — 2-е издание, М., 1990.
- Ахметов Н. С. Общая и неорганическая химия. М.: Высшая школа, 2001.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Ссылки[править | править код]
- Азотная кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Nitric Acid 65—67% (англ.). fishersci.com. Fisher Scientific. Дата обращения: 13 апреля 2018. Архивировано из оригинала 14 апреля 2018 года.
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Innana
Ученик
(82),
закрыт
10 лет назад
Дополнен 12 лет назад
нина казакова, молярную, а не молекулярную!!!
Лучший ответ
Нина Казакова
Профи
(676)
12 лет назад
Прикалываешься? Сложить атомную массу всех входящих в формулу элементов. 1(Н) +14(N)+3*16(О)
Остальные ответы
Илона Козеева
Мыслитель
(6088)
12 лет назад
А чем по-твоему молярная масса от молекулярной отличается? Они численно равны. Только одно в г/моль выражается а другое в а. е. м.
Ответ: 1+14+48 =63 г/моль
Похожие вопросы
Random converter
азотная кислота: состав и молярная масса
Химическая формула
Молярная масса HNO3, азотная кислота 63.01284 г/моль
1,00794+14,0067+15,9994·3
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Hydrogenium | H | 1.00794 | 1 | 1.600% |
| Nitrogenium | N | 14.0067 | 1 | 22.229% |
| Oxygenium | O | 15.9994 | 3 | 76.173% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube


























![{displaystyle {mathsf {Au+HNO_{3}+4HCllongrightarrow H[AuCl_{4}]+NO!uparrow +2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3eadbe6c1df77fa81eb7894d4fe09676f777b00f)
![{displaystyle {mathsf {3Pt+4HNO_{3}+18HCllongrightarrow 3H_{2}[PtCl_{6}]+4NO!uparrow +8H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5653feb657212947eabe111fb5a3f088b6784e1)






![{displaystyle {mathsf {3KNO_{3}+8Al+5KOH+18H_{2}Orightarrow 3NH_{3}!uparrow +8K[Al(OH)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da95a956b1a1ca224fd6ccc1aebfe350ee00b92)




![{displaystyle {mathsf {4KNO_{3}+2FeSO_{4}cdot 7H_{2}O {xrightarrow[{}]{^{o}t}} Fe_{2}O_{3}+2K_{2}SO_{4}+2HNO_{3}!uparrow +2NO_{2}!uparrow +6H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/baeb565aa36a62ad30cb68548257ee31842803ce)
![{displaystyle {mathsf {KNO_{3}+H_{2}SO_{4} {xrightarrow[{}]{^{o}t}} KHSO_{4}+HNO_{3}!uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d0161f8fd2dec5348f745f0c5373433e01085a4d)

