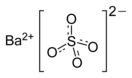
- Формула: BaO4S или BaSO4
- Относительная молекулярная масса BaO4S: 233.3896
- Молярная масса BaO4S: 233.3896 г/моль (0.23339 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Ba (барий) | 1 | 137.327 | 137.327 |
| O (кислород) | 4 | 15.9994 | 63.9976 |
| S (сера) | 1 | 32.065 | 32.065 |
| 233.3896 |
Расчёт молярной и относительной молекулярной массы BaO4S
- Mr[BaO4S] = Ar[Ba] + Ar[O] * 4 + Ar[S] = 137.327 + 15.9994 * 4 + 32.065 = 233.3896
- Молярная масса (в кг/моль) = Mr[BaO4S] : 1000 = 233.3896 : 1000 = 0.23339 кг/моль
Расчёт массовых долей элементов в BaO4S
- Массовая доля бария (Ba) = 137.327 : 233.3896 * 100 = 58.84 %
- Массовая доля кислорода (O) = 63.9976 : 233.3896 * 100 = 27.421 %
- Массовая доля серы (S) = 32.065 : 233.3896 * 100 = 13.739 %
Калькулятор массы
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 февраля 2022 года; проверки требуют 11 правок.
| Сульфат бария | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Сульфат бария | |
| Хим. формула | BaSO4 | |
| Рац. формула | BaSO4 | |
| Физические свойства | ||
| Состояние | твёрдый | |
| Молярная масса | 233.43 г/моль | |
| Плотность | 4.5 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 2876°F (1580°C) | |
| • разложения | 2912±1°F (1600°C) | |
| Давление пара | 0 ± 1 мм рт.ст.[1] | |
| Химические свойства | ||
| Растворимость | ||
| • в воде |
0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
|
| Классификация | ||
| Рег. номер CAS | 7727-43-7 | |
| PubChem | 24414 | |
| Рег. номер EINECS | 231-784-4 | |
| SMILES |
[O-]S(=O)(=O)[O-].[Ba+2] |
|
| InChI |
InChI=1S/Ba.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 TZCXTZWJZNENPQ-UHFFFAOYSA-L |
|
| RTECS | CR0600000 | |
| ChEBI | 133326 | |
| ChemSpider | 22823 | |
| Безопасность | ||
| Токсичность | не токсичен | |
| NFPA 704 |
0 0 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Сульфа́т ба́рия (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Получение[править | править код]
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжёлого шпата, при этом исходное сырьё измельчается и декантируется.
Свойства[править | править код]
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C)[уточнить] и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Коэффициент преломления коллоидной частицы (дисперсной фазы) n = 1,63[].
Химические свойства[править | править код]
Токсичность[править | править код]
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества. Однако стоит учесть, что в медицине используется фармакопейный сульфат бария, в котором гарантируется отсутствие токсичных примесей и возбудителей инфекций[3]. Промышленный сульфат бария может содержать токсичные для человека примеси. Применение сульфата бария, кустарно приготовленного из токсичного карбоната бария, послужило причиной человеческих жертв в инциденте с Целобаром[en] в Бразилии[4]. Следственный комитет Российской Федерации связывает смерти 7 пациентов в Санкт-Петербурге в период с декабря 2021 по январь 2022 с использованием при рентгенографии желудка промышленного сульфата бария[5].
Применение[править | править код]
Аналитическая химия[править | править код]
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество[править | править код]
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 % (массовая доля бария в BaSO4).
Пигмент-наполнитель[править | править код]
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. blanc fixe).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения[править | править код]
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов. См., например, баритаж.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров.
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).[6]
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
- В качестве белого пигмента при производстве бумаги.
Примечания[править | править код]
- ↑ http://www.cdc.gov/niosh/npg/npgd0047.html
- ↑ Н. С. Фрумина, Н. Н. Горюнова, С. Н. Еременко. Аналитическая химия бария. — Москва: Наука, 1977.
- ↑ ФС.2.2.0001.15 Бария сульфат Архивная копия от 14 февраля 2022 на Wayback Machine — Pharmacopoeia.ru — сайт о регистрации лекарственных средств в России.
- ↑ Caso Celobar: diretores do laboratório fabricante do medicamento são condenados. Court Sentence Summary Архивная копия от 21 июля 2011 на Wayback Machine (in Portuguese) by JusBrasil Notícias Jurídicas, extracted from the Rio de Janeiro Court of Justice proceedings of January 30, 2009. Accessed on 2009-06-30.
- ↑ Проверка выявила смерть еще четырех пациентов после рентгена желудка в Петербурге. Таким образом число погибших увеличилось до семи Архивная копия от 5 февраля 2022 на Wayback Machine — ТАСС 2022
- ↑ Peter Eio, president of Lego Systems, Inc. To the Editor (англ.) // The New England Journal of Medicine. — Massachusetts Medical Society, 1996. — Vol. 334, no. 6. — P. 407. — ISSN 0028-4793. Архивировано 28 октября 2016 года.
Литература[править | править код]
- Учебник общей химии Некрасов Б. В. 1981 год, в 2 томах.
Ссылки[править | править код]
- Характеристики сульфата бария (аккумуляторного)
- Сульфат бария на медицинской энциклопедии (недоступная ссылка)
Random converter
сульфат бария: состав и молярная масса
Химическая формула
Молярная масса BaSO4, сульфат бария 233.3896 г/моль
137,327+32,065+15,9994·4
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Barium | Ba | 137.327 | 1 | 58.841% |
| Sulfur | S | 32.065 | 1 | 13.739% |
| Oxygenium | O | 15.9994 | 4 | 27.421% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
Многие задачи в химии связаны с вычислением молярной массы вещества, с которым проводятся опыты. В статье рассмотрим один из примеров таких задач и найдем, чему равна молярная масса сульфата бария. Также рассмотрим, в каких областях человеческой деятельности используется это вещество.
Что такое сульфат бария?

Прежде чем рассматривать вопрос молярной массы сульфата бария, познакомимся поближе с этим веществом. Оно, с химической точки зрения, представляет собой соль, образованную сульфат-анионом и катионом бария. Его формулу можно записать следующим образом: BaSO4.

Сульфат бария является белым порошком, который обладает высокой химической инертностью. Так, он не только не растворяется в воде, но и не реагирует со многими щелочами и кислотами. Растворяется он только в концентрированной серной кислоте, а также восстанавливается до оксида бария при нагреве выше 1600 oC.
В природе сульфат бария встречается во многих рудах этого металла, например, он является основным веществом минерала барит.
Благодаря своему белому цвету и химической инертности, эта соль применяется в качестве специальной “каши”, которую употребляет в пищу пациент во время рентгеновского исследования желудка (тяжелые атомы бария хорошо поглощают рентгеновские лучи), а также используется при производстве белых красителей в пластмассах.
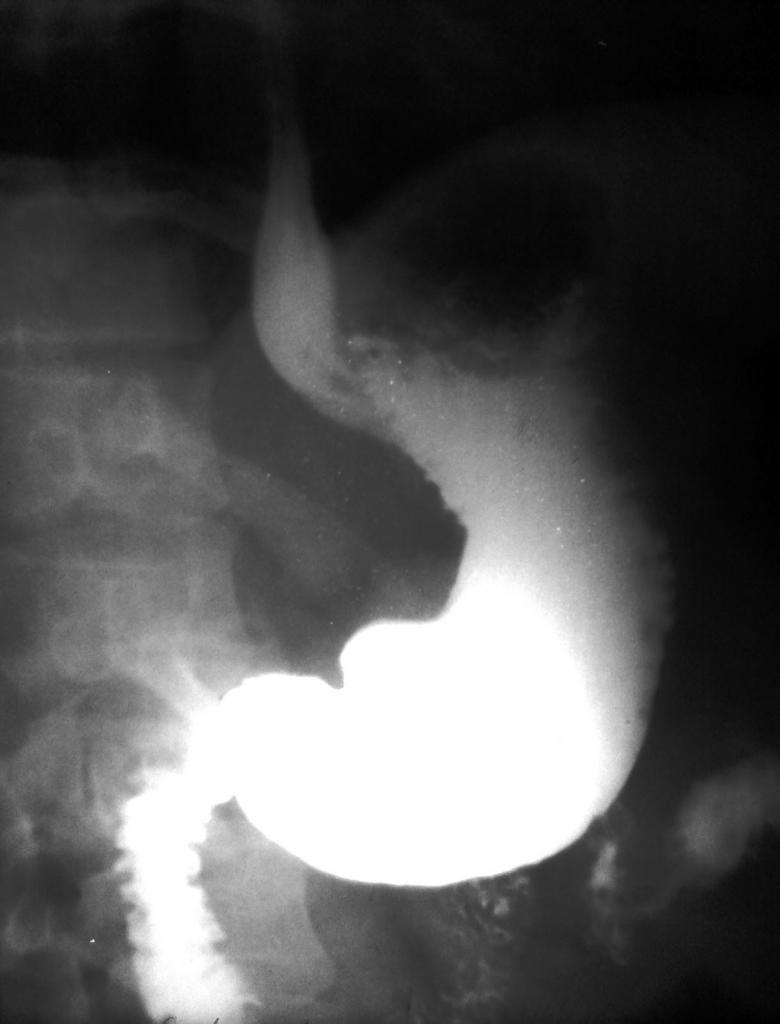
Любопытно отметить, что почти все соли бария являются ядовитыми и при попадании в организм вызывают сильные отравления. Сульфат бария в этом плане безвреден благодаря его нерастворимости в кислой среде нашего желудка.
Понятие о молярной массе
Прежде чем ответить на вопрос о том, что такое молярная масса сульфата бария, необходимо разобраться с этим понятием. Молярная масса представляет собой отношение массы вещества к количеству молей этого вещества, то есть массу одного моля вещества
Слово “моль” является одной из семи основных или базовых единиц измерения в системе СИ, которая была добавлена в нее в 1971 году. Эта величина означает количество элементов, которое составляет рассматриваемый материал. Это могут быть атомы, молекулы, ионы, электроны, в общем случае любые частицы, на которые можно разделить объект. Значение 1 моль принято считать равным числу Авогадро (NA = 6.022 * 1023). Откуда взялось это число? Все просто, оно точно соответствует числу атомов в 2 граммах газообразного водорода (H2), то есть 1 грамм атомарного водорода (H) так же будет содержать 1 моль частиц.
Использование этой единицы в физике и химии является удобным, ввиду малых размеров атомов и молекул и их большого количества.
Как рассчитать молярную массу сульфата бария?
Теперь, когда разобрано понятие молярной массы, можно переходить непосредственно к теме статьи. Как можно понять из предыдущего пункта, чтобы рассчитать массу 1 моль рассматриваемой соли, необходимо знать, сколько весит одна ее молекула, то есть BaSO4.
Согласно химической формуле, рассматриваемая молекула состоит из одного атома бария, одного атома серы и четырех атомов кислорода. Идея расчета ее массы заключается в суммировании атомных масс соответствующих элементов. Необходимые данные можно найти в периодической системе Д. И. Менделеева.
Использование таблицы Менделеева: атомные молярные массы
Если обратиться к периодической системе химических элементов, то можно увидеть, что в каждой клетке, представляющей химический элемент, приводится информация о заряде ядра его атома (порядковый номер), конфигурация внешних электронных оболочек, а также некоторое число, которое отражает молярную массу атомов соответствующего элемента.
Из таблицы получаем необходимые молярные массы:
- M(Ba): 137,327;
- M(S): 32,065;
- M(O): 15,999.
Все приведенные значения имеют размерность грамм на моль (г/моль). Отметим, что эти цифры являются усредненным значением между массами разных изотопов одного химического элемента, ядра атомов которого содержат постоянное количество протонов, но число нейтронов может изменяться. Так, барий в действительности является смесью из 6 изотопов, которые могут считаться относительно стабильными, поскольку имеют большие значения периодов полураспада.
Полученные из таблицы Менделеева значения для отдельных атомов можно использовать, чтобы определить, чему равна молярная масса сульфата бария.
Молярная масса BaSO4
Чтобы рассчитать молярную массу сульфата бария 2 (цифра указывает валентность, которую проявляет атом металла в химическом соединении), необходимо сложить соответствующие величины для каждого элемента, учитывая их количество в рассматриваемой молекуле соли. Так, соединение BaSO4 образовано 6-тью атомами: по одному атому Ba и S и 4 атома O. Молярная масса соединения равна: M(BaSO4) = 1 * M(Ba) + 1 * M(S) + 4 * M(O) = 1 * 137,327 + 1 * 32,065 + 4 * 15,999 = 233,388 г/моль.
Справедливости ради следует отметить, что образование устойчивых химических соединений из отдельных атомов сопровождается выделением некоторого количества энергии. Согласно же уравнению Эйнштейна (E = m*c2), потеря энергии эквивалентна потери массы. Поэтому в действительности молярная масса соединения BaSO4 будет иметь меньшее значение, чем посчитанная величина, однако, эта поправка настолько незначительна, что ей пренебрегают.
Рассмотренный на примере сульфата бария способ расчета молярной массы можно применять абсолютно к любым соединениям. Для этого лишь важно знать их химические формулы.