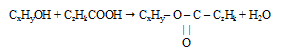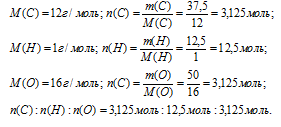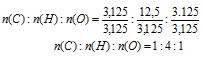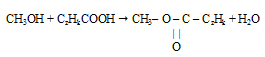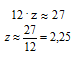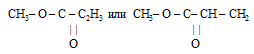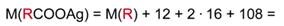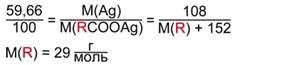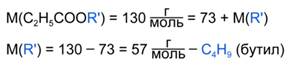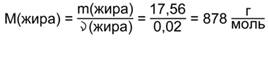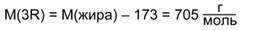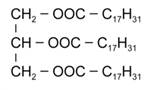Random converter
диэтиловый эфир: состав и молярная масса
Химическая формула
Молярная масса (C2H5)2O, диэтиловый эфир 74.1216 г/моль
(12,0107·2+1,00794·5)·2+15,9994
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Carboneum | C | 12.0107 | 4 | 64.817% |
| Hydrogenium | H | 1.00794 | 10 | 13.599% |
| Oxygenium | O | 15.9994 | 1 | 21.586% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
ПОМОГИТЕ!Какова молярная масса ЭФИРА??
Александр Бичевой
Знаток
(282),
на голосовании
11 лет назад
Голосование за лучший ответ
Янка
Мудрец
(18563)
11 лет назад
какого именно эфира?? ? если не знаете формулы, то хотя бы название эфира укажите.
Похожие вопросы
Метод определения простейшей формулы эфира
Некоторые задачи в тестах ЕГЭ представляют собой комбинацию двух более простых задач. Рассмотрим такой пример.
Задача 2.8.
При взаимодействии одноатомного спирта, содержащего 37,5% углерода и 50% кислорода, с органической кислотой образуется вещество, плотность паров которого по аргону равна 2,15. Определите молекулярную формулу образующегося вещества.
Дано:
массовая доля углерода в спирте: 
массовая доля кислорода в спирте: 
относительная плотность паров эфира по аргону: D(Аr) = 2,15.
Найти: молекулярную формулу эфира.
Решение:
Данная задача представляет собой комбинацию двух более простых задач. В первой из них требуется узнать формулу спирта по значениям массовых долей элементов в нем. Во второй части требуется выявить формулу эфира по его молярной массе. Рассмотрим ход решения более подробно.
Шаг 1. Очевидно, что при взаимодействии одноатомного спирта с органической кислотой образуется сложный эфир. Если предположить, что в реакции участвовала карбоновая кислота, то в состав образовавшегося сложного эфира входят углерод, водород и кислород.
Шаг 2. Для составления уравнения реакции необходимо определить формулы спирта и кислоты. В условии указано, что спирт был одноатомным, следовательно, в его состав входил лишь один атом кислорода. Соотношение атомов углерода и водорода в углеводородном радикале нам неизвестно. Поэтому формулу спирта обозначим как СxHyOH.
В отношении карбоновой кислоты в условии нет никакой информации, но небольшое значение молярной массы эфира, рассчитанное по относительной плотности его паров позволяет утверждать, что она была одноосновная. Обозначим ее формулу как СzHkCOOH.
Запишем реакцию этерификации:
Шаг 3. По значениям массовых долей элементов определим соотношение атомов в молекуле спирта.
Сначала определим массовую долю водорода. Так как в состав спирта входит только углерод, кислород и водород, сумма их массовых долей составит 100% :






Теперь необходимо произвольно выбрать некоторый образец, в котором мы будем определять соотношение количеств веществ элементов. В условии указана информация о массовой доле, поэтому удобно выбрать образец массой 100 г. В этом случае числовые значения массовой доли каждого элемента совпадут с его массой в этом стограммовом образце.
Итак, в 100 г искомого вещества содержится 37,5 г углерода, 12,5 г водорода и 50 г кислорода.
Далее вычислим соотношение количеств вещества (n) углерода, водорода и кислорода.
Шаг 4. Находим простейшую формулу.
n(С): n(H) : n(О) = 3,125 : 12,5 : 3,125
Выбираем наименьшее значение (в данном случае «3,125») и делим на него все три числа:
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: СН4О.
Шаг 5. В условии есть указание на одноатомность спирта. Это значит, что его молекула содержит только один атом кислорода. Следовательно, индексы в простейшей формуле увеличивать не надо, она совпадает с истинной. Запишем истинную формулу спирта, выделив в ней гидроксильную группу: СН3ОН.
с учетом найденной формулы спирта будет иметь следующий вид:
По относительной плотности паров по аргону определяем истинную молярную массу эфира:
М(эфира) = D(Аr) . M(Аr) = 2,15 . 40 = 86 г/моль.
Определим вклад в общую молярную массу углеводородного радикала – остатка от карбоновой кислоты:
М(СzHk) = 86 – (12 + 1 . 3 + 16 . 2 + 12) = 27 г/моль.
По значениям молярных масс элементов составляем математическое уравнение с двумя неизвестными:
12 . z + 1 . k = 27
Пренебрегая вкладом массы водорода в общую массу, получаем математическое уравнение, позволяющее оценить количество атомов углерода в молекуле:
Если количество атомов углерода в углеводородном радикале равно 2, то подставляя z = 2 в математическое уравнение с двумя неизвестными получаем:
12 . 2 + 1 . k = 27
k = 8.
Следовательно, углеводородный радикал оставшейся в молекуле эфира от карбоновой кислоты имеет формулу: С2Н3.
Формула эфира для формирования ответа будет иметь вид:
Примеры задач по химии сложных эфиров и жиров
Задача 1
Условие задачи.
Какие исходные кислоты и спирты необходимо взять для синтеза сложных эфиров этилбензоата (с запахом мяты) и бензилацетата (с запахом жасмина)?
Решение
1. Вспомните, как образуется название сложного эфира.
Ответ: сначала указывают название радикала – остатка от спирта, а затем название кислотного остатка.
2. Определим исходные вещества для синтеза этилбензоата и бензилацетата.
«Этил» – остаток этилового спирта, «бензоат» – остаток бензойной кислоты. Следовательно, этилбензоат образуется из бензойной кислоты и этилового спирта. «Бензил» – остаток бензилового спирта, «ацетат» – остаток уксусной кислоты.
Формулы сложных эфиров представлены на рисунке 1.
Рис. 1. Формулы и исходные вещества для синтеза этилбензоата и бензилацетата
Приведенные сложные эфиры между собой являются изомерами, их состав соответствует формуле С9Н10О2 (Рис. 2).
Рис. 2. Изомерные сложные эфиры
Задача 2
Условие задачи
При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если: а)серебряная соль кислоты А содержит 59,66 % серебра, б) спирт Б не окисляется дихроматом калия.
Решение
1. Предположим, что кислота, образующая сложный эфир, одноосновна. Но если задача не будет решена таким образом, то придется рассматривать случаи двух-, трехосновной кислот и так далее.
2. Запишем формулу серебряной соли и рассчитаем молярную массу углеводородного радикала R в кислоте.
RCOOAg – формула серебряной соли кислоты А.
Зная молярные массы серебра, углерода и кислорода, выразим молярную массу RCOOAg:
Известно, что серебро составляет 59,66 % от массы всей соли. Составим пропорцию:
59,66 % – 108 г/моль
100 % – (M(R) + 152) г/моль
Произведем соответствующие вычисления и найдем молярную массу R:
Такая молярная масса соответствует радикалу этилу – С2Н5. Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Зная молярную массу эфира С2Н5СООR, можно найти молярную массу радикала R:
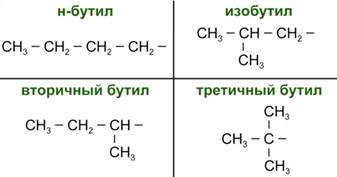
Молярной массе 57 г/моль соответствуют 4 изомерных радикала (Рис. 3).
Рис. 3. Изомеры состава -С4Н9
В условии задачи сказано, что спирт Б не окисляется дихроматом калия, следовательно, этот спирт является третичным.
Таким образом, исходный сложный эфир образован пропановой кислотой и третбутиловым спиртом:
Задача 3
Условие задачи
Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное.
Установите возможную формулу жира.
Решение
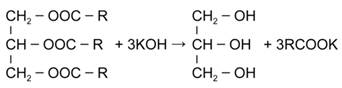
Запишем в общем виде уравнение гидролиза жира:
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия.
Найдем количество вещества гидроксида калия и жира (количество жира втрое меньше):
Зная количество и массу жира, можно найти его молярную массу:
На три углеводородных радикала R кислот приходится 705 г/моль:
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:
Возможная формула жира представлена на рисунке 4.
Рис. 4. Формула жира
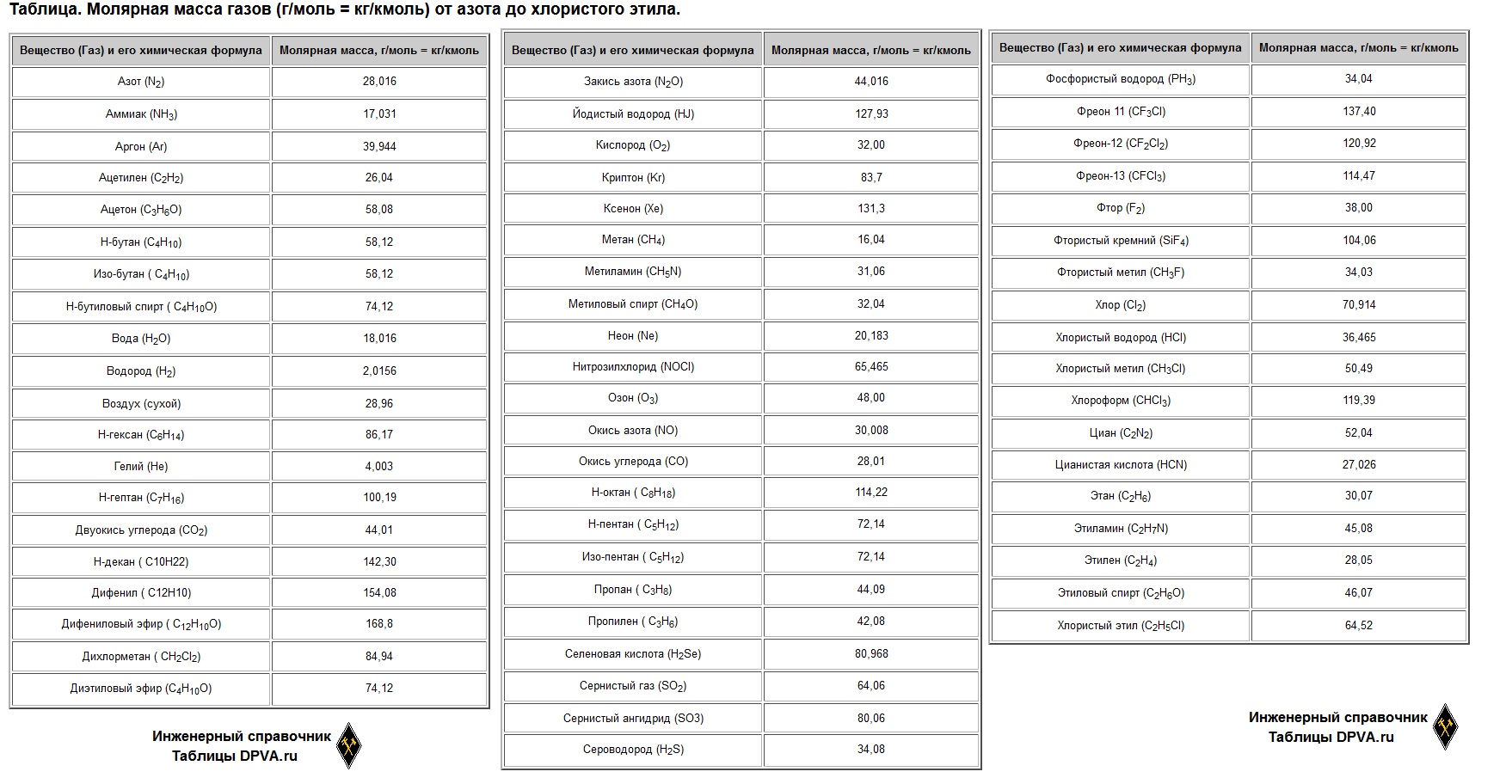
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Азот (N2) | 28,016 |
| Аммиак (NH3) | 17,031 |
| Аргон (Ar) | 39,944 |
| Ацетилен (C2H2) | 26,04 |
| Ацетон (C3H6O) | 58,08 |
| Н-бутан (C4H10) | 58,12 |
| Изо-бутан ( C4H10) | 58,12 |
| Н-бутиловый спирт ( C4H10O) | 74,12 |
| Вода (H2O) | 18,016 |
| Водород (H2) | 2,0156 |
| Воздух (сухой) | 28,96 |
| Н-гексан (C6H14) | 86,17 |
| Гелий (He) | 4,003 |
| Н-гептан (C7H16) | 100,19 |
| Двуокись углерода (CO2) | 44,01 |
| Н-декан ( C10H22) | 142,30 |
| Дифенил ( C12H10) | 154,08 |
| Дифениловый эфир ( C12H10O) | 168,8 |
| Дихлорметан ( CH2Cl2) | 84,94 |
| Диэтиловый эфир (C4H10O) | 74,12 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Закись азота (N2O) | 44,016 |
| Йодистый водород (HJ) | 127,93 |
| Кислород (O2) | 32,00 |
| Криптон (Kr) | 83,7 |
| Ксенон (Xe) | 131,3 |
| Метан (CH4) | 16,04 |
| Метиламин (CH5N) | 31,06 |
| Метиловый спирт (CH4O) | 32,04 |
| Неон (Ne) | 20,183 |
| Нитрозилхлорид (NOCl) | 65,465 |
| Озон (O3) | 48,00 |
| Окись азота (NO) | 30,008 |
| Окись углерода (CO) | 28,01 |
| Н-октан ( C8H18) | 114,22 |
| Н-пентан ( C5H12) | 72,14 |
| Изо-пентан ( C5H12) | 72,14 |
| Пропан ( C3H8) | 44,09 |
| Пропилен ( C3H6) | 42,08 |
| Селеновая кислота (H2Se) | 80,968 |
| Сернистый газ (SO2) | 64,06 |
| Сернистый ангидрид (SO3) | 80,06 |
| Сероводород (H2S) | 34,08 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Фосфористый водород (PH3) | 34,04 |
| Фреон 11 (CF3CI) | 137,40 |
| Фреон-12 (CF2CI2) | 120,92 |
| Фреон-13 (CFCI3) | 114,47 |
| Фтор (F2) | 38,00 |
| Фтористый кремний (SiF4) | 104,06 |
| Фтористый метил (CH3F) | 34,03 |
| Хлор (Cl2) | 70,914 |
| Хлористый водород (HCl) | 36,465 |
| Хлористый метил (CH3Cl) | 50,49 |
| Хлороформ (CHCl3) | 119,39 |
| Циан (C2N2) | 52,04 |
| Цианистая кислота (HCN) | 27,026 |
| Этан (C2H6) | 30,07 |
| Этиламин (C2H7N) | 45,08 |
| Этилен (C2H4) | 28,05 |
| Этиловый спирт (C2H6O) | 46,07 |
| Хлористый этил (C2H5Cl) | 64,52 |