Содержание:
Количество вещества:
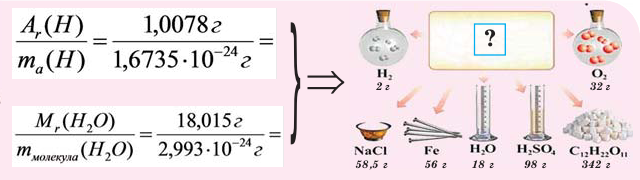
В чём разница между понятиями «масса» и «количество»
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число — 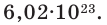
Например, в 1 моле водородного газа содержится  молекул, в 1 моле поваренной соли (NaCI)
молекул, в 1 моле поваренной соли (NaCI)  ионов натрия
ионов натрия 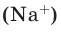 и
и  ионов хлора
ионов хлора 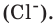
Количество частиц, содержащихся в 1 моле химических веществ (  ), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей
), называется постоянной Авогадро (Na). Постоянная Авогадро отличается от числа Авогадро тем, что измеряется определенной единицей 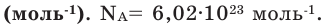
Количество вещества можно вычислить по следующей формуле:
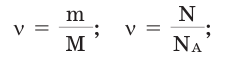
Здесь 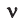 — количество вещества,
— количество вещества, 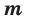 — масса, М — молярная масса, N – заданное количество молекул,
— масса, М — молярная масса, N – заданное количество молекул, 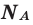 — постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
— постоянная Авогадро. Все представленные в формуле величины нам уже известны. Кроме понятия молярной массы. Давайте выясним сущность этого понятия.
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):

Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса – измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
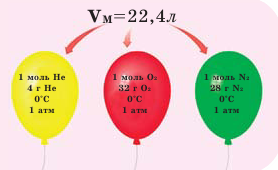
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.

Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит  молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
молекул. Согласно закону Авогадро, можно утверждать, что одинаковое число молекул в 2 г водорода, 32 г кислорода, 28 г азота, 44 г углекислого газа занимает одинаковый объём.
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 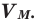 . При измерении объема газа в литрах молярный объём составит
. При измерении объема газа в литрах молярный объём составит 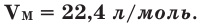 Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
Зависимость между количеством вещества и молярным объёмом газа можно выразить следующей формулой:
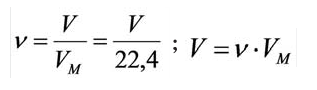
Здесь 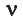 – количество вещества,
– количество вещества, 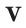 – объём газа,
– объём газа, 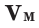 – молярный объем.
– молярный объем.
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 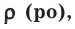 её единица
её единица
измерения – 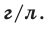
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
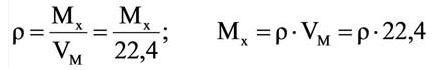
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
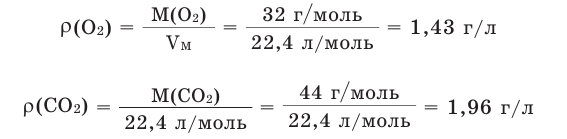
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 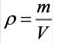 .
.
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
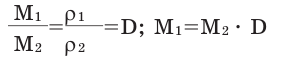
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу – водороду и воздуху:
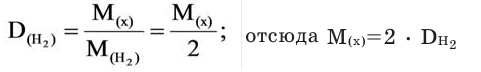
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
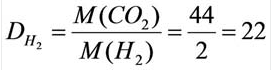
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
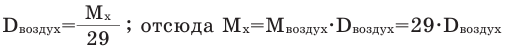
Способы вычисления средней молярной массы газовой смеси

Здесь: 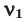 и
и 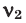 количество молей газов,
количество молей газов, 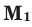 и
и 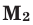 – молярные массы газов,
– молярные массы газов,  и
и 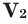 – объем газов в н.у., (
– объем газов в н.у., (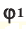 и
и 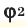 – доля газов в объеме газовой смеси.
– доля газов в объеме газовой смеси.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 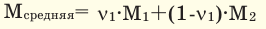 .
.
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании  и
и 
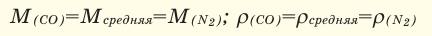
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании  и
и 
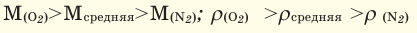
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
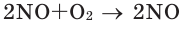 (объёмное соотношение 2:1:2)
(объёмное соотношение 2:1:2)
Численное соотношение объемов, молей и молекул газов равно друг другу.
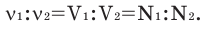
Можно производить следующие вычисления по смесям:
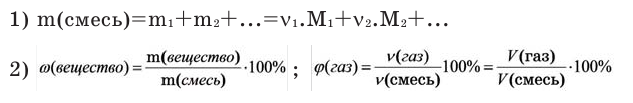
3) Массовое соотношение двух газов: 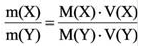
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl – хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления – 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярная масса


4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.

Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
M=m/v,
где m – масса вещества, а v – количество вещества.

Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.

Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.

Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10
-

Регина Медникова
10/10
-

Юля Владимировна
10/10
-

Ольга Королёва
8/10
-

Дима Торопов
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 875.
А какая ваша оценка?
Моля́рная ма́сса — характеристика вещества, отношение массы вещества к его количеству. Численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро. Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой, выраженной в а. е. м., и относительной молекулярной массой. Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности[1].
Например, молярная масса кислорода как элемента 


Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов. Например, молярная масса воды 
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol), но из-за того, что когда молярная масса выражена в г/моль, её численное значение совпадает с относительной молекулярной массой, исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярную массу в формулах обычно обозначают заглавной буквой 
Молярная масса некоторых веществ и смесей[править | править код]
| Элемент, вещество или смесь | Молярная масса, г/моль |
|---|---|

|
14 |

|
28 |

|
40 |

|
1 |

|
2 |

|
18 |

|
4 |
| Воздух | 29 |

|
16 |

|
32 |

|
12 |

|
44 |

|
32 |

|
7 |

|
20 |

|
108 |

|
96 |
Округлённые до целого числа молярные массы некоторых веществ и смесей приведены в таблице.
Средняя молярная масса[править | править код]
Средняя молярная масса 


так как 
Если состав вещества задан через массовые доли 
Средняя молярная масса важна для смесей газов, так как входит в термодинамические уравнения состояния газовых смесей.
Например, молярная масса воздуха 
г/моль.
Более точный расчет средней молярной массы сухого воздуха дает 28,97 г/моль[3].
Для высокомолекулярных веществ, состоящих из молекул с разной молярной массой, например, полимеров, иногда указывают среднюю молярную массу или диапазон молярных масс.
Примечания[править | править код]
- ↑ Дерябина Г. И., Кантария Г. В. 2.2. Моль, молярная масса. Органическая химия: веб-учебник. Дата обращения: 26 июня 2017. Архивировано 29 июля 2012 года.
- ↑ 1 2 Нащокин В. В. Техническая термодинамика и теплопередача. Учебное пособие для вузов. / Под ред. проф. В. С. Силецкого. — 2-е изд. — М.: Высшая школа, 1969. — Т. 3. — С. 224. — 560 с.
- ↑ The Engineering ToolBox Molecular Mass of Air Архивная копия от 4 декабря 2020 на Wayback Machine
Литература[править | править код]
Глинка Н. Л. Общая химия: Учеб. пособие для вузов /Под ред. А. И. Ермакова. — 30-е изд., испр. — М.: ИНТЕГРАЛ-ПРЕСС, 2005. — 728 с.: ил. — ISBN 5-89602-017-1.
2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
![]() ,
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
![]() или
или
![]() ,
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
![]() ,
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
![]()
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
![]() ,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
![]() или
или
для двух состояний
![]() ,
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
![]()
или
для двух состояний
![]() ,
,
г)
объединенный газовый закон (m=const)
![]() или
или
для двух состояний
![]() .
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
![]() ,
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
![]() .
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
![]() ,
,
где
т
—
масса смеси.
Концентрация молекул
![]() ,
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
![]() ,
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно – кинетической теории газов
![]() ,
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #



