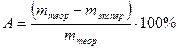В этой статье мы узнаем о том, как рассчитать молярную массу по давлению молекул газа и как ее можно рассчитать по давлению, объему, плотности и подробным фактам.
Молекула, содержащая один моль собственного вещества, называется молярной массой этого конкретного вещества. Упрощенно, это вес одного моля вещества. С помощью числа Авогардо мы можем вычислить молярную массу.
Обозначается формулой,
М=м/н, Где m молярная масса вещества в граммах, m это масса вещества в грамме,n это число молей вещества.
Как рассчитать молярную массу по давлению ?
Используя уравнение идеального газа, мы можем легко вычислить молярную массу по давлению.
Это следует из уравнения идеального газа
PV = NRT
P = давление газа, V = объем газа, R = универсальная газовая постоянная, T = температура, n = количество молей газовой молекулы.
Опять же, мы знаем
n = m/M = масса / молярная масса
поэтому, подставляя значение n в приведенное выше уравнение, мы получаем
PV=(м/м)RT
Итак, M = m(RT/PV)
М α 1/П [где α — постоянная пропорциональности]
Итак, мы можем сказать, что из приведенного выше уравнения Молярная масса обратно пропорциональна давлению молекул газа. Это означает, что чем выше молярная масса газа, тем ниже будет его давление и наоборот., как рассчитать молярную массу от давления является важным фактором.
Рассчитать молярную массу по температуре
Из уравнения идеального газа можно рассчитать молярную массу по температуре.
PV = NRT
P = давление газа, V = объем газа, R = универсальная газовая постоянная, T = температура, n = количество молей газовой молекулы.
Опять же, мы знаем
n = m/M = масса / молярная масса
поэтому, подставляя значение n в приведенное выше уравнение, мы получаем,
PV=(м/м)RT
Итак, M = m(RT/PV)
М α Т [где α — постоянная пропорциональности]
Таким образом, в приведенном выше соотношении отношение между молярной массой и температурой прямо пропорционально друг другу. Таким образом, чем выше температура, тем выше будет молярная масса. как рассчитать молярную массу по давлению, здесь важный фактор, но здесь мы строим зависимость между молярной массой и температурой.
Рассчитать молярную массу по объему
Молярную массу по объему можно рассчитать с помощью уравнения идеального газа.
PV = NRT
P = давление газа, V = объем газа, R = универсальная газовая постоянная, T = температура, n = количество молей газовой молекулы.
Опять же, мы знаем
n = m/M = масса / молярная масса
поэтому, подставляя значение n в приведенное выше уравнение, мы получаем,
PV=(м/м)RT
Итак, M = m(RT/PV)
М α 1/В [где α — постоянная пропорциональности]
Итак, мы можем сказать, что из приведенного выше уравнения Молярная масса обратно пропорциональна объему газообразных молекул. Это означает, что чем выше молярная масса газа, тем меньше будет его объем, и наоборот. как рассчитать молярную массу по давлению, здесь важный фактор, но здесь мы строим зависимость между молярной массой и объемом.
Рассчитать молярную массу по плотности
Плотность равна отношению массы вещества к его объему.
Используя уравнение идеального газа, мы можем легко вычислить молярную массу по плотности.
PV = NRT
P = давление газа, V = объем газа, R = универсальная газовая постоянная, T = температура, n = количество молей газовой молекулы.
Опять же, мы знаем
n = m/M = масса / молярная масса
поэтому, подставляя значение n в приведенное выше уравнение, мы получаем,
PV=(м/м)RT
M = (м/В)(RT/P)
М=ρ(РТ/П)
Итак, M α ρ [где α — постоянная пропорциональности]
Таким образом, плотность прямо пропорциональна молярной массе газообразной молекулы. как рассчитать молярную массу от давления является важным фактором. здесь, но мы строим зависимость между молярной массой и плотностью здесь.
Рассчитать молярную массу по осмотическому давлению
Использование формулы коллигативных свойств для расчета молярной массы по осмотическому давлению.
Из коллигативного свойства
Π=iCRT
Где Π — осмотическое давление данного вещества, I = коэффициент Вант-Гоффа (это константа), C = концентрация растворенного вещества в конкретном растворе, R = универсальная газовая постоянная, t = температура.
Для газообразных молекул концентрация растворенного вещества в конкретном растворе будет преобразована в молярную массу, и мы опускаем коэффициент I, поскольку он является постоянным членом..
Теперь уравнение становится П=МРТ.
So Π α М [где α — постоянная пропорциональности]
Таким образом, осмотическое давление также прямо пропорционально молярной массе газообразной молекулы. как рассчитать молярную массу от давления является важным фактором. здесь, но мы строим зависимость между молярной массой и осмотическим давлением здесь.
Рассчитать молярную массу по давлению паров
Из коллигативного свойства мы знаем, что относительное понижение давления пара является более подходящим, чем давление пара.
Таким образом, здесь мы не только рассчитываем молярную массу по давлению, но и рассчитываем молярную массу растворенного вещества по относительному снижению давления пара.
Из закона Рауля
(P0-П)/П0 = X2……(я)
Где Р0 – давление пара чистого растворителя, а P – давление пара над раствором. Икс2 – молярная доля растворенного вещества.
И снова Х2 = п2 / (n1+n2)
Для идеального решения n1>>>н2
Таким образом, уравнение сводится к
X2=n2/n1 ………(ii)
n2=W2/M2 и н1=W1/M1
тогда уравнение (ii) принимает вид
X2=(Вт2/M2)|(М1/W1)….(iii)
Сравнивая уравнения (i) и (iii), получаем,
(W2/M2)(М1/W1)=(П0-П)/П0
M2= (Вт2/W1)M1 (P0/p0-п)
Таким образом, молярная масса прямо пропорциональна снижению давления паров летучей молекулы. как рассчитать молярную массу от давления является важным фактором. здесь, но мы строим зависимость между молярной массой и давлением пара здесь.
Часто задаваемый вопрос
Как рассчитать молярную массу по закону идеального газа?
Используя закон идеального газа PV=nRT, мы можем легко вычислить молярную массу.
Используя этот закон, мы можем рассчитать, как рассчитать молярную массу по давлению, отношению между молярной массой и давлением, молярной массой и температурой, а также молярной массой и объемом.
В чем принципиальная разница между молем и молярной массой?
Моль определяется как количество веществ, приходящееся на число Авогадро. а молярная масса равна одному молю этого вещества.
Моль определяется как n=N/NA, где НA число Авогадро, а значение равно 6.023*1023.
Сколько атомов соответствует одному молю?
Один моль равен 6.023*1023 атомов поскольку он содержит число атомов Авогадро.
Что такое молярная масса?
Молярная масса = масса вещества (в граммах)/количество молей
Итак, единицей молярной массы является грамм/ Моль.
Газовые законы и расчет молярных масс газообразных веществ
1. Уравнение Бойля-Мариотта и Гей-Люссака
;
где
V
– объем газа, измеренный при реальных
условиях, т.е. при атмосферном давлении
Р и температуре Т; V0
– объем газа при нормальном давлении
Р0
и температуре Т0.
Используют для приведения объема к
нормальным условиям.
-
Закон
Авогадро: в
равных объемах разных газов при
одинаковом давлении и температуре
содержится одинаковое число молекул.
В одном моле содержится 6,022·1023
молекул (число Авогадро).
При
нормальных
условиях
(T=
273К, p
= 101,325 кПа или 760 мм рт.ст.) моль
любого газа занимает объем 22,4 л. Теперь
несложно рассчитать молярные объемы
эквивалентов наиболее распространенных
в реакциях газов Н2
и О2.
Один моль Н2
(2г) занимает
объем 22,4 л, а один эквивалент Н2(1г)
– V л, следовательно, Vэ(Н2)
= 11,2 л/моль. Аналогичным образом
рассчитывается Vэ(О2)
= 5,6 л/моль.
3.
Молярную массу газа можно вычислить,
пользуясь уравнением Клапейрона –
Менделеева:
,
или
,
где
Р – давление, Па; V
– объем, м3;
m-
масса, г; М – молярная масса, г/моль; R
– универсальная газовая постоянная,
равная 8,314 Дж/(моль .
К); Т –
абсолютная температура, К.
4.
Из закона
Авогадро следует, что при одном и том
же давлении и температуре массы равных
объемов газов относятся как их молярные
массы:
,
или D
=
где
D
= m1/m2
–относительная
плотность D
первого газа по второму,
m1
– масса первого газа, m2
– масса второго газа.
5. Закон Дальтона (закон парциальных давлений).
Парциальным
давлением (po)
газа в
смеси называется давление, которое
производил бы этот газ, занимая при тех
же физических условиях объем всей
газовой смеси.
Согласно
закону: общее
давление смеси газов, не вступающих
друг с другом в химическое взаимодействие,
равно сумме парциальных давлений газов,
составляющих смесь.
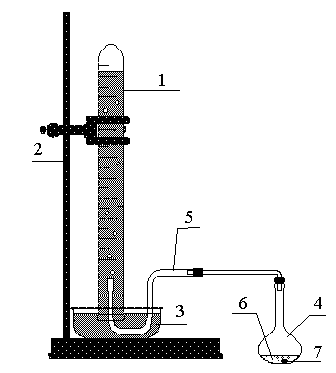
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ.
Оборудование:
эвдиометр, штатив, колба, соединительные
трубки, кристаллизатор, термометр,
барометр, соляная кислота (HCl
1:2), таблетка
цинка.
Метод основан на
измерении объема водорода, который
выделяется из кислоты при действии на
нее металла.
Zn
+ 2HCl
= ZnCl2
+ H2
ХОД РАБОТЫ:
-
Собрать установку
так, как показано на рисунке 1. Для этого:
-
в кристаллизатор
налить 1/2 объема воды; -
заполнить водой
эвдиометр и установить его в штативе
так, чтобы в него не попадал воздух;
Налить
в реакционную колбу 10-15 мл соляной
кислоты.
Взвесить
кусочек цинка и положить на горлышко
колбы, колбу закрыть пробкой с газоотводной
трубкой, проверить герметичность
системы, а затем колбу поставить в
вертикальное положение, чтобы цинк
упал в кислоту.
После
полного растворения цинка в кислоте,
измерить объем выделившегося водорода.
|
|
Рис. |
ОФОРМЛЕНИЕ РАБОТЫ:
-
Зарисовать
установку для определения молярной
массы эквивалента цинка. -
Написать
уравнение реакции. -
Записать
экспериментальные данные:
-
m
(Zn) –
масса цинка, г; -
V
– объем выделившегося водорода, дм3; -
t
oC –
комнатная температура, С; -
Т – комнатная
температура, К; -
P
– атмосферное давление по барометру
в лаборатории, кПа; -
р
–
давление насыщенного водяного пара
при данной комнатной температуре
(определить по таблице 1); -
=
P
– р
– давление водорода в эвдиометре, при
данной комнатной температуре. -
Гидростатическим
давлением водного столба пренебрегаем.
Таблица 1
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl – хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления – 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание
- Способы определения молярной массы газов
- Определение молекулярной массы газообразных веществ
- Способы определения молекулярных масс газов
Способы определения молярной массы газов
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т).
1. По закону Авогадро и следствиям из него
Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул.
Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙10 23 моль -1 ).
Следствие 2: при нормальных условиях (н.у.) (Р = 10 5 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM).
Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
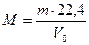 . . |
(2.3.1) |
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
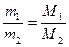 . . |
(2.3.2) |
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
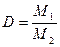 . . |
(2.3.3) |
Обычно плотность газа определяют по отношению к водороду (DH2) или воздуху ( 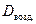
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
n 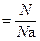 , , |
(2.3.6) |
где N – количество структурных единиц в системе;
n 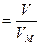 , , |
(2.3.7) |
2. По уравнению Клапейрона – Менделеева
Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1).
Источник
Определение молекулярной массы газообразных веществ



Цель работы: экспериментально определить молекулярную массу оксида углерода (IV).
Определение молярной массы газа может быть выполнено несколькими способами.
Чаще всего его определяют исходя из абсолютной и относительной плотности газов.
Абсолютной плотностью газа 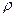
М = 22,4 ∙
Для приведения объёма, газа к нормальным условиям используют уравнение газового состояния
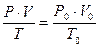
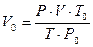
где V – объёма газа, измеренный при реальных условиях, т.е. при атмосферном давлении P и температуре Т.
Относительной плотностью D первого газа по второму называют отношение плотностей этих газов
D = 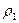
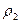
где 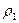
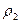
Это отношение можно заменить отношение масс газов, содержащихся в одинаковых объёмах при одинаковой температуре
D = 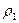
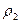
где m1 — масса первого газа,
По закону Авогадро в одинаковых объёмах любых газов при одних и тех же условиях содержится равное число молекул. Следовательно, их массы относятся друг к другу как их молярные массы
Так как m1 / m2 – плотность первого газа по второму, то
Молярную массу газа можно вычислить также, пользуясь уравнением Менделеева – Клайперона
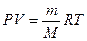
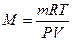
где P – давление, Па;
М – молярная масса, кг/моль;
R — молярная газовая постоянная, равная 8,314 Дж/(моль∙К);
Т – абсолютная температура, К.
Экспериментальная часть
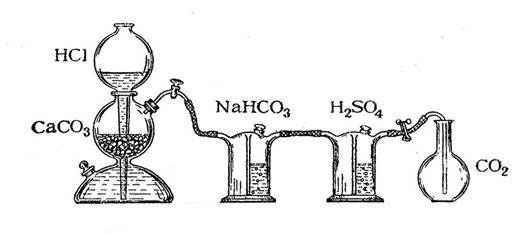
Определение молекулярной массы оксида углерода (IV).
Определение молекулярной массы оксида углерода (IV) проводится в приборе, изображённом на рис.1. Оксид углерода (IV) получается в аппарате Киппа действием 10%-ой соляной кислоты на мрамор:
Оксид углерода (IV) подвергают очистке, пропуская последовательно через растворы NaHCO3 и H2SO4.
Рисунок 1. Аппарат Кипа
Взвесить колбу с пробкой на технохимических весах с точностью до 0,01г. Данные записать. Наполнить колбу оксидом углерода (IV), опустив газоотводную трубку до дна колбы. Закрыть колбу пробкой (пробка должна входить на ту же глубину, что при взвешивании колбы) и вновь взвесить. Чтобы быть уверенным в том, что воздух из колбы полностью вытеснен, и она целиком наполнена оксидом углерода (IV), надо, взвесив колбу, ещё раз на несколько минут опустить в неё газоотводную трубку, опустить и вновь взвесить колбу, повторяя эту операцию до получения постоянной массы колбы. Массу колбы с оксидом углерода (IV) записать. Определить объём колбы, наполнив её водой до пробки, затем измерить объём воды мерным цилиндром и записать результаты. Отметить и записать показания термометра и барометра во время опыта.
Форма записи наблюдений и обработка результатов.
| 1. | Масса колбы (с пробкой) с воздухом – m1, г |
| 2. | Масса колбы (с пробкой) с оксидом углерода (IV) – m2, г |
| 3. | Объём колбы – V, мл |
| 4. | Температура – t, 0 С |
| 5. | Давление – Р1, мм рт.ст. |
По полученным данным вычислить молекулярную массу оксида углерода (IV) с помощью уравнения Менделеева – Клапейрона, исходя из относительной плотности оксида углерода (IV) по водороду, если известно, что масса 1л Н2 при н.у. 0,09г.
В конце опыта вычислить относительную ошибку в процентах:
Вопросы и задачи.
1. Как следует формулировать закон Авогадро? Что показывает число Авогадро?
2. Что называется относительной плотностью газа?
3. Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какова плотность по воздуху азота N2, хлора Сl2 и оксида углерода (II) СО?
5. Что тяжелее: сухой углекислый газ или равный объём того же газа, содержащего водяные пары?
6. Масса 1 л газа при нормальных условиях 1,43 г. Чему равна молекулярная масса газа?
7. Вычислить молекулярную массу газа, если относительную плотность его по воздуху равна 0,966.
8. Плотность газа по воздуху 1,17. Определить молекулярную массу газа.
9. Вычислить относительную плотность по воздуху газов: NH3, CH4, N2.
10. Вычислить относительную плотность по воздуху газов: N2O, NO, F2.

11. Вычислить какой объём (н.у.) займут 3,5 г азота; 640 г кислорода; 110 г углекислого газа; 70 г оксида углерода?
12. Какие объёмы занимают при н.у. следующие количества газов: 1 г водорода; 1 г кислорода и 1 г углекислого газа?
13. Сколько молекул содержится в 1 мл водорода при н.у.?
14. Плотность газа по водороду 17. Какова масса 1 л этого газа при н.у.? Какова его плотность по воздуху?
15. Плотность газа по воздуху 1,52. Какой объём займут при н.у. 5,5 г этого газа?
16. Какой объём займут 2∙10 23 молекул хлора при 27 0 С и 600 мм рт. ст.
17. Масса 87 мл пара при 62 0 С и 758 мм рт. ст. равна 0,24 г. Вычислить молекулярную массу вещества.
18. Вычислить массу 1 м 3 воздуха при 17 0 С и 624 мм рт. ст.
19. Вычислить объём, который займёт при 17 0 С и 1 атм. 1кг воздуха.
20. Из опыта найдено, что газ, собранный над водой, при 25 0 С имеет объём 600 мл при атмосферном давлении 97,325 кПа. Вычислить, чему равен объём сухого газа при нормальных условиях.
21. В стальном баллоне ёмкостью 20 л находится кислород под давлением в 12 кПа при температуре 17 0 С. Вычислите массу кислорода в баллоне.
22. Вычислите молекулярную массу газа тремя различным способами, если известно, что массы 1 л воздуха и водорода при н.у., соответственно равны 1,29 и 0,09 г, а масса 1 л газообразного вещества при тех же условиях равна: а) 3,57 г; б) 0,76 г; в) 3,17 г; г)2,058 г; д) 4,82 г; е) 1,965 г; ж) 1,25 г; з) 2,86 г.
Источник
Способы определения молекулярных масс газов
По закону Авогадро равные объемы газов, взятые при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные их молярные массы:
Здесь 



Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму.
Например, при нормальных условиях масса диоксида углерода в объеме 1 л равна 1,98 грамм, а масса водорода в том же объеме и при тех же условиях — 0,09 грамм, откуда плотность диоксида углерода по водороду составит:
Обозначим относительную плотность газа 
Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду, как самому легкому из всех газов. Поскольку молярная масса водорода равна 2,0158 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид
или, если округлить молярную массу водорода до 2:
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим:
Нередко также молярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль.
Обозначив плотность исследуемого газа по воздуху через 
Молярную массу вещества (а следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 
Пример. 0,7924 грамм хлора при 

Находим массу хлора, содержащегося в объеме 
Следовательно, молярная масса хлора равна 71 г/моль, а относительная молекулярная масса хлора равна 71.
Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля — Мариотта и Гей-Люссака
Здесь V объем газа при давлении Р и температуре Т; 



Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа — уравнением Клапейрона — Менделеева
где Р — давление газа, 


Если объем газа выражен в литрах, то уравнение Клапейрона — Менделеева приобретает вид
Описанными способами можно определять молекулярные массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние. Для этого навеску исследуемого вещества превращают в пар и измеряют его объем, температуру и давление. Последующие вычисления производят так же, как и при определении молекулярных масс газов.
Молекулярные массы, определенные этими способами, не вполне точны, потому что рассмотренные газовые законы и уравнение Клапейрона — Менделеева строго справедливы лишь при очень малых давлениях (см. § 11). Более точно молекулярные массы вычисляют на основании данных анализа вещества (см. § 14).
Источник
давления (1-е за единицу)
1 2,5 4
плотности (1-я за единицу)
1 2,53 4,1
рост плотности от давления отличается от линейной зависимости (и в условии оговорено, что газ не идеальный) значит надо брать не Клайперона, а Ван-дер-Ваальса или какую-нибудь экзотику вроде Дитеричи или Бертло, но в двух последних вместо молярной массы или молярного объёма фигурируют совсем другие характеристики газа.
Так что придётся к Ван-дер-Ваальсу обращаться. Там под V фигурирует молярный обём (молярная масса, делённая на плотность), но получается система из трёх уравнений, причём молярный объём аж в кубе
(p+a/V^2) (V-b) = RT. Молярную массу обозначу за M, плотность за ro
pM^3/ro^3 – bpM^2/ro^2 + aM/ro – ab – RTM^2/ro^2 =0 и так три раза для разных (но известных) p и ro.
u,w,x,y,z константы, которые можно вычислить
u1 M^3 – b w1 M^2 + a x1 M -ab -y1 M^2 = 0
u2 M^3 – b w2 M^2 + a x2 M -ab -y2 M^2 = 0
u3 M^3 – b w3 M^2 + a x3 M -ab -y3 M^2 = 0
можно из первого вычесть второе, из второго третье, из третьего первое, член ab исчезнет
a и b линейно входят, можно из первого ур-я выразить а через b и M, из второго, подставив а, выразить b через M, в третьем уже избавиться от а и b, получив что-то жуткое относительно M, но вполне считаемое численными методами.
То есть молекулярную массу узнать можно, но “почему-то” не хочется.
По одной молекулярной массе узнать газ. Может можно, может нет, зависит от конкретной массы, а если смесь, то вообще говорить не о чем.
СO2 -> 12+2*16=44
С3 H8 -> 12*3 +8 = 44
Учитывая наработки авторов предыдущих ответов, я бы выбрал молярную массу кислорода, но двухатомные газы почти идеальные. Значит надо взять многоатомный с той же молярной массой. Однозначно подходит метанол. Муравьиный спирт не в водном растворе и так должен быть газообразным, а уж при давлениях меньше атмосферы тем более.