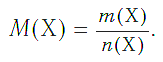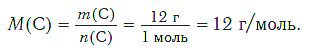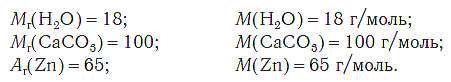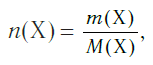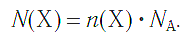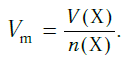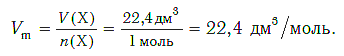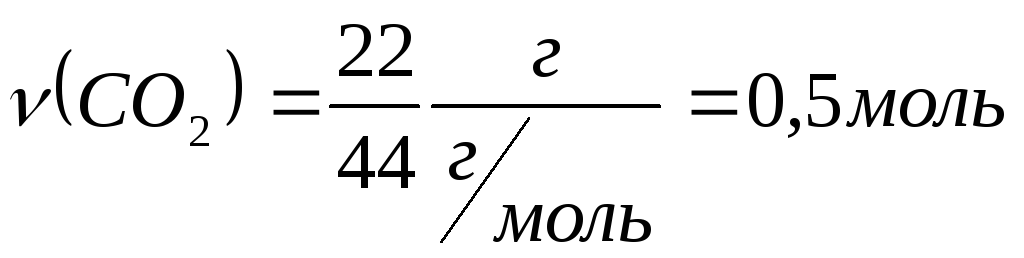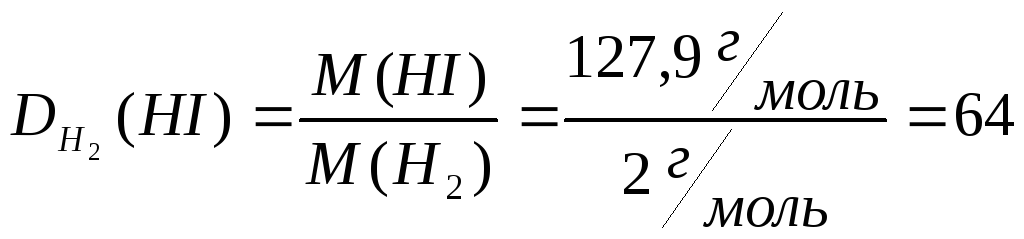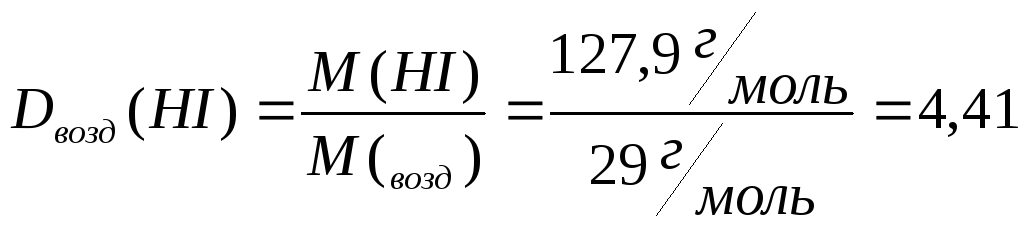Молярная масса

4.2
Средняя оценка: 4.2
Всего получено оценок: 876.
4.2
Средняя оценка: 4.2
Всего получено оценок: 876.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
M=m/v,
где m – масса вещества, а v – количество вещества.
Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
10/10
-
Регина Медникова
10/10
-
Юля Владимировна
10/10
-
Ольга Королёва
8/10
-
Дима Торопов
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 876.
А какая ваша оценка?
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
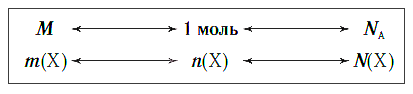
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Молярная масса — это масса одного моля любого химического вещества. Данный термин является ключевым в учебных вычислениях, поэтому калькулятор молярной массы газа наверняка пригодится школьникам и студентам.
Количество вещества и его масса
В химии количество вещества вычисляется в молях. 1 моль абсолютно любого вещества включает в себя ровно 6,02·10^23 структурных единиц. Это число было предсказано в 1811 году Амадео Авогадро и определено как количество атомов, которые содержатся в 12 г чистого углерода. Сам итальянский химик не имел понятия даже о порядке этого числа, и знал только, что оно невообразимо большое. Численно это значение было подсчитано в 1908 году австрийским физиком Иоганном Лошмидтом, но и через сотню лет химики периодически уточняют значение числа Авогадро.
Молярная масса — масса 1 моля химического вещества, которую легко подсчитать при помощи периодической таблицы. Для простого расчета требуется найти атомные массы элементов, входящих в состав соединения. Например, 1 моль простого вещества углерода имеет массу 12 г, а 1 моль сложного этанола — 46,07 г. Соответственно, 2 моля этих веществ будут иметь массу 24 г и 92,14 г. Для газообразных веществ понятие моля характеризуется одной существенной особенностью: 1 моль любого газа при нормальных условиях имеет один и тот же объем в размере 22,4 литра. Нормальными условиями считаются температура 0 градусов Цельсия и давление 1 атмосфера.
Молярный объем и молярная масса газа
Не сразу понятно, почему объем 1 моля любого газа при нормальных условиях всегда одинаков, ведь газы имеют разную массу. Сложно сравнить одноатомный гелий с химической формулой He и, например, иприт, формула которого выглядит как C₄H₈Cl₂S. Как такие разные газы могут занимать одинаковый объем? Дело в том, что абсолютно все газы можно представить в виде математической модели идеального газа, в которой расстояние между атомами и молекулами не учитывается.
Вся суть в крайне слабой связи структурных единиц, поэтому модель идеального газа пренебрегает размерами молекул. Таким образом, для подсчета объема газа важно именно количество молекул, а не их размер, а в одном моле любого вещества всегда присутствует одно и то же количество. Понимая, что газы имеют одинаковое количество вещества при одинаковой температуре и давлении становится понятно, что и объем газов будет также одинаков.
Зная объем газа легко определить его количество вещества по простой формуле:
n = V / 22,4,
где n — количество вещества, а V — объем газообразного вещества при нормальных условиях.
Например, зная, что 0,5 грамма некоторого газа в нормальных условиях занимает объем в размере 1 л, то понятно, что n = 1 / 22,4 = 0,0446 моль. Следовательно, молярная масса такого газа составит 0,5 / 0,0446 = 11,21 г/моль.
Обычно требуется определить молярную массу газа в произвольных, а не нормальных условиях. Для таких вычислений используется уравнение Менделеева-Клапейрона, из которого выделяется молярная масса:
M = m × R × T / (P × V)
Зная значения массы, температуры, давления и объема газа, легко определить его молярную массу. Обычно в уравнение идеального газа давление подставляется в паскалях, температура — в Кельвинах, а объем — в литрах. В этом случае газовая постоянная R = 8,31 Дж/Моль × К. Для удобства использования более привычных градусов Цельсия и атмосфер в калькулятор заложено пересчитанное значение универсальной газовой постоянной.
Для использования калькулятора вам требуется знать всего 4 величины.
Рассмотрим небольшой пример
Вычисление молярной массы в произвольных условиях
Определим молярную массу газа, 0,625 грамм которого занимают 300 кубических сантиметров при температуре 25 градусов Цельсия и давлении в 2 атмосферы. Введем данные в соответствующие ячейки и получим, что молярная масса газа равна 25,47 г/моль.
Вычисление молярной массы при нормальных условиях
Давайте проверим вычисления, которые мы приводили выше для газа массой 0,5 грамм и объемом 1 л. Переведем литры в кубические сантиметры и заполним соответствующие ячейки с учетом нормальных условий (P = 1, C = 0). Напомним, что в одном литре содержится 1 000 кубических сантиметров. В итоге получим, что молярная масса такого газа равна 11,2008 г/моль, что практически полностью совпадает с предыдущим результатом. Такой расчет даже точнее, чем грубая оценка молярной массы через объем газа.
Заключение
Молярная масса газа — важная величина, без которой не обходятся никакие химические расчеты газообразных веществ. Наш калькулятор пригодится школьникам и студентам младших курсов для решения задач по элементарной химии.
В равных объемах
различных газов при одинаковых условиях
(температуре и давлении) содержится
одинаковое число молекул (атомов).
Следствия из
закона Авогадро.
1. При одинаковых
условиях 1 моль любого газа занимает
одинаковый объем.
При н.у.
один моль любого газа занимает объем,
равный 22,4 литра. Этот объем называется
молярным объемомгаза (Vm
= 22,4 л/моль)
Молярный объем
можно вычислить, если известна масса 1
л газа. При н.у., т.е. Т0=273 К и давлении
Р0=101325 Па, 1 л водорода имеет массу
0,09 г, молярная масса его равна 1,008∙2=2,016
г/моль.
Тогда объем,
занимаемый 1 моль водорода равен:
Молярный объем
(Vm) –
это отношение объема газообразного
вещества к количеству этого вещества:
V–
объем вещества , л
ν – количество
газообразного вещества, моль.
Vm= 22,4 л/моль
2. Отношение масс
равных объемов различных газов при
одинаковых условиях равно отношению
их молярных масс.
где m1,m2– массы первого
и второго газов,
М1, М2– молярные массы первого и второго
газов.
Отношение m1/m2– называетсяотносительной плотностьюи обозначается D.
Тогда:
,
а М1 = DМ2
относительную
плотность газа обычно вычисляют по
отношению к водороду или воздуху.
,
М1=2D
,
М1=29D
Задача. Какой
объем займет при нормальных условиях
оксид углерода (IV)
массой 22 г?
Дано: m(CO2)
=22г.
Найти: V(СО2).
Решение:
1.Определяем количество вещества оксида
углерода (IV):
,
2. Находим объем
СО2:
V=νVm,
V( CO2)=0,5
моль∙22,4 л/моль =11,2 л
Ответ: V(CO2)
= 11,2 л.
Задача. Определите
плотности иодоводорода по водороду и
по воздуху.
Дано: М(НI)=127,9
г/моль
М(Н2)=2
г/моль
М(возд)=29 г/моль
Найти:
Решение: определяем
относительную плотность (HI)
иодоводорода по водороду:
Находим
относительную плотность иодоводорода
по воздуху:
Ответ:
Уравнение Менделеева
– Клапейрона широко используется для
определения молярной массы не только
газов, но и всех веществ, переходящих
при нагревании (без разложения) в
газообразное состояние.
Молярные массы,
определенные этими способами не вполне
точны, потому что рассмотренные газовые
законы и уравнение Менделеева –
Клапейрона строго справедливы лишь при
очень малых давлениях и высоких
температурах.
Определение молярной массы газа.
Для определения
относительной молекулярной массы
газообразного вещества М(r)(безразмерная величина) находят численно
равную ей молярную массу М (выражается
в СИ в кг/моль или г/моль). Экспериментальное
определение молярной массы газообразного
или парообразного вещества основано
на применении закона Авогадро и следствий
из него.
1. Определение молярной массы газа по относительной плотности к другому газу.
где D– относительная плотность;
М1, М2– молярные массы газов.
Тогда
М1
= DМ2
Если второй газ
водород, М(Н2) = 2 г/моль, то формула
для расчета молярных масс принимает
вид (М(н2)=2,0158 г/моль):
М = 2D(н2)
Если второй газ
воздух (М(возд)=29 г/моль), то уравнение
для расчета молярных масс:
М
= 29Dвозд
2. Определение
молярной массы газа по молярному объёму
газа.
или
P0,V0,T0– давление, объём и температура
газа при н.
у.
P,V,T- давление,
объём и температура газа при заданных
условиях.
Зная массу
(m) газа и его объём (V0)
рассчитывают массу 22,4 л, газа равную
молярной массе.
m–V0
M– 22,4
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl – хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления – 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.