Органические вещества образуют
гомологические ряды, которые имеют
общие формулы.
Это позволяет:
-
выражать молярную массу через число n
M(CnH2n
+ 2) = 12 ∙
n + 1 ∙
(2n +2) = 14n + 2;
-
приравнивать молярную массу, выраженную
через n, к истинной молярной
массе и находить n. -
составлять уравнения реакций в общем
виде и производить по ним вычисления.
При решении таких задач нужно знать и
использовать общие формулы гомологических
рядов:
-
алканы – СnH2n
+ 2 -
алкены и циклоалканы – CnH2n
-
алкины и алкадиены – CnH2n
– 2 -
арены – CnH2n
– 6 -
моногалогеналканы – CnH2n
+ 1Г -
дигалогеналканы – CnH2nГ2
-
фенолы – CnH2n
– 7OH -
предельные одноатомные спирты – CnH2n
+ 1OH, R
– COH -
альдегиды – CnH2n
+ 1 COH, R
– COH -
предельные карбоновые кислоты – CnH2n
+ 1COOH, R
– COOH -
сложные эфиры – R1
– COOR2 -
первичные амины – CnH2n
+ 1NH2,
R – NH2
вторичные амины – R1
– NH – R2
третичные амины – R1
– N – R2

R3
14. аминокислоты – CnH2n(NH2)COOH
Рассмотрим возможные варианты задач
на вывод формул органических веществ
по общим формулам.
-
Вывод формул по известной массовой доле элемента в веществе.
Порядок решения:
-
Написать общую формулу и выразить
молекулярную массу вещества через
число n; -
Подставить данные в формулу ω(Эл)
= Аr (Эл) ∙
индекс / Мr; -
Решить уравнение с одним неизвестным,
найти число n.
Задача № 1.
Определить формулу аминокислоты,
если известно, что она содержит 15,73 %
азота.
Дано: Решение:
ω
(N)
= 15,73 % 1. Oбщая формула
аминокислот:
CnH2n(NH2)COOH
М.Ф. = ?
2. Выразим через
n молекулярную массу:
Мr(CnH2n(NH2)COOH)
= 12n + 2n + 16 + 45 = 14n + 61.
3. Подставим данные
в формулу: 0,1573 = 14 ∙ 1 / 14n
+ 61.
2,2022n + 9,5953 = 14.
2,2022n = 4,4047
n = 2 Ответ:
C2H4(NH2)COOH.
Задача № 2.
Массовая доля водорода в алкане
составляет 0,1579. Найти формулу алкана.
Ответ: С8Н18.
Задача № 3.
Массовая доля углерода в алкине 87,8 %.
Определить формулу алкина.
Ответ: С6Н10.
Задача № 4.
Массовая доля кислорода в аминокислоте
равна 35,95 %. Найти молекулярную формулу
аминокислот.
Ответ: C2H4(NH2)COOH.
Задача № 5.
Массовая доля хлора в монохлоралкане
равна 55,04 %. Найти формулу моно –
хлоралкана.
Ответ: C2H5Cl.
2. Вывод формул по известным данным для нахождения истинной молярной массы
(плотности, относительной плотности,
массе и объёму).
-
Найти истинную молярную массу по
формулам: = m
/ V
М = ∙ Vm
М = D2 ∙
M2
2. Выразить молярную массу через
n и приравнять её к
истинной.
3. Решить уравнение с одним
неизвестным, найти число n.
Задача № 1.
Пары одного из монобромалканов в 68,5
раз тяжелее водорода. Найти формулу
монобромалкана.
Дано:
D
H2
= 68,5 Решение:

1. Общая формула
монобромалканов – CnH2n+1Br;
М.Ф. = ? 2. Найдём истинную молярную
массу:
M = DH2
∙ 2 = 68,5 ∙ 2 = 137 (г/моль);
3. Выразим М через n:
M(CnH2n
+ 1Br) = 12n + 2n + 1 + 80 = 14n
+ 81
Приравняем: 14n
+ 81 = 137
14n
= 56
n
= 4
Ответ: С4H9Br.
Задача № 2.
Плотность газообразного алкина равна
2,41 г/л. Найти его молекулярную формулу.
Ответ: С7Н12.
Задача № 3.
Относительная плотность паров альдегида
по воздуху равна 1,517. Найти его молекулярную
формулу.
Ответ: СН3СОН.
Задача № 4.
Относительная плотность паров первичного
амина по кислороду – 2,719.
Определить его молекулярную формулу.
Ответ: C5H11NH2.
Задача № 5.
Найти молекулярную формулу алкина,
если 5,6 л его имеют массу 10 г.
Ответ: С3Н4.
3. Вывод формул по уравнениям
реакций в общем виде, если известны
данные для двух веществ.
Порядок решения:
-
Составить уравнение реакции в общем
виде. -
Выразить молярные массы неизвестных
веществ через число n. -
Найти количества двух веществ по
формулам:
= m /M
= V
/ Vm
4. Составить уравнение, приравняв
найденные количества веществ с
учётом соотношения числа моль этих
веществ по уравнению (определяют по
коэффициентам).
5. Решить уравнение с одним
неизвестным, найти число n
и записать формулу.
Задача № 1.
При взаимодействии предельного
одноатомного спирта массой 3 г с избытком
натрия было получено 0,56 л водорода.
Определить формулу спирта.
Дано:
m
спирта = 3г Решение:
V(H2)
= 0,56л 1. Напишем уравнение реакции
в общем виде:
2
CnH2n
+ 1 OH + 2Na
H2
+ 2CnH2nONa
М.Ф. = ?
2 моль 1
моль
2. Выразим
молярную массу спирта через число n:
M(CnH2n
+ 1OH) = 12n
+ 2n + 1 + 16 + 1 = 14n
+ 18(г/моль).
3. Найдём количества
веществ:
(СnH2n
+ 1OH) = m
/ M = 3г / 14n
+ 18г/моль =
= 3 / 14n
+ 18 моль
(Н2) = V
/ Vm
= 0,56л / 22,4г/моль =
0,025 моль.
4. Из уравнения
реакции видно, что
(СnH2n
+ 1OH) = 2 ∙ (H2)
5. Cоставим
уравнение: 3 / 14n
+ 18 = 2 ∙ 0,025
n = 3
Ответ: С3Н7ОН.
Задача № 2.
При сгорании 13,2г алкана образовалось
20,16л углекислого газа. Найти формулу
алкана.
Дано:
m
алкана = 13,2г Решение:
V(CO2)
= 20,16л 1. Напишем уравнение реакции
горения в общем виде:

CnH2n
+ 2 + (3n
+ 1 / 2)O2
nCO2
+ (n + 1)H2O
М.Ф. = ? 1 моль
n
моль
2. Выразим молярную
массу алкана через n:
M(CnH2n
+ 2) = 12n + 2n
+ 2 = 14n + 2г/моль
3. Найдём количества
веществ:
(CnH2n
+ 2) = m /M
= 13,2г / (14n +
2)г/моль =
= 13,2 / 14n
+ 2 моль
(CO2)
= V / Vm
= 20,16 / 22,4г/моль = 0,9 моль
4. Из уравнения
реакции видно, что:
n ∙
(CnH2n
+ 2) = (CO2)
5. Составим
уравнение: n ∙ 13,2 / 14n
+ 2 = 0,9
n = 3
Ответ: С3Н8.
Задача № 3.
При взаимодействии 2,9г неизвестного
альдегида с аммиачным раствором оксида
серебра получается 10,8г металла. Определить
формулу альдегида.
Ответ: С3Н6О.
Задача № 4.
В результате реакции предельного
одноатомного спирта с 18,25г хлороводорода
получили органический продукт массой
46,25г и воду. Определить молекулярную
формулу спирта.
Ответ: С4Н9ОН.
Задача № 5.
Для сжигания 5,8г алкана потребовалось
14,56л (н.у.) кислорода. Определить формулу
алкана.
Ответ: С4Н10.
Задача № 6.
К 10,5г алкена присоединяют 5,6л бромоводорода
(н.у.).
Найти формулу алкена.
Ответ: С3Н6.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.2015398.43 Кб285.pdf
- #
- #
- #
- #
- #
- #
- #
- #
Установление формулы органического вещества
Установление строения химического соединения является предметом научного исследования. Сложность данной проблемы зависит от сложности строения соединения. Первым этапом исследования, как правило, является определение молекулярной формулы вещества. Рассмотрим некоторые способы установления формул органических веществ на достаточно простых примерах.
Пример 1. Более двух столетий назад химики уже умели определять качественный и количественный состав веществ. Например, было известно, что в состав одного из органических веществ входят углерод и водород, причём массовая доля углерода составляет 75 %, а водорода — 25 %. То есть в 100 г вещества содержится 75 г углерода и 25 г водорода. Используя эти данные, определите формулу органического вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его молекулярную формулу можно представить в виде CxHy. Таким образом, решение задачи сводится к нахождению индексов x и y в формуле вещества. Индексы x и y в формуле показывают количества атомов углерода и водорода в молекуле органического вещества, поэтому на первом этапе решения подобных задач необходимо найти простейшее целочисленное соотношение между количеством атомов углерода и водорода в неизвестном веществе:
x : y = n(C) : n(H).
По условию, масса атомов углерода равна 75 г, водорода — 25 г. Тогда:
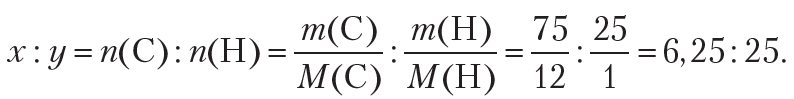
Точность промежуточных вычислений должна соответствовать точности исходных данных, то есть промежуточные значения должны содержать не меньше значащих цифр, чем данные задачи.
Видно, что полученное соотношение не является целочисленным. Чтобы получить целочисленные значения индексов x и y, выполняют следующие действия: сначала все числа полученного соотношения делят на наименьшее (в одном случае уже будет единица), и при необходимости умножают полученные числа на натуральное число (2, 3 и т. д.) для получения целочисленного соотношения:
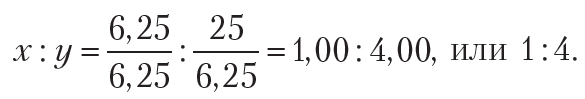
Тогда формула соединения — CH4. Это вещество нам хорошо известно, оно называется метан.
О т в е т: СН4.
Пример 2. Некоторое органическое вещество состоит из углерода и водорода. Массовая доля углерода в веществе составляет 82,8 %. Установите молекулярную формулу вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его формула — CxHy. В условии задачи даны массовые доли элементов в веществе. В таких случаях при решении задачи удобно рассмотреть определённую массу вещества, которую обычно принимают равной 100 г. В этом случае массовые доли элементов будут совпадать по величине с их массами. Тогда простейшее целочисленное соотношение индексов в формуле вещества:
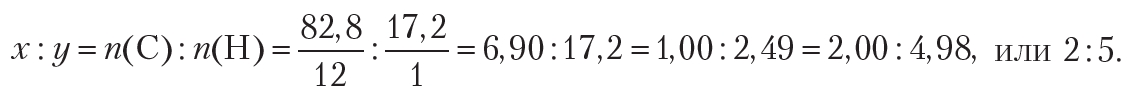
Следовательно, простейшая формула органического вещества — С2Н5. Устойчивого органического вещества с такой формулой не существует. Действительно, формула С2Н5 соответствует этильному радикалу. Чтобы определить истинную формулу органического вещества, будем учитывать, что удвоение, утроение и т. д. индексов в формуле не изменяет соотношение между ними. Удвоив индексы в простейшей формуле С2Н5, получим формулу С4Н10. Эта формула соответствует углеводороду бутану. Таким образом, истинная формула вещества — С4Н10.
О т в е т: С4Н10.
В рассмотренных примерах для определения формулы органического вещества нам было достаточно знать лишь массовые доли элементов в веществе. В то же время, в некоторых случаях, зная лишь массовые доли элементов в веществе, можно определить только простейшую, но не истинную формулу. В таких случаях для установления истинной формулы необходимы дополнительные данные. Как правило, это сведения о молярной массе соединения.
Пример 3. Молярная масса углеводорода равна 42 г/моль. Массовая доля углерода в углеводороде составляет 85,7 %. Установите молекулярную формулу углеводорода.
Формула углеводорода — CxHy. Найдём простейшее целочисленное соотношение индексов в формуле вещества:
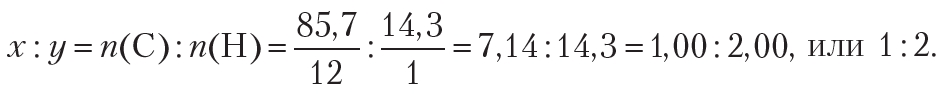
Следовательно, простейшая формула углеводорода — СН2. Удвоив индексы в простейшей формуле СН2, получим формулу С2Н4. Эта формула соответствует углеводороду этилену. Если утроить индексы в простейшей формуле СН2, то получится формула С3Н6. Данная формула соответствует углеводороду пропилену. То есть, найденному соотношению индексов соответствует множество веществ, поэтому в данном случае, используя лишь массовые доли элементов, невозможно установить истинную формулу вещества.
Для установления истинной формулы сравним молярную массу углеводорода с молярной массой простейшей формулы CH2:
![]()
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2 в 3 раза. Тогда истинная формула углеводорода — C3H6.
О т в е т: С3Н6.
В составе органических соединений, наряду с углеродом и водородом, часто присутствует кислород. Выведем молекулярную формулу кислородсодержащего соединения.
Пример 4. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Простейшее целочисленное соотношение индексов в формуле вещества:
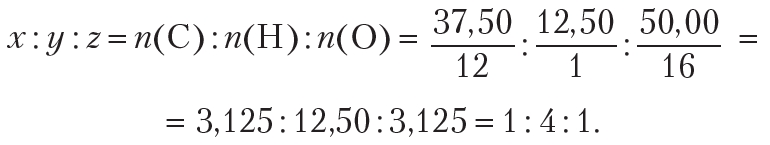
Простейшая формула вещества СН4О. Этой молекулярной формуле соответствует метиловый спирт ![]() .
.
О т в е т: СН4О или ![]() .
.
В рассмотренных примерах для установления формул мы использовали сведения о массовых долях элементов в веществе. Формулу органического вещества можно вывести также на основании данных эксперимента по сжиганию определённой массы органического вещества.
Пример 5. В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.
Поскольку при сжигании вещества образовались только углекислый газ и вода, то в состав вещества могли входить лишь атомы углерода, водорода и кислорода. Тогда формула вещества — CxHyOz. Соотношение индексов в формуле будем находить из условия:
x : y : z = n(C) : n(H) : n(O).
Составим схему реакции:
![]()
Из схемы реакции видно, что углерод из органического вещества переходит в CO2, водород — в H2O. Таким образом количества углерода и водорода в CO2 и H2O будут такими же, как в органическом веществе.
Найдём количество углерода в CO2:
![]()
В молекуле воды содержится два атома водорода, следовательно, количество (моль) водорода в два раза больше количества воды:
![]()
Определим количество (моль) атомов кислорода в веществе. Для этого рассчитаем массы углерода и водорода в данной порции вещества:

Рассчитаем массу и количество кислорода в веществе:
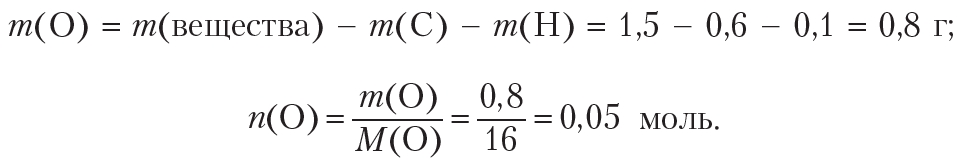
Простейшее целочисленное соотношение индексов в формуле вещества:
x : y : z = n(C) : n(H) : n(O) = 0,05 : 0,1 : 0,05 = 1 : 2 : 1.
Таким образом, простейшая формула органического вещества СН2O.
Для установления истинной формулы сравним молярную массу вещества с молярной массой простейшей формулы — CH2O:
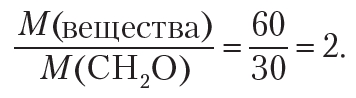
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2O в два раза. Тогда истинная формула вещества — C2H4O2. Одним из веществ, имеющих такую молекулярную формулу, является уксусная кислота СН3 — СООН.
О т в е т: C2H4O2.
Обобщим вышеизложенное. Зная количества (моль) элементов в веществе можно установить простейшую формулу вещества. Для вывода истинной формулы зачастую необходимы дополнительные данные, например сведения о молярной массе вещества.
Вывод формулы органического вещества обычно состоит из следующих этапов:
а) вычисление количества (моль) элементов в веществе;
б) определение простейшего целочисленного соотношения между вычисленными количествами элементов — установление простейшей формулы вещества;
в) установление истинной формулы вещества.
Для установления простейшей формулы достаточно знать количества (моль) элементов в веществе.
Для определения истинной формулы часто требуются дополнительные данные, например сведения о молярной массе вещества.
Цель: применение алгоритма при
решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения
задач; - закрепить навыки работы с алгоритмами;
- показать взаимосвязь химии и математики.
ХОД УРОКА
1. Оргмомент
Учитель знакомит класс с темой урока, целью и
задачами урока.
2. Повторение общих формул органических
веществ.
Учитель предлагает учащимся назвать общие
формулы алканов, алкенов, алкинов, циклоалканов,
алкадиенов, типы гибридицациии атомов углерода,
характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач
на нахождение формулы вещества по продуктам
сгорания вещества, если дана относительная
плотность.
АЛГОРИТМ №1.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) =
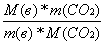
(2)
б) если СО2 дано в объеме:
n(C) =
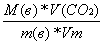
(3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда
формулу умножаем на 2 (это применимо и к N)
n(Н) = 2
(4)
4. Вычисляем молярную массу полученного
вещества.
5. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
При сгорании органического вещества массой 2, 37
г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35
г воды и азот. Относительная плотность этого
вещества по воздуху равна 2,724. Выведите
молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = ![]() = 5
= 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 ![]() = 5
= 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в
данной формулу один атом N.
Ответ: С5Н5N
4. Составление алгоритма нахождение
молекулярной формулы вещества по его
относительной плотности и массовой доле
элементов в соединении.
АЛГОРИТМ № 2
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) = ![]()
(2)
б) если w дана в долях:
n(Э) = ![]()
(3)
3. Вычисляем молярную массу полученного
вещества.
4. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
Выведите формулу вещества, содержащего 82,75%
углерода и 17,25 % водорода. Относительная
плотность паров этого вещества по воздуху равна
2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = ![]() = 4
= 4
3. Находим количество атомов Н по формуле (2)
n(Н) = ![]() = 1
= 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1),
задача решена.
Ответ: С4Н10
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по
необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г.
Углеводорода получили оксид углерода массой 35,2 г
и воду массой 14,4 г. Относительная плотность этого
углеводорода по воздуху равна 1,93. Выведите
молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества
получили 4,4 г оксида углерода и 1,8 г. воды.
Относительная плотность вещества по водороду
равна 44. Определите молекулярную формулу
вещества.
Задача 3. Выведите формулу вещества,
содержащего 81,8% углерода и 18,2 % водорода, если
относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную
формулу углеводорода, если массовая доля
углерода равна 85,75, а водорода –14,3%.
Относительная плотность этого вещества по азоту
примерно равна 2.
6. Домашнее задание
Гара Н.Н., Горбусева Н. И. Сборник задач. –
М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D – относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород – CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
Молярная масса


4.2
Средняя оценка: 4.2
Всего получено оценок: 877.
4.2
Средняя оценка: 4.2
Всего получено оценок: 877.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.

Таким образом, молярная масса вещества – это масса одного моля, в котором находится 6,02*10^23 элементарных частиц.
Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
M=m/v,
где m – масса вещества, а v – количество вещества.

Как найти молярную массу вещества?
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Получается, что суммарная молекулярная масса равна 98 атомных единиц массы (1*2+32+16*4). Таким образом, мы выясняли, что один моль серной кислоты весит 98 грамм.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.

Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре. Известным способом измерения объема пара является определение количество вытесненного воздуха. Такой процесс осуществляется с использованием бокового отвода, ведущего к измерительному устройству.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.

Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10
-

Регина Медникова
10/10
-

Юля Владимировна
10/10
-

Ольга Королёва
8/10
-

Дима Торопов
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 877.
А какая ваша оценка?
