Каждый, кто уже немного продвинулся в изучении химии, сталкивается с понятием «моль». Правда, большинство сразу думает о моли, которая съела за лето шубу в шкафу, но моль в химии – это совсем другая история. И вот сейчас мы в этом разберёмся.
Итак, давайте посмотрим на какую-нибудь химическую реакцию. Например, такую:
Н2+F2=2HF
Здесь 1 молекула водорода H2 реагирует с одной молекулой фтора F2 и получается две молекулы фторида водорода. Напомню, то число молекул или атомов, вступающих в реакцию или получающихся в реакции, определяется коэффициентом, то есть цифрой, стоящей перед формулой вещества. В нашем примере перед водородом не стоит ничего, но на самом деле мы можем поставить здесь единицу, то есть нам нужна 1 молекула водорода. Перед фтором тоже не стоит ничего, значит, нам нужна 1 молекула фтора. А вот перед фторидом водорода HF стоит двойка. Это означает, что у нас получилось 2 молекула фторида водорода. То есть:
Н2 + F2 = 2HF – это то же самое, что и
1 молекула H2 + 1 молекула F2 = 2 молекулы HF.
Но вы знаете, что молекулы так малы, что мы их увидеть не можем. Как же нам считать эти молекулы, вступающие в реакцию? Для этого и ввели понятие МОЛЬ.
Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12.
Это довольно мудрёное определение, но его нужно запомнить. Есть и приятный момент: в одном моле любого вещества содержится число Авогадро частиц. Вот оно, это число:
Такое число представить сложно. Вы только подумайте, миллиард – это 1 000 000 000. А в одном моле частиц 6,02*100 000 000 000 000 000 000 000! (Но чтобы не видеть по ночам кошмаров, просто запомните 6,02*10 в двадцать третьей степени).
Итак, в одном моле любого вещества содержится 6,02*10 в двадцать третьей степени частиц. Но мы же знаем, что атомы разных веществ имеют разное строение, а поэтому и разную массу. Поэтому и массы одного моля у разных веществ различаются. Чтобы разобраться в этом, давайте поедем на дачу и проведём эксперимент.
Мы точно помним, что 1 моль – это всегда одинаковое число частиц (6,02*10 в двадцать третьей степени ). Но в обычной жизни таких чисел нет, поэтому возьмём число поменьше, например, 100. Это будет наш условный экспериментальный моль. Теперь в одну кучу складываем 100 вишен, в другую кучу – 100 груш, в третью – 100 арбузов. Куча – это 1 моль. В каждую кучу мы добросовестно сложили одинаковое число частиц, верно? Но частицы эти разного вида: в одной куче вишни, в другой – груши, в третьей – арбузы. А теперь будем взвешивать. Как вы думаете, будет ли различаться масса 100 вишен, 100 груш и 100 арбузов? Конечно же, будет. При этом обратите внимание: число частиц в каждой куче одинаково, но весят эти кучи по-разному. Почему? Потому что частицы разные!
В химии всё точно так же. Если взять 1 моль водорода, 1 моль кислорода и 1 моль натрия, то масса их будет разной (вспоминаем поездку на дачу). И это важно. Но теперь возникает закономерный вопрос: а как же узнать, какова масса 1 моль водорода, 1 моль кислорода и 1 моль натрия и вообще любого вещества? Для этого вводится понятие молярная масса.
Молярная масса и есть масса 1 моля вещества.
Как её определить? Просто. Это атомная масса или молекулярная масса вещества, которую мы рассчитываем, пользуясь таблицей Менделеева. Молярная масса обозначается буквой М и выражается в г/моль (просто потому, что она показывает сколько граммов вести 1 моль). Примеры из учебника химии.
Пример 1.
Найдите массу одного моля (она же молярная масса) алюминия.
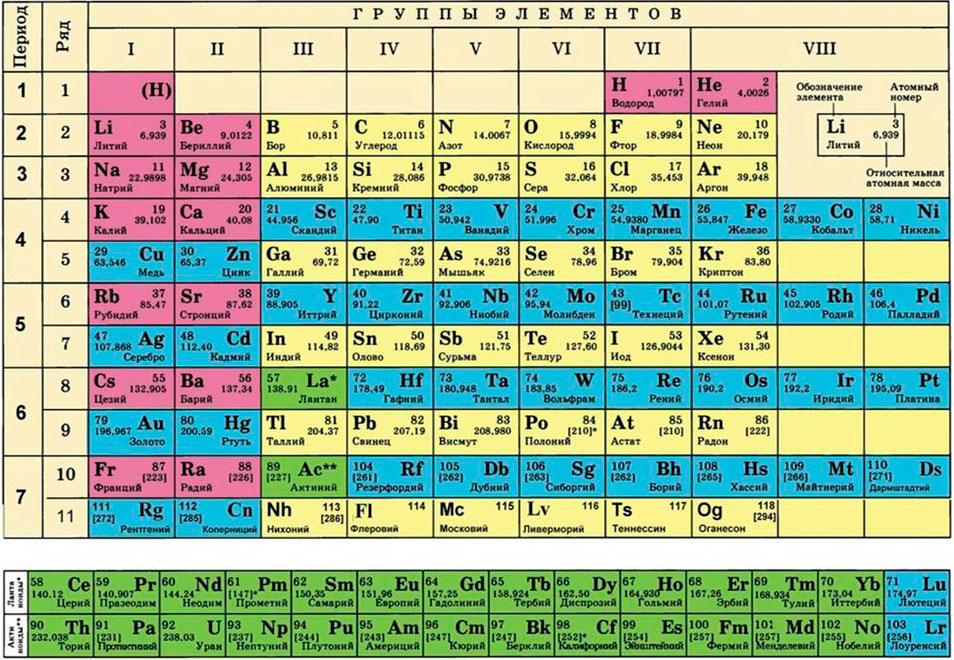
Решаем химию и смотрим в таблицу Менделеева. Видим, что атомная масса алюминия 27. Формула просто вещества алюминия – Al, то есть атом здесь один. Следовательно, молярная масса алюминия совпадает с атомной и равна 27 г/моль.
Пример 2.
Найдите молярную массу фтора.
Фтор у нас в обычных условиях – газ, поэтому молекула фтора состоит из двух атомов и выглядит так: F2. В периодической таблице находим фтор и видим, что его атомная масса 19. Следовательно, молярная масса фтора 2*19=38 г/моль.
Пример 3.
Найдите молярную массу оксида кальция.
Формула оксида кальция СаО. Опять смотрим в таблицу: атомная масса кальция 40, атомная масса кислорода 16. Молярная масса оксида кальция 40+16=56 г/моль.
Пример 4.
Найдите молярную массу оксида кремния.
Формула оксида кремния SiO2. Таблица Менделеева сообщает, что атомная масса кремния 28, кислорода – 16. Будьте внимательны, в этом вопросе подвох! В формуле оксида два атома кислорода, обязательно учтите это, чтобы ответ был верным. И он будет таким: молярная масса оксида кремния 28+16*2=60 г/моль. (16 – масса одного атома кислорода, у нас в формуле их два, поэтому мы и умножили 16 на 2!).
Пример 5.
Сложный пример от репетитора по химии. Но я рекомендую всё-таки вникнуть и разобраться, чтобы прояснить всё окончательно. Итак, ответьте, какова молярная масса серной кислоты.
Здесь придётся сосредоточиться, чтобы не запутаться. Формула серной кислоты H2SO4, то есть у нас имеется:
· 2 атома водорода
· 1 атом серы
· 4 атома кислорода.
Смотрим в периодическую таблицу и определяем атомные массы:
· атомная масса водорода – 1
· атомная масса серы – 32
· атомная масса кислорода – 16.
Переходим к расчёту:
2 атома водорода + 1 атом серы + 4 атома кислорода
2*1 + 1*32 + 4*16
В этом выражении в каждом слагаемом первый множитель – число атомов элемента, второй множитель – атомная масса. Дальше просто математика: 2*1+1*32+4*16=98. И да, молярная масса серной кислоты 98 г/моль.
Уверена, теперь вы различите моль в шкафу и моль в химии. А дальше мы будем разбираться, как взвесить на обычных весах эти моли.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
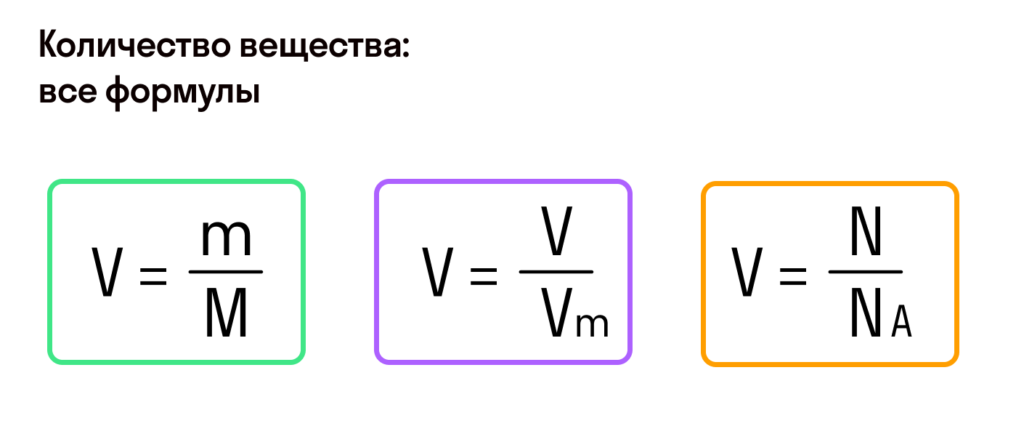
Для того чтобы разобраться с понятием «молярная масса», необходимо вспомнить важный химический термин «моль». Моль тесно связан с химической константой – числом Авогадро и химическим элементом углерод (С), который взят за основу при определении количества вещества, равного 1 молю. Помнить наизусть его значение необязательно, любой электронный или бумажный справочник легко напомнит нам, что число Авогадро (оно обозначается NА) составляет 6,02х1023. Это число частиц вещества (количество молекул или атомов), которое содержится в одном его моле. Принято считать, что в 1 моле любого химического соединения содержится такое количество вещества, которое содержат 12 г атома углерода.
Простыми словами молярную массу можно идентифицировать как «вес 1 моля химического вещества».
В международной системе единиц СИ в соответствии с принятыми стандартами молярную массу определяют в граммах на моль (г/моль). В определенных случаях ее также указывают в кг/моль, если так удобнее производить расчеты. В процессе решения задач по химии молярную массу обозначают большой буквой «М».
Молярную массу не надо путать с весом молекулы, атома и иона, эти понятия отнюдь не тождественны, хотя их числовые величины могут и совпадать. Далеко не для всех химических веществ молярная масса и молекулярный вес равны друг другу. Молярная и молекулярная массы соединений имеют одинаковые значения для химических веществ, состоящих из атомов.
Не путайте молярную массу с весом молекулы!
Рассмотрим это на примере галогена из 7-й группы таблицы Менделеева – хлора (CL):
• атом хлора Cl «весит» 35,5;
• ион хлора Cl– – 35,5;
• молекула хлора Cl2 – 71.
Отличаются между собой эти значения и для другого газа – азота (N2):
• молекула азота, состоящая из 2 атомов, имеет массу 28;
• атом элемента N – 14.
Вывод напрашивается сам по себе – молярные массы элемента, иона и вещества могут существенно различаться.
Как вычислить молярную массу
Чтобы рассчитать значение молярной массы химического вещества, целесообразно придерживаться следующего алгоритма:
- Подготовить таблицу Менделеева (она может понадобиться для определения валентности и атомных масс химических элементов).
- Правильно составить химическую формулу вещества, пользуясь знаниями об основных классах неорганических соединений и их свойствах и сведениями, почерпнутыми из таблицы Менделеева, например:
- углекислый газ – СО2;
- серная кислота – Н2SO4;
- хлорид кальция CaCL2;
- гидроксид алюминия Al(OH)3.
Прежде всего при составлении формул соединений необходимо помнить о валентности элементов, из которых они состоят.
- Определяем молекулярный вес и молярную массу каждого из вышеуказанных химических соединений (вес атомов опять берем в ячейке химического элемента в таблице Менделеева):
- СО2 – 1 атом углерода (12) + 2 атома кислорода (32) = 44;
- Н2SO4 – 2 атома водорода (2) + 1 атом серы (32) + 4 атома кислорода (64) = 98;
- CaCL2 – 1 атом кальция (40) + 2 атома хлора (71) = 111;
- Al(OH)3 – 1 атом алюминия (27) + 3 атома водорода (3) + 3 атома кислорода (48) = 78.
Как видно из приведенных примеров, для выполнения необходимых вычислений достаточно сложить значения атомных масс элементов, находящихся в составе сложных веществ. Для простых веществ следует взять этот показатель, относящийся к соответствующему элементу, из таблицы Менделеева, принимая во внимание количество атомов в одной молекуле вещества (индекс в его формуле).
- Определяем массу одной молекулы каждого из этих неорганических соединений с помощью числа Авогадро:
- m(СО2) = Мr(СО2) : NA= 44:6,02·1023 = 7,3·1023 г;
- m(H2SO4) = Мr(H2SO4) : NA= 98:6,02·1023 = 16,28·1023 г;
- m(CaCL2) = Мr(CaCL2) : NA= 111:6,02·1023 = 18,5·1023 г;
- m(Al(OH)3) = Мr(Al(OH)3) : NA= 78:6,02·1023 = 13,0·1023 г.
Практическое значение молярной массы вещества
Термин «молярная масса» широко используется в таких научных дисциплинах, как химия и физика. Значения молярных масс соединений часто требуется вычислять в химической промышленности при разработке полимерных комплексов и в ряде других ситуаций. Современную фармакологию также трудно представить без проведения расчетов этой величины.
Молярная масса – одно из ключевых понятий при проведении биохимических исследований.
Таким образом, молярную массу необходимо уметь вычислять не только ученым-химикам и сотрудникам химических лабораторий, но и специалистам из ряда других областей науки, фармакологам и работникам ряда отраслей промышленного производства.
Тест по теме “Молярная масса”
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Содержание
- Что такое молярная масса
- Как найти молярную массу
- Какова важность знания молярной массы вещества
Молярная масса является физическим свойством веществ. Это очень полезно при анализе, сравнении и прогнозировании других физических и химических свойств, таких как плотность, температура плавления, температура кипения и количество вещества, которое реагирует с другим веществом в системе. Существует более одного метода для расчета молярной массы. Некоторые из этих методов включают использование прямого уравнения, добавление атомных масс различных элементов в соединении и использование повышения точки кипения или понижения точки замерзания. Некоторые из этих основных методов будут кратко обсуждаться в этой статье.
Ключевые области покрыты
1. Что такое молярная масса
– определение, уравнение для расчета, объяснение
2. Как найти молярную массу
– Методы определения молярной массы
3.Какова важность знания молярной массы вещества
– Применение молярной массы
Ключевые термины: число Авогадро, точка кипения, калузиус-клапейрон, криоскопическая константа, эбуллиоскопическая константа, точка замерзания, точка плавления, молярность, молярная масса, молекулярная масса, осмотическое давление, относительная атомная масса
Что такое молярная масса
Молярная масса – это масса моля определенного вещества. Наиболее распространенной единицей измерения молярной массы вещества является гмоль-1, Однако единица СИ для молярной массы составляет кгмоль-1 (или кг / моль). Молярная масса может быть рассчитана с использованием следующего уравнения.
Молярная масса = масса вещества (кг) / количество вещества (моль)
Моль или моль – это единица измерения количества вещества. Один моль вещества равен очень большому числу, 6,023 x 1023 атомов (или молекул), из которых состоит вещество. Этот номер называется номером Авогадро. Это константа, потому что независимо от типа атома, один моль его равен этому количеству атомов (или молекул). Следовательно, молярной массе можно дать новое определение, то есть молярная масса представляет собой общую массу 6,023 х 10.23 атомы (или молекулы) конкретного вещества. Чтобы избежать путаницы, взгляните на следующий пример.
- Соединение А состоит из молекул А.
- Соединение B состоит из молекул B.
- Один моль соединения А состоит из 6,023 х 1023 молекул.
- Один моль соединения B состоит из 6,023 х 1023 молекул B.
- Молярная масса соединения А представляет собой сумму масс 6,023 х 10.23 Молекулы.
- Молярная масса соединения B представляет собой сумму масс 6,023 х 10.23 Молекулы В.
Теперь мы можем применить это для реальных веществ. Один моль Н2О состоит из 6,023 х 1023 ЧАС2О молекулы. Общая масса 6,023 х 1023 ЧАС2Молекулы O – около 18 г. Следовательно, молярная масса Н2О составляет 18 г / моль.
Как найти молярную массу
Молярная масса вещества может быть рассчитана с использованием нескольких методов, таких как;
- Используя атомные массы
- Используя уравнение для расчета молярной массы
- От точки кипения
- От замерзания депрессии
- От осмотического давления
Эти методы подробно обсуждаются ниже.
Использование атомных масс
Молярная масса молекулы может быть определена с использованием атомных масс. Это может быть сделано просто путем добавления молярной массы каждого присутствующего атома. Молярная масса элемента приведена ниже.
Молярная масса элемента = Относительная атомная масса х постоянная молярной массы (г / моль)
Относительная атомная масса – это масса атома относительно массы атома углерода-12, и она не имеет единиц измерения. Это соотношение может быть дано следующим образом.
Молекулярный вес A = масса одной молекулы A / [масса одного атома углерода-12 x (1/12)]
Давайте рассмотрим следующие примеры, чтобы понять эту технику. Далее приведены расчеты для соединений с одним и тем же атомом, комбинации нескольких разных атомов и комбинации большого количества атомов.
• Молярная масса Н2
o Типы присутствующих атомов = два атома Н
o Относительные атомные массы = 1,00794 (H)
o Молярная масса каждого атома = 1,00794 г / моль (Н)
o Молярная масса соединения = (2 х 1,00794) г / моль
= 2,01588 г / моль
• Молярная масса HCl
o Типы присутствующих атомов = один атом Н и один атом Cl
o Относительные атомные массы = 1,00794 (H) + 35,453 (Cl)
o Молярная масса каждого атома = 1,00794 г / моль (H) + 35,453 г / моль (Cl)
o Молярная масса соединения = (1 х 1,00794) + (1 х 35,453) г / моль
= 36,46094 г / моль
• Молярная масса С6ЧАС12О6
o Типы присутствующих атомов = 6 атомов C, 12 атомов H и 6 O атома Cl
o Относительные атомные массы = 12.0107 (C) + 1.00794 (H) + 15.999 (O)
o Молярная масса каждого атома = 12,0107 г / моль + 1,00794 г / моль (H) + 15,999 г / моль (O)
o Молярная масса соединения = (6 х 12,0107) + (12 х 1,00794) + (6 х 15,999) г / моль
= 180,15348 г / моль
Использование уравнения
Молярная масса может быть рассчитана с использованием уравнения, приведенного ниже. Это уравнение используется для определения неизвестного соединения. Рассмотрим следующий пример.
Молярная масса = Масса вещества (кг) / Количество вещества (моль)
- Соединение D находится в растворе. Детали даны следующим образом.
- Соединение D является сильной основой.
- Это может выпустить один H+ ион на молекулу.
- Раствор соединения D готовили с использованием 0,599 г соединения D.
- Реагирует с HCl в соотношении 1: 1
Затем определение может быть выполнено кислотно-основным титрованием. Поскольку это сильное основание, титруйте раствор сильной кислотой (например, HCl, 1,0 моль / л) в присутствии индикатора фенолфталеина. Изменение цвета указывает на конечную точку (например, при добавлении 15,00 мл HCl) титрования, и теперь все молекулы неизвестного основания титруют добавленной кислотой. Тогда молярная масса неизвестного соединения может быть определена следующим образом.
o Количество прореагировавшей кислоты = 1,0 моль / л х 15,00 х 10-3 л
= 1,5 х 10-2 моль
o Следовательно, количество прореагировавшего основания = 1,5 х 10-2 моль
o Молярная масса соединения D = 0,599 г / 1,5 х 10-2 моль
= 39,933 г / моль
o Тогда неизвестное соединение D можно предсказать как NaOH. (Но чтобы подтвердить это, мы должны сделать дальнейший анализ).
От точки кипения
Повышение температуры кипения представляет собой явление, которое описывает, что добавление соединения к чистому растворителю увеличило бы температуру кипения этой смеси до более высокой температуры кипения, чем у чистого растворителя. Следовательно, молярная масса этого добавленного соединения может быть найдена с использованием разности температур между двумя точками кипения. Если точка кипения чистого растворителя составляет Трастворитель и точка кипения раствора (с добавленным соединением) составляет ТрешениеРазница между двумя точками кипения может быть приведена ниже.
ΔT = Tрешение – Трастворитель
Используя соотношение Клаузиуса-Клапейрона и закон Рауля, мы можем получить связь между ΔT и молярностью решения.
ΔT = Kб , M
Где Кб является эбуллиоскопической константой и зависит только от свойств растворителя и М – моляльности
Из приведенного выше уравнения мы можем получить значение для моляльности решения. Поскольку количество растворителя, используемого для приготовления этого раствора, известно, мы можем найти значение для молей добавленного соединения.
Молярность = Моль добавленного соединения (моль) / Масса чистого используемого растворителя (кг)
Теперь, когда мы знаем моли соединения в растворе и массу добавленного соединения, мы можем определить молярную массу соединения.
Молярная масса = масса соединения (г) / моль соединения (моль)
Рисунок 01: Высота точки кипения и депрессия точки замерзания
От депрессии до точки замерзания
Понижение точки замерзания противоположно повышению температуры кипения. Иногда, когда соединение добавляют к растворителю, температура замерзания раствора ниже, чем у чистого растворителя. Тогда приведенные выше уравнения немного модифицируются.
ΔT = Tрешение – Трастворитель
Значение ΔT является отрицательным значением, поскольку точка кипения теперь ниже, чем начальное значение. Молярность раствора может быть получена так же, как в методе повышения температуры кипения.
ΔT = Kе , M
Здесь Кеизвестен как криоскопическая константа. Это зависит только от свойств растворителя.
Остальные расчеты такие же, как в методе повышения точки кипения. Здесь, моли добавленного соединения также могут быть рассчитаны с использованием приведенного ниже уравнения.
Молярность = Моль соединения (моль) / Масса используемого растворителя (кг)
Затем молярную массу можно рассчитать, используя значение для молей добавленного соединения и массы добавленного соединения.
Молярная масса = масса соединения (г) / моль соединения (моль)
От осмотического давления
Осмотическое давление – это давление, которое необходимо приложить, чтобы избежать попадания чистого растворителя в данный раствор посредством осмоса. Осмотическое давление может быть дано в уравнении ниже.
∏ = MRT
Где ∏ – осмотическое давление,
М – молярность раствора
R – универсальная газовая постоянная
Т – температура
Молярность решения определяется следующим уравнением.
Молярность = Моль соединения (моль) / Объем раствора (л)
Объем раствора может быть измерен, а молярность может быть рассчитана, как указано выше. Следовательно, моли соединения в растворе могут быть измерены. Тогда молярная масса может быть определена.
Молярная масса = масса соединения (г) / моль соединения (моль)
Какова важность знания молярной массы вещества
- Молярные массы различных соединений можно использовать для сравнения температур плавления и температур кипения этих соединений.
- Молярная масса используется для определения массовых процентов атомов, присутствующих в соединении.
- Молярная масса очень важна в химических реакциях для определения количества определенного реагирующего реагента или для определения количества продукта, который можно получить.
- Знание молярных масс очень важно, прежде чем будет разработана экспериментальная установка.
Резюме
Существует несколько методов для расчета молярной массы данного соединения. Самый простой способ среди них – это добавление молярных масс элементов, присутствующих в этом соединении.
Рекомендации:
1. «Крот». Энциклопедия Британника. Encyclopædia Britannica, inc., 24 апреля 2017 года. Интернет.
Как определить молярную массу? Можно в теории как определить молярную массу того или иного вещества и пример
Мастер
(1063),
закрыт
12 лет назад
Geselle
Гений
(63461)
12 лет назад
Откуда вы. что такие вопросы задаете ?
Пример углекислый газ имеет формулу СО2. Смотрим в таблицу Менделеева. Углерод С – массовое число 12, кислород О – массовое число 16 Два кислорода и один углерод вместе в сумме имеют массу 44. Это в атомных единицах массы.
Но формула СО2 означает не только молекулу углекислого газа, но и моль этого вещества. Масса моля, т. е . числа молекул. равного числу Авогадро, будет в граммах столько же. сколько масса молекулы в относительных атомных единицах, т. е. 44 г. Таким образом, молярная масса СО2 – 44 г/моль.
LelushМастер (1063)
12 лет назад
На американском задаешь вопрос – получаешь ответ
На еврейском задаешь вопрос – тебя спрашивают в ответ
На русском задаешь вопрос и тебе на 30 страницах обсуждения объясняют какой ты мудак
Наталия ЕмельяноваВысший разум (169065)
12 лет назад
В! Добрый день! Огромное спасибо за поздравление! Не могу удержаться от комментария. Отвечая на вопрос, наверное, мысленно нужно представлять вопрошающего, чтобы быть готовым к любому комментарию.Везде побывал-в Америке, Израиле-но ОТКУДА задал вопрос до сих пор не понял.